符合“ATN”诊断框架的logopenic变异型原发性进行性失语一例
2022-02-03孙梦凡姜季委梁楠邹昕颖徐俊
孙梦凡,姜季委,梁楠,邹昕颖 ,徐俊*
(1首都医科大学附属北京天坛医院神经病学中心认知障碍性疾病科,北京100070;2国家神经系统疾病临床医学研究中心,北京 100070;3首都医科大学附属北京天坛医院全科医疗科,北京100070)
Logopenic变异型原发性进行性失语(logopenic variant primary progressive aphasia, lvPPA)是原发性进行性失语(primary progressive aphasia, PPA)的一种特殊表型,临床以进行性单词提取和复述能力损害,但语法、发音及运动语言功能相对保留为主要特征[1]。LvPPA的病理改变多为脑内β-淀粉样蛋白(β-amyloid, Aβ)沉积以及优势半球颞叶及顶叶皮质萎缩,因此,lvPPA通常被认为是阿尔茨海默病(Alzheimer′s disease, AD)的一种非典型临床表现[2,3]。然而,AD样病理改变在lvPPA发病机制中的作用仍有待阐明,AD与lvPPA之间的直接联系亦未建立。2018年,美国国立衰老研究院-阿尔茨海默病协会(National Institute on Aging-Alzheimer′s Association,NIA-AA)发布的“ATN”研究框架中建议,以Aβ斑块(A)、神经纤维缠结Tau蛋白(T)和神经变性(N)生物标志物作为AD的诊断依据,这促使AD的定义向生物学转变,为临床早期识别AD病理改变提供了证据[4]。本文报道1例基于“ATN”标准确诊为符合AD病理改变的lvPPA患者,并采用人工智能技术对其颅脑萎缩情况进行定量分析,进一步探讨lvPPA的临床、影像和病理改变与AD的相关性,为lvPPA的早期诊断和治疗提供理论依据。
1 临床资料
患者女性,59岁,右利手,中专学历。因“进行性找词和复述困难3年,记忆力下降1年”于2021年5月25日收入首都医科大学附属北京天坛医院认知障碍性疾病科。患者3年前出现找词困难,表现为不能找到正确的词语表达自己的观点,伴语速变慢,能和家人进行简单的对话交流,但对长句子的表述和复述能力下降,伴命名障碍;1年前出现记忆力下降,表现为忘记刚说过的话、做过的事情。无性格及人格改变,无行为异常。否认高血压、糖尿病、冠心病和脑血管病史;否认吸烟、酗酒、滥用药物和毒物接触史;否认精神疾病史和家族类似疾病史。
神经查体:意识清楚,构音清,语言障碍突出,语速缓慢,偶有找词困难,复述困难,听理解力减退。记忆力、计算力、定向力及理解力下降。颅神经查体未见明显异常。四肢肌力Ⅴ级,肌张力正常,双侧指鼻试验、跟-膝-胫试验稳准,Romberg征阴性。双侧深浅感觉正常。四肢腱反射对称。双侧Hoffmann征及Babinski征阴性。实验室检查:血常规、肝肾功能、离子、甲状腺功能、维生素B12、叶酸、同型半胱氨酸及肿瘤标志物均未见明显异常。载脂蛋白E(apolipoprotein E,ApoE)基因:ApoEε3/3。腰椎穿刺检查:脑脊液(cerebrospinal fluid, CSF)无色透明,压力100 mmH2O(1 mmH2O=0.009 kPa),细胞数、蛋白质、糖以及氯化物均正常。CSF Aβ和Tau蛋白检测(北京海思特医学检验实验室,ELISA法)示Aβ42196.02 pg/ml(正常值≥651 pg/ml)、Aβ407290.3 pg/ml(正常值≥7 000 pg/ml)、Aβ42/Aβ40比值0.026(正常值>0.05)、总Tau蛋白509.84 pg/ml(正常值≤399 pg/ml)、磷酸化Tau181蛋白37.23 pg/ml(正常值≤50 pg/ml),提示脑内Aβ沉积,神经细胞损伤。神经精神心理检查:西方失语症成套测验示自发性语言流畅性尚可,对句子的理解和复述能力下降,对部分常见物品存在命名障碍,提示感觉性失语,失语指数67.5;简易智能精神状态量表得分15分(定向力7分,即刻回忆2分,注意力及计算力1分,回忆能力2分,命名2分,语言重复1分);蒙特利尔认知评估量表得分15分(视空间与执行功能2分,命名3分,注意3分,语言1分,定向力6分);神经精神问卷得分4分(抑郁1分,焦虑1分,淡漠1分,食欲和进食障碍1分);日常生活能力得分20分。头颅核磁共振(magnetic resonance imaging, MRI)示脑内缺血性白质病变(改良Fazekas分级1级),轻度脑萎缩(左侧顶叶及左侧颞叶为著)(图1)。18氟-氟脱氧葡萄糖(18F-flurodeoxyglucose,[18F]-FDG)正电子发射计算机断层显像/计算机断层扫描(positron emission tomography/computed tomography, PET/CT)示双侧顶叶、颞叶(左侧显著),左侧额叶及左侧后扣带回区代谢明显降低(图2)。本例患者以单词提取和复述能力受损为主要表现;优势半球顶叶及颞叶萎缩、低代谢;CSF检查提示脑内Aβ沉积,呈现AD病理学特征,符合2011年lvPPA的诊断标准[5]。最终患者确诊为lvPPA。遂予以多奈哌齐2.5 mg 1次/d治疗,1周后增加剂量至5 mg 1次/d。出院后6个月随访,患者病情稳定,语言和记忆功能较前无明显加重,复查头颅MRI并于脑医生(Dr. Brain)平台(基于人工智能技术和人群脑影像大数据的定量分析平台)上进行定量分析示患者双侧额叶、顶叶及颞叶均有不同程度的萎缩,其中以左侧的额中回、颞中回、缘上回和楔前叶萎缩为著,与PET/CT低代谢区基本一致。

图1 患者住院期间颅脑MRI平扫结果Figure 1 MRI plain scan results of brain during hospitalizationMRI-T1 shows that the left parietal sulci and fissures are slightly wider (A), the left temporal cortex is thinned, and the sulci and fissures are wide and deep (B); FLAIR shows paraventricular white matter hyperintensive, and modified Fazekas grade 1 (C, D)MRI: magnetic resonance imaging; FLAIR: fliud attenuated inversion recovery.
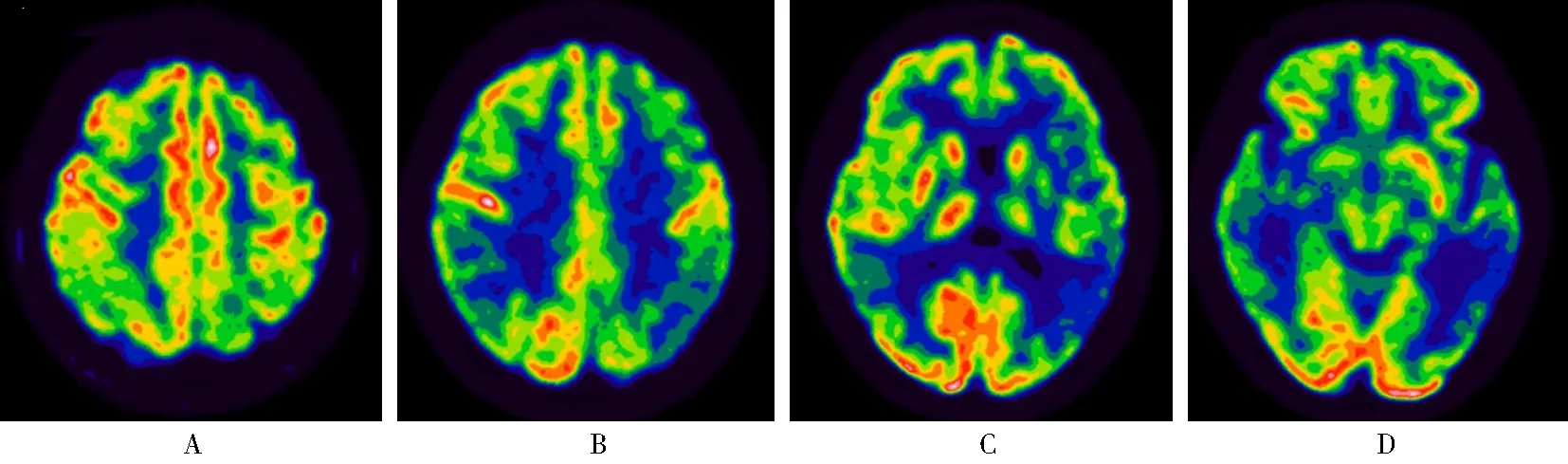
图2 患者住院期间PET/CT检查结果Figure 2 PET/CT examination results during hospitalizationA: bilateral parietal lobes metabolism decrease; B: metabolism of left frontal lobe, bilateral parietal lobes, and left posterior cingulate gyrus decrease; C, D: bilateral temporal lobes metabolism decrease, especially on the left side.PET/CT: positron emission tomography/computed tomography.
2 讨 论
20世纪80年代,Mesulam提出PPA这一概念,指以进行性语言功能障碍为首要突出主诉并且在疾病早期不合并痴呆的一组临床综合征[6]。此后约20年间,PPA被分为语义型PPA(semantic variant primary progressive aphasia, svPPA)和非流利型PPA(nonfluent variant primary progressive aphasia, nfvPPA)两种类型。nfvPPA患者主要表现为言语表达费力、电报式语言和语法错误;svPPA患者以词语理解和物体命名能力受损为表现[5,7,8]。但这两种类型并不能解释所有PPA的临床特征。2004年,Gorno-Tempini等[9]将“第三种”变异型的PPA定义为lvPPA。LvPPA患者的语言流畅性介于svPPA和nfvPPA之间,典型特征包括单词提取困难和对语音的短期记忆障碍,常出现对复杂语句的理解和复述困难情况。此外,lvPPA患者还经常合并有显著的语言以外的认知功能减退,包括记忆力下降及视空间能力受损等[10]。Foxe等[11]的纵向研究发现,与nfvPPA和svPPA相比,lvPPA患者的语言和认知功能下降速度更快,平均年下降率为16.3%(95%CI-16.3%~-21.0%)。本例患者在6个月随访时语言和记忆功能无明显变化,遗憾的是,受新型冠状病毒肺炎疫情的影响,未能对患者进行1年随访。
不同亚型的PPA在影像学上表现为不同区域的受累。在颅脑MRI上,PPA通常表现为大脑皮层非对称性萎缩(优势侧为主)。lvPPA患者通常在左侧颞叶、顶叶出现萎缩,而nfvPPA患者在左侧额叶和岛叶出现萎缩,多数svPPA患者以颞极、海马及杏仁核萎缩为著[1]。PET检查往往发现上述脑区的代谢减低[8]。一项对PPA患者的颅脑结构性MRI进行定量分析的2年随访研究发现[12],随着疾病进展,nfvPPA和svPPA在受累脑区的萎缩加剧,而lvPPA则引起额叶、枕叶及海马等更广泛的区域萎缩。本例患者在颅脑结构性MRI定量分析中除左侧颞叶、顶叶萎缩显著外,左侧额叶、海马以及枕叶均有不同程度的萎缩,这与上述研究结果一致,也与本例患者PET/CT所示的低代谢部位相匹配。MRI的定量分析具有无创、简便及经济等优点,可推广应用于临床,以明确脑萎缩的部位、程度以及进展情况,从而辅助PPA的早期诊断及分类。
组织病理学发现,不同的PPA亚型存在特定的致病蛋白在不同部位的异常沉积。LvPPA患者多在优势半球颞叶、顶叶区域出现Aβ沉积[13],故该型常被认为是AD的非典型临床表现。而nfvPPA和svPPA则分别在优势半球额叶出现Tau病理和颞叶出现TAR DNA结合蛋白43病理改变,因此,这两种类型也常分属于额颞叶变性疾病(frontotemporal lobar degeneration,FTLD)的临床亚型[2]。目前,主要通过PET和CSF检查明确脑内的AD病理改变[14]。Aβ PET检查示脑内Aβ沉积,CSF示Aβ42或Aβ42/Aβ40比值下降、磷酸化Tau水平增高,则提示AD病理改变[4]。此外,Tau PET检查也能够识别AD相关的Tau病理改变。一项评估Tau PET显像剂[18F]flortaucipir对AD和非AD病理识别能力的大型多中心研究发现,该示踪剂区分AD和FTLD的ROC曲线下面积(area under the curve, AUC)为0.93(95%CI0.89~0.97)[15]。本例患者通过CSF检查发现Aβ42及Aβ42/Aβ40比值下降,总Tau蛋白水平升高,符合AD病理改变,在长期随访中或许能够检测到磷酸化Tau水平增高。
综上,本文报道了1例临床表现为lvPPA的患者,通过CSF检查发现其符合“ATN”诊断框架,明确为AD的一种变异类型。此外,我们还进行了颅脑结构性MRI定量分析检查,具体明确了该患者的脑萎缩部位,为临床诊断PPA提供了新的思路。囿于结构性磁共振早期萎缩征象不明显、PET/CT价格昂贵且具有辐射性,颅脑定量分析或可作为lvPPA早期诊断和分类、监测病情进展的辅助手段。随着“ATN”诊断标准在临床中的不断应用,期待未来开展更多大样本临床研究,以进一步探索lvPPA和AD的相关性,并明确颅脑定量分析在早期lvPPA诊断中的价值。
