治疗食管癌的pH敏感多肽水凝胶的设计与研究*
2022-02-02朱春香吴轶群田天立陈晓庆
朱春香,吴轶群,田天立,陈晓庆,张 晴,姚 勇,葛 亮**
1南京高新医院药剂科,南京 211800;2中国药科大学药学院,南京211100
食管癌是一种高发病率与死亡率的恶性肿瘤,最新资料显示,其发病率在全球所有癌种中居第8位,病死率居第6位,手术治疗、放疗以及化疗是最常见的食管癌治疗方式[1,2],然而传统化疗药物靶向性不佳、药物不良反应严重[3,4]等问题严重影响了食管癌的治疗效果。阿霉素(doxorubicin,DOX)作为蒽环类广谱非特异性小分子抗癌药物,对多种实体瘤具有良好的疗效;但是存在生物利用度低、心脏毒性强以及肿瘤耐药等缺点[5]。目前,已见多种脂质体、胶束等辅助纳米载体进行药物递送以弥补阿霉素的缺陷,但这些载体也存在一定局限性,例如载药能力差、代谢产物具有毒性、易引发免疫应答而影响治疗效果[6,7]。因此亟需设计一种安全高效的药物载体提高阿霉素载药量、缓释能力、靶向性并降低毒副作用。
水凝胶作为一种特殊的药物载体,具有优异的理化性质、可控的降解性和缓控性,受到了广泛关注[8]。凝胶是由交联聚合物在延伸流体中形成的三维网络交联体系;当凝胶的分散介质是水时,称之为水凝胶:它对水和其他体液(如血清、血浆)具有高度亲和力,其质量可达到凝胶干重的数千倍,同时不溶于这些流体[9]。根据是否能随着外界环境的改变发生相应的变化,将水凝胶分为普通水凝胶和响应性水凝胶。前者对环境变化不敏感,而后者的性质(如溶胀行为、结构、机械强度、渗透率等)能够随外界物理或化学条件的刺激发生改变[10]。在受到温度、pH 值、光、机械应力、溶剂、压力等刺激时,响应性水凝胶可通过自身结构的可逆膨胀或收缩,发生溶胶-凝胶相转变,从而控制药物的释放[11]。而根据外界刺激的不同,响应性水凝胶主要分为温敏性、pH敏感性、光敏性及多敏感性水凝胶[12]。多肽水凝胶由氨基酸组成,其自组装过程自发可逆,无需使用化学交联剂来引发溶液-凝胶之间的转化,其体内降解产物无毒无害且代谢完全。自组装多肽水凝胶的高含水量和纳米级多肽纤维能够包封用于组织工程的细胞或生物活性分子,包括抗肿瘤药物和蛋白质[13,14]。由于其制备过程简单便利,具有非免疫原性、可生物降解、可注射、可局部给药等优点,为纳米医学应用提供了一个理想的平台。
本课题设计了一种基于pH 响应性多肽水凝胶装载DOX 的药物递送系统用于食管癌治疗的研究,其中多肽FOVVVEF 两端的苯丙氨酸(F)能够提供π-π 作用力以及疏水作用力,有利于多肽形成β折叠构象,而碱性氨基酸鸟氨酸(O)在pH 降低时质子化程度增强,多肽之间的静电斥力增大并促进多肽水凝胶的瓦解,形成了多肽水凝胶的pH 敏感性。在治疗时将其原位埋置于肿瘤部位,在肿瘤微酸环境中水凝胶结构瓦解,快速且稳定地释放DOX,极大提高了药物的局部缓释能力,在提高疗效的同时又减少了药物毒副作用。
1 材料与方法
1.1 材料
FOVVVEF 购自南京杰肽公司;盐酸阿霉素购自上海源叶公司;CCK-8 试剂盒购自上海翌圣生物公司;小鼠食管癌细胞(AKR)、人正常食管上皮细胞(HEEC)购自美国模式培养物集存库(ATCC);DMEM、1640 培养基购自美国Gibco 公司;胎牛血清购自美国Hyclone 公司;DAPI 购自碧云天生物技术公司;水为超纯水。
1.2 实验仪器
电子天平(BSA-124S,德国SARTORIUS 有限公司);飞鸽离心机(TDL-80-2B,上海安亭科学仪器有限公司);反向高效液相色谱仪(LC-8A,日本岛津公司);LC-MS(G6545A Q-TOF with 1290 Infinity II LC,美国Agilent 公司);紫外/可见分光光度计(UV-1800,日本岛津公司);圆二色谱仪(J-810,日本JASCO 公司),旋转流变仪(HAAKE 600,美国Thermo Fisher Scientific 公司);透射电子显微镜(HT-7700,日本日立公司);多功能酶标仪(ELx800,美国BioTek Instruments 公司);倒置荧光显微镜(IX73,日本Olympus 公司)。
1.3 方法
1.3.1 多肽的合成、纯化与确证 序列为FOVVVEF的多肽使用固相多肽合成法由南京杰肽公司合成。称取适量多肽粗品,以水为溶剂,配制成10 mg·mL-1的溶液,用0.45 μm 水相微孔滤膜过滤后使用RPHPLC 系统进行纯化。
色谱条件:岛津C18柱(4.6 mm×250 mm,5 μm);检测波长:214 nm;流动相:0.1%四氢呋喃(TFA)/水(v∶v)-0.1%TFA/乙腈(v∶v);流速:5 mL·min-1;洗脱时间:45 min。
线性洗脱后,通过制备液相色谱收集目标峰,除去有机溶剂,冷冻干燥后即可得到多肽纯品。称取适量上述制备液相纯化得到的各个多肽样品,以水为溶剂,配制成浓度为1 mg·mL-1的多肽溶液,用0.22 μm 水相微孔滤膜过滤,使用LC-MS 分析仪进行结构确证。
1.3.2 多肽水凝胶的制备 制备适合浓度的多肽溶液(10~20 mg·mL-1),涡旋使多肽粉末在水中充分溶解,离心除去残留气泡,测得多肽溶液的pH 为6.0,以0.25 mol·L-1NaOH 溶液调节pH 至7.4,涡旋混匀,静置5 min 观察多肽溶液的成胶状态;在制备载药水凝胶时,于多肽溶液中加入1 mg·mL-1或2 mg·mL-1的盐酸阿霉素,按上述步骤使得多肽溶液成胶。
1.3.3 TEM 使用透射电子显微镜(TEM)来观察多肽在不同条件下的纳米微观结构。制备pH 7.4和pH 5.8 的多肽水凝胶,待所制备的凝胶稳定后,吸取20 μL 并稀释10倍,稀释液即为含有多肽纳米纤维的溶液。吸取一滴稀释液滴至碳涂层铜网上,3 min 后用滤纸吸去多余液体,再吸取一滴2%磷钨酸溶液至铜网上,作样品复染,3 min 后吸去多余染色剂,在红外灯下烘干。将制作好的多肽样品放入透射电子显微镜下,观察其微观结构。
1.3.4 圆二色谱 根据J-810 圆二色谱仪上的标准使用方法,制备20 mg·mL-1的多肽水凝胶,分别溶于pH 7.4 和pH 5.8 的磷酸盐(PBS)缓冲液中,配制成浓度为0.2 mg·mL-1的多肽溶液,作为圆二色谱(CD)检测的样品,并以相应的PBS 缓冲液作为空白溶液。仪器预热后,用相应的PBS 溶液润洗圆型比色池3次,扫描该溶液作为空白;后用样品润洗圆型比色池3次,加入样品并扫描检测其二级结构。
1.3.5 流变学检测 制备空白水凝胶和包载DOX的多肽水凝胶,在室温下静置12 h。使用旋转流变仪进行动态频率扫描。开机预热,安装固定直径为25 mm 的圆形椎体,并将仪器温度设置为37℃,将水凝胶转移到圆形椎骨后缓慢降低上层椎板,水凝胶静置30 min 后进行流变测试。动态频率扫描的参数设置如下:频率为0.1~10 rad·s-1,剪切力为1%,测试时间为15 min。测量后,以频率为横坐标,储能模量(G′)和耗能模量(G″)为纵坐标,观察多肽水凝胶的机械强度变化。
1.3.6 体外药物释放 制备不同多肽以及DOX 浓度的载药水凝胶,将水凝胶稳定一夜,于第二天在管中加入200 μL PBS 缓冲液(pH 7.4 以及pH 5.8)作为凝胶释放液并记为0 h,在0、0.5、1、2、4、8、12、24、48、72、96、120、144、168 h 分别收集释放液并加入等体积的新鲜释放液。配制不同浓度的DOX溶液并使用紫外/可见分光光度计在波长499 nm 处读取DOX 吸光度,绘制标准曲线;分别计算释放液中DOX 对应质量并计算累计药物释放量与累计释放百分比。
1.3.7 细胞培养 当AKR 食管癌细胞/HEEC 食管上皮细胞生长密度达到80%~90%时,弃去培养基并加入3 mL PBS 缓冲液清洗细胞,加入1 mL 含0.02% EDTA 的0.25%胰蛋白酶消化细胞约1 min,吸出大部分胰酶并将培养瓶转移至培养箱中继续消化2 min,待细胞变圆变亮后,加入3 mL 新鲜培养基终止消化,将细胞重悬液吹匀并弃去2 mL,加入4 mL 新鲜DMEM/1640+10% FBS 培养基,分别从上、下、左、右四个方向摇动培养瓶,使重悬液均匀分布,然后将细胞放入培养箱中进一步培养。
1.3.8 生物相容性 用CCK-8 试剂盒考察空白水凝胶的生物相容性。将HEEC 细胞以5×104个/mL 的密度接种至96 孔板中,每孔100 μL,接种完成后置于37℃恒温培养箱中孵育24 h。将多肽溶于培养基中,使多肽终浓度为0、1、10、50、100、500 μg·mL-1,0.22 μm 滤膜过滤后替换原培养基,48 h 后避光加入10 μL CCK-8 试剂,继续以37℃恒温培养1.5 h,使用酶标仪检测吸光度A值,设定检测波长为450 nm,细胞存活率公式如下:

1.3.9 细胞摄取实验 按照“1.3.7”项下培养AKR细胞并将其接种于6 孔板中,孵育培养24 h,使其贴壁稳定。弃去原培养基,加入含有pH 5.5 和pH 7.4 条件下载药水凝胶48 h 释放液的新鲜培养基,设置对照组,继续孵育培养4 h。弃去含药培养基,PBS 缓冲液润洗3遍,用4%的多聚甲醛固定细胞,30 min 后使用0.5 μg·mL-1DAPI 对细胞核进行染色,PBS 缓冲液漂洗3遍,使用荧光显微镜观察AKR 细胞对DOX 的摄取情况。
1.3.10 体外抗肿瘤实验 制备1.0 mg·mL-1DOX母液,使用0.22 μm 滤膜过滤除菌,用DMEM 培养基将其稀释至实验所需药物浓度(0.1、1、10、20、50μg·mL-1)后备用。制备载药水凝胶(水凝胶中药物在释放液中完全释放后的浓度与游离药物的浓度相对应),分别收集pH 5.5 和pH 7.4条件下载药水凝胶48 h释放液,过滤后按照每孔100 μL 的体积加入96 孔板中,孵育48 h,使用CCK-8 试剂盒检测细胞毒性。
2 结果与讨论
2.1 多肽的合成与验证
通过多肽固相合成法得到白色FOVVVEF 多肽粉末,高效液相色谱法测得多肽粉末的纯度为96.37%(图1A),其符合后续实验要求。ESI-MS 质谱结果显示,多肽的实际分子量为854.03(图1B),与理论值一致,证明分离纯化后多肽均为所需目标多肽。
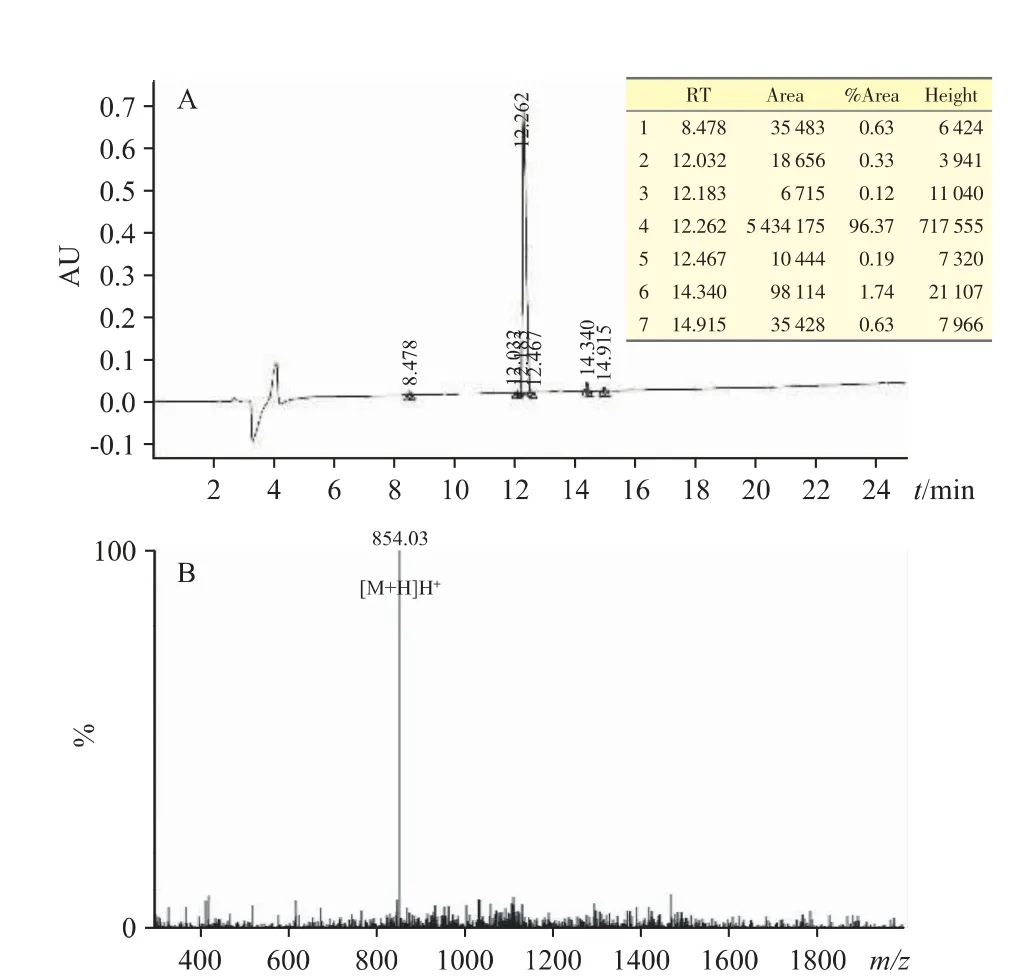
图1 (A)FOVVVEF 多肽HPLC 图谱;(B)FOVVVEF 多肽ESI-MS 质谱图
2.2 多肽的性质测定
2.2.1 多肽的成胶性能及其筛选 称取FOVVVEF多肽粉末2 mg 置于EP 管中并加入100 μL 纯水(使浓度为20 mg·mL-1),旋涡5 min 使多肽与水充分混合,使用浓度为0.25 mol·L-1的氢氧化钠溶液调节pH,静置5 min 观察结果见图2。

图2 FOVVVEF 多肽在(A)pH 5.5 和(B)pH 7.4 时状态
制备的FOVVVEF 水凝胶能够在中性环境中形成稳定的结构,在肿瘤微酸环境中释放药物,以降低载药水凝胶对正常组织的毒性。通过氢氧化钠调节并观察在pH 5~8 范围内该多肽的成胶情况,如图2 所示,FOVVVEF 在浓度为20 mg·mL-1、pH 7.4的条件下能够形成稳定的水凝胶,由此后续实验对该水凝胶进行理化性质测定。
2.2.2 透射电镜 利用TEM 对多肽凝胶的微观形态进行直接清晰的表征,如图3 所示。在酸性条件下(pH 5.8),多肽水凝胶主要有较短的纳米纤维构成,短纤维分布松散,形态为条状细长型,略微蜷曲,直径约50 nm,长度在0.5~1.5 μm。在中性条件下(pH 7.4),多肽水凝胶成聚集的直棒网状结构,交织扎堆层叠,直径约50 nm,长度在0.5~1.5 μm,其网格结构中的空隙可以有效锁住水分子,包载药物,为抗肿瘤药物的运输提供有力支撑。从TEM 结果证实,FOVVVEF 多肽水凝胶在酸碱度环境不同时,微观形态呈现明显的差异,具有显著的pH 敏感性。

图3 (A)pH 5.8 和(B)pH 7.4 环境下FOVVVEF 多肽水凝胶的透射电子显微镜图像,标尺为500 nm
2.2.3 圆二色谱 根据多肽二级结构的标准圆二色谱图[15]可知:在190~240 nm 的紫外区段,α 螺旋结构在192 nm 波段附近有一正峰,在208、222 nm波段处呈两个负的肩峰;β 折叠二级结构在217 nm波段附近有一负峰,在185~200 nm 波段有一强的正峰。FOVVVEF 水凝胶在pH 5.8 和pH 7.4 水溶液中的CD 光谱如图4 所示:蓝色线代表pH 为7.4时的圆二光色谱图,在205 nm 处有最大吸收峰,在220 nm 处有一峰谷,波形接近β 折叠结构;绿色色线代表pH 为5.8 时的圆二光色谱图,波形和蓝线相似,但CD 值相对较小,波形靠下,且在波长198 nm处有一负峰,除了β 折叠结构外还存在其他类型的二级结构。

图4 在pH 5.8(绿线)和pH 7.4(蓝线)环境下FOVVVEF的圆二色谱图
2.2.4 流变性 流变学是常用作测定自组装多肽水凝胶相对机械刚度的方法。为了考察FOVVVEF水凝胶是否具有较好的机械刚度和稳定性,本课题组对多肽水凝胶和载药多肽水凝胶进行了动态应变扫描,结果如图5 所示。在1%应变、0.1~100 rad·s-1的动态频率扫描下,多肽水凝胶和载药多肽水凝胶均处于线性粘弹性区域。在线性粘弹区间内,两者的储能模量G′远大于损耗模量G″,表明多肽水凝胶和载药多肽水凝胶具有一定的机械强度,宏观上表现为不具备流动性的固体稳定状态,且两者的储能模量和耗能模量十分相近,可见载药几乎不会对该多肽水凝胶的结构产生影响。可得出FOVVVEF 水凝胶具有刚性固体性质,可以作为一种稳定的药物递送载体材料。

图5 FOVVVEF 的动态应变扫描
2.3 药物释放
通过测量阿霉素标准品的吸光度,得到阿霉素浓度和吸光度之间的线性范围:0.4~60 μg·mL-1,线性关系:Y=0.017 8X+0.004 7,相关系数:r2=0.999 2,X为DOX 浓度(μg·mL-1),Y 为吸光度A。
为了探究FOVVVEF 水凝胶在生物体内肿瘤部位的释药特点、药物装载情况,本课题采用不同pH的释放介质以及不同装载量,考察FOVVVEF 载药水凝胶的释放行为。分别制备了4 份不同的载药水凝胶,多肽浓度均为20 mg·mL-1,DOX 的浓度和pH值分别为1 mg·mL-1(pH 5.8)、1 mg·mL-1(pH 7.4)、2 mg·mL-1(pH 5.8)、2 mg·mL-1(pH 7.4)。将0、0.5、1、2、4、8、12、24、48、72、96、120、144、168 h 吸取的释放液通过紫外/可见分光光度计测量吸光度,对数据进行处理后得到药物累积释放量并计算累计释放百分比。
如图6 所示,当pH 5.8时,无论载药水凝胶中DOX 的浓度为1 mg·mL-1还是2 mg·mL-1,其168 h的药物释放百分比无明显差异,分别为89.9%和91.3%。而当pH 7.4时,两者的DOX 释放百分比分别为24.3%和26.7%,其数值显著低于pH 5.8 时的数值,表明FOVVVEF 多肽水凝胶有较好的酸响应性与药物释放能力,在中性生理条件下具有较好的包封效果。
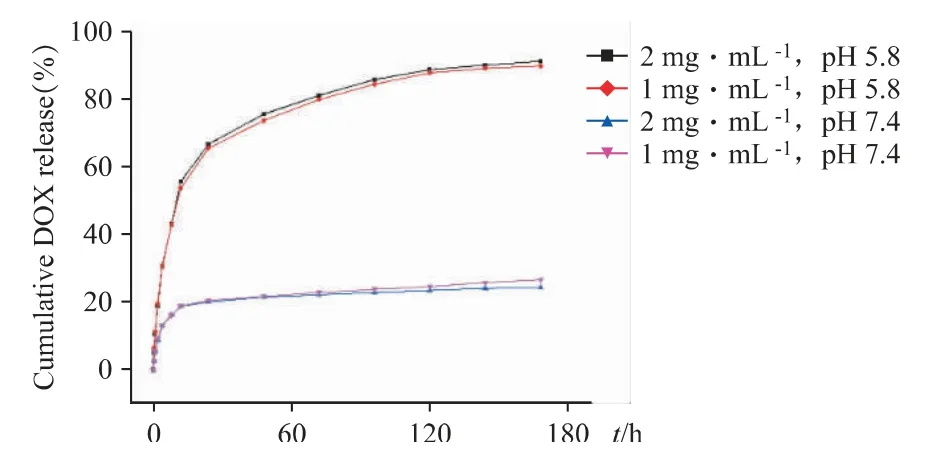
图6 DOX@FOVVVEF 水凝胶在不同pH 条件和不同载药浓度下的累积释放百分比
2.4 生物相容性
验证载药水凝胶的抗肿瘤效果之前需保证该载体材料具有良好的生物相容性。FOVVVEF 自组装多肽水凝胶的生物相容性结果如图7 所示。给予HEEC 细胞不同浓度的FOVVVEF 多肽并作用48 h,发现即使多肽浓度高达500 μg·mL-1时,HEEC 细胞的存活率仍高于90%,表明FOVVVEF 多肽具备良好的生物相容性,是一种安全的药物载体。
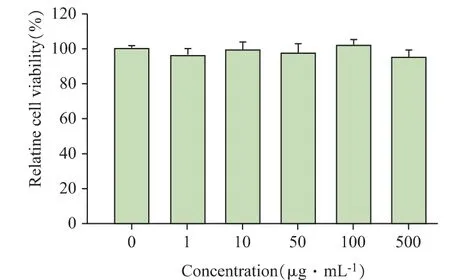
图7 HEEC 细胞与不同浓度FOVVVEF 多肽共孵育48 h后的细胞活力
2.5 载药水凝胶的细胞毒性
2.5.1 CCK-8 实验 通过CCK-8 实验考察DOX@FOVVVEF 水凝胶的体内抗肿瘤活性。如图8所示,随着药物浓度升高,AKR 细胞存活率均逐渐降低。其中,在DOX 药物浓度为10μg·mL-1以及20μg·mL-1时,pH 5.8 释放条件下的细胞比在pH 7.4 时出现了更加显著的细胞死亡。
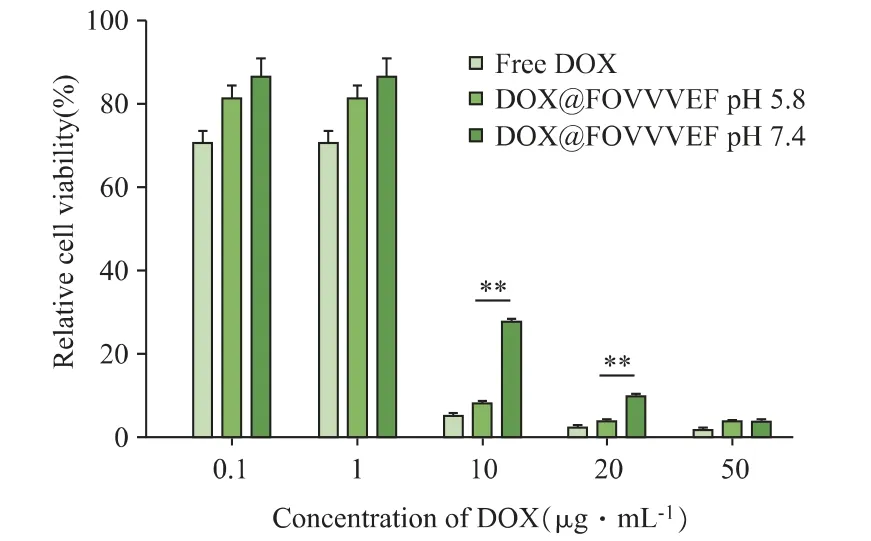
图8 游离DOX 以及DOX@FOVVVEF 在pH 5.8 和pH 7.4 的释放液共孵育48 h 的AKR 细胞活力,**P <0.001
2.5.2 细胞摄取实验 通过细胞摄取实验,验证不同pH 条件下细胞死亡程度的差异是否与DOX 的释放直接相关(DOX 总浓度为10 μg·mL-1)。如图9所示,DOX@FOVVVEF 在pH 5.8 时比在pH 7.4 时具有更强的细胞内DOX 荧光强度,酸性条件下凝胶的纳米纤维结构更容易降解,释放出更多的DOX,被细胞摄取后表现出更强的荧光。

图9 与(A)空白DMEM、DOX@FOVVVEF 在(B)pH 7.4 和(C)pH 5.8 的释放液共孵育48 h 后AKR 细胞的DOX 摄取,标尺为100 μm
3 小 结
本课题使用了固相多肽合成法合成了序列为FOVVVEF 的七肽,该多肽在pH 7.4、浓度为20 mg·mL-1时,能够包裹化疗药盐酸阿霉素自组装成稳定的多肽水凝胶,其具有优异的机械稳定性与生物相容性。在肿瘤微酸环境中,水凝胶中的碱性氨基酸与阿霉素质子化程度增强导致体系静电斥力增大,凝胶三维机构瓦解,大量且稳定地释放阿霉素,在细胞实验中取得了良好的抗肿瘤作用。综上所述,FOVVVEF 多肽水凝胶是一种理想的抗肿瘤药物递送载体,具有临床应用的潜力与价值。