低温胁迫对番茄幼苗不同叶龄叶片叶绿素荧光成像特性的影响
2022-02-02胡雪华刘宁宁陶慧敏彭可佳夏晓剑胡文海
胡雪华,刘宁宁,陶慧敏,彭可佳,夏晓剑,胡文海
低温胁迫对番茄幼苗不同叶龄叶片叶绿素荧光成像特性的影响

1井冈山大学生命科学学院,江西吉安 333009;2浙江大学农业与生物技术学院园艺系,杭州 310058
研究番茄幼苗第2叶(成熟叶)和第4叶(新生叶)叶绿素荧光成像特性对低温胁迫的响应,并分析低温胁迫下番茄不同叶龄叶片光合活性区域相对面积及荧光参数值的变化,以探明番茄幼苗不同叶龄叶片对低温胁迫的适应机制。以番茄品种‘中蔬4号’(L. cv Zhongshu No.4)4叶期幼苗为材料,对番茄幼苗进行低温(8℃、200 μmol·m-2·s-1)处理15 d后常温(26℃白天/20℃夜晚,500 μmol·m-2·s-1)恢复1 d,于处理不同时期对幼苗全株进行叶绿素荧光成像,并比较第2叶和第4叶的叶绿素荧光成像特性。低温处理期间,第4叶的光合活性区域相对面积(RAP)仅在处理前期(5 d)有所下降,而全株和第2叶的RAP则随处理时间的延长持续下降,但常温1 d即可完全恢复。低温处理下PSII调节性能量耗散的量子产量(Y(NPQ))、PSII非调节性能量耗散的量子产量(Y(NO))和非光化学猝灭(NPQ)的荧光活性区域相对面积(RAF)与RAP基本一致,但PSII实际光化学效率(Y(II))和光化学猝灭(qP)的RAF则显著低于RAP。低温处理前期(5 d),番茄幼苗光合活性区域的PSII最大光化学效率(Fv/Fm)、Y(NPQ)、NPQ急剧下降和Y(NO)急剧上升,随后,Fv/Fm保持不变,但Y(NPQ)和NPQ有所上升,Y(NO)则下降。但是,低温处理1 d即导致光合活性区域Y(II)的急剧下降,随后维持不变。另外,番茄全株和第4叶的光合活性区域qP仅表现在处理第1天时小幅下降,随后则维持高于处理前的水平,而第2叶qP则在第5天有明显上升后又迅速下降。总体上,第4叶光合活性区域的Fv/Fm、Y(II)、Y(NPQ)、NPQ和qP明显高于第2叶,Y(NO)低于第2叶。番茄幼苗可通过主动降低叶片光合活性区域面积来适应低温胁迫,而叶片热耗散能力在低温处理前期受到抑制,直到处理后期才逐渐发挥其光保护作用;低温胁迫下番茄幼苗优先保护生长点和新生叶,成熟叶主要通过可逆降低光合活性区域面积来适应低温胁迫,而新生叶则主要通过维持相对较高的PSII反应中心光化学和热耗散能力防御低温光抑制;低温导致新生叶光合活性区域中部分有活性的PSII反应中心关闭的同时,刺激了剩余有活性PSII反应中心开放程度的提高,这将有利于低温胁迫解除后光合活性的恢复。
番茄;低温胁迫;叶绿素荧光成像;光抑制;叶龄
0 引言
【研究意义】番茄(L.)是我国冬春设施栽培面积最大的喜温蔬菜之一[1],低于10℃通常会造成番茄植株冷害的发生[2]。光合作用是低温胁迫下受到抑制的主要生理代谢过程[3]。由于同一植株上不同叶片以及同一叶片不同部位的光合特性存在差异[4-5],因此,对低温胁迫后番茄幼苗全株进行叶绿素荧光成像分析,并比较不同叶龄叶片间叶绿素荧光成像特征的差异,有助于从整体水平上探究番茄幼苗光合特性对低温胁迫的适应机制,为番茄设施栽培提供依据。【前人研究进展】低温胁迫抑制了番茄叶片SBPase、FBPase和Rubisco等光合酶活性[6-9],降低了光系统II(PSII)光化学效率,阻碍了光合电子传递的顺利进行,从而造成光抑制甚至光合机构的破坏[10-14]。叶绿素荧光分析技术作为研究植物光合特性的主要手段,具有快速无损伤、高灵敏度等优势。然而,有关植物叶片叶绿素荧光特征的研究大多是通过测定或分析叶片局部某一点的叶绿素荧光参数,以叶片某一特定位置的叶绿素荧光信息代替了全叶甚至全株的叶绿素荧光特征。由于植物叶片存在光合异质性,因此,叶片局部的叶绿素荧光信息并不足以代表叶片整体的荧光特征,无法正确评估植物的光合特性[15-16]。叶绿素荧光成像技术可以获得植物全叶或全株叶绿素荧光信号,既能提供荧光参数数值,又可观察荧光特性的空间异质性,从而成为叶绿素荧光研究的重要方法之一[17-18]。虽然叶绿素荧光成像技术的应用为植物环境胁迫研究提供了巨大潜力,但是大多数文献仍是采用叶片局部区域的荧光参数开展研究,并不能代表全叶的荧光特性,该技术在植物逆境胁迫研究中的方法还需进一步完善。而少数利用叶绿素荧光成像技术对作物整体荧光成像的研究主要侧重于作物生理监测,例如王恒[19]对应用于植物生理检测的高通量叶绿素荧光成像系统的研究,董贞芬[20]对低温胁迫下番茄幼苗叶绿素荧光成像的分析及研究,以及Bresson等[21]基于Fv/Fm荧光值分布来量化植株光合效率空间异质性的动态分析,这类方法在分析叶绿素荧光参数图的过程中需要采用图像处理技术对植物区域的图像进行提取和分析,由于图像处理技术的专业性而限制了大多数研究者的应用。笔者前期预试验表明,8℃低温处理导致番茄叶片荧光成像面积显著缩小,但常温下1 d即可恢复,这意味着番茄在低温胁迫下会主动抑制叶片部分区域的光合活性以减轻低温伤害,并且还呈现不同叶片的荧光成像面积和同一叶片不同荧光参数的荧光成像面积缩小程度不一致等特征。王春萍等[5]研究也表明4℃低温胁迫下水稻幼苗叶片的伤害程度随着叶龄的增加而增大。【本研究切入点】对低温胁迫下的番茄幼苗全株进行叶绿素荧光成像,并分析不同叶片叶绿素荧光成像的差异性,避免以局部叶绿素荧光特征代表植株整体对低温胁迫响应的局限;进一步分析植株具有光合活性的区域的荧光参数对低温胁迫的响应,以利于判断植物保持有光合活性的部位如何防御低温伤害。【拟解决的关键问题】本研究对8℃低温处理15 d后常温恢复1 d的番茄幼苗,在处理的各个时期采用ImagingPAM荧光成像系统对幼苗全株进行叶绿素荧光成像,并分析全株、第2叶和第4叶叶绿素荧光成像特征的变化及差异,探明番茄幼苗不同叶龄叶片光合机构对低温胁迫的响应,从植株整体水平上探究番茄幼苗光合特性对低温胁迫的适应机制,并完善叶绿素荧光成像技术在植物逆境胁迫研究中的应用。
1 材料与方法
试验于2020年在井冈山大学人工气候室进行。
1.1 试验材料与处理
供试番茄品种为‘中蔬4号’(L. cv Zhongshu No.4)。种子播种于装有草炭土的塑料盆(长20 cm、宽14 cm、高5 cm),幼苗2叶期移入装有草炭土的圆形塑料盆(直径10 cm、高15 cm),浇灌园试营养液进行水肥管理,置于人工气候室内培养。人工气候室设置昼夜温度26℃/20℃(白天/夜晚),空气相对湿度75%,采用LED植物生长灯提供约500 μmol·m-2·s-1光照,昼夜光周期设置为10/14 h,8:00和18:00分别为昼夜起始时间。幼苗4叶期时,选取植株高度和冠幅较为一致且其全株叶绿素荧光成像于ImagingPAM成像窗口中的5盆植株为试验材料。
于处理前(T0d)将5盆番茄试验植株分别编号1、2、3、4、5,并按编号顺序于8:30开始逐一开展全株叶绿素荧光成像测定,每一盆植株在测定结束后立即移入人工气候箱中进行8℃低温处理,人工气候箱空气相对湿度75%,光照强度约200 μmol·m-2·s-1,光照时间8:00—18:00。于低温处理第1、5、10、15天(分别记为T1d、T5d、T10d、T15d)于8:30开始,按编号顺序逐一进行叶绿素荧光成像测定。低温处理15 d的植株结束荧光成像测定后立即移入人工气候室,恢复1 d(R1d)后按编号顺序对各植株进行叶绿素荧光成像测定。
1.2 叶绿素荧光成像测定
采用调制式IMAGING-PAM叶绿素荧光仪(Walz,德国)对番茄幼苗进行全株叶绿素荧光成像测定。按照操作手册,移除IMAGING-MAX/GS底部载物平台并安装4个金属支架,将盆栽植株移入荧光仪中并使植株顶部位于18.5 cm的标准工作距离处(即LED陈列前端和植株顶部之间的距离,原安装底部载物平台处),以黑色绒布遮住植株根部培养基质和花盆,并用黑布包裹荧光仪进行遮光暗处理30 min。设置光化光(actinic light)强度为281 μmol·m-2·s-1,选择Kinetics模式,进行叶绿素荧光诱导曲线(持续260 s)的测定,并导出荧光成像源文件。
1.3 叶绿素荧光参数图像分析
1.3.1 全株、第2叶和第4叶AOI区域的选择 ImaingWin v2.47软件提供了Circle(圆形)、Rectangle(矩形)和Polygon(多边形)3种AOI(area of interest)区域选择方式。其中Polygon方式可通过连续设置多边形点连接成任意形状,为以全叶作为AOI区域开展研究提供了方便。利用ImaingWin v2.47软件打开荧光成像源文件,在Image窗口下选择NIR图像类型,采用Polygon方式沿着植株外围将全株纳入AOI范围,获得全株AOI区域;采用Polygon方式,分别沿第2叶和第4叶边缘连续设置多边形点使之与叶片边缘尽量重合,获得第2叶和第4叶全叶AOI区域(图1-A)。
1.3.2 全株、第2叶和第4叶光合活性区域荧光参数平均值的读取 利用ImaingWin v2.47软件Report功能可导出各AOI范围内像素值(size)、PSII最大光化学效率(Fv/Fm)、PSII实际光化学效率(Y(II))、PSII调节性能量耗散的量子产量(Y(NPQ))、PSII非调节性能量耗散的量子产量(Y(NO))、非光化学猝灭(NPQ/4)和光化学猝灭(qP)等参数值。根据IMAGING-PAM操作手册,当光合活性区域(photosynthetically active regions,即Fv/Fm>0区域)为斑块时,应禁用软件Options中“Mean over AOI”功能,此时仅对AOI范围内光合活性区域的荧光值进行平均,所显示的荧光图像和荧光参数平均值仅对应AOI的光合活性区域。以低温处理5 d的植株1全株叶绿素荧光成像图为例,在NIR图像类型下采用Polygon方式对第2叶和第4叶进行全叶AOI选择(图1-A),在Fv/Fm图像类型下(图1-B)明显可观察到两叶沿着叶片边缘均有一定面积Fv/Fm=0的非光合活性区域(即AOI中呈现黑色的部位),其中第2叶光合活性区域面积占全叶总面积的比例明显低于第4叶。

图1 低温处理5 d时番茄幼苗第2叶和第4叶AOI选择(A)及其光合活性区域(B)(以植株1为例)
选择好全株、第2叶和第4叶的AOI后,通过软件的Report功能导出全株、第2叶和第4叶AOI区域的Size、Fv/Fm、Y(II)、Y(NPQ)、Y(NO)、NPQ/4和qP等荧光参数值。经过260 s光化光诱导,植株荧光曲线已平滑,因此,选择诱导曲线最后一次测得的荧光数据进行分析,所有荧光参数值均为AOI范围内光合活性区域的平均值。
1.3.3 植株全株的光合活性区域相对面积和各荧光参数的荧光活性区域相对面积的计算 通过ImaingWin v2.47软件,在Image窗口对最后一次荧光成像选择Analysis功能,通过设置各荧光参数Low值为0.004,High值为1(其中,Y(NO)参数Low值设定为0,High值设定为0.996),读取Red Pixel Assessment中的Number值,该值即为各荧光参数的荧光活性区域面积(size of fluorescence active regions,SAF)。由于ImagingPAM荧光成像系统定义Fv/Fm>0的部位为光合活性区域,因此,Fv/Fm的荧光活性区域面积即为光合活性区域面积(size of photosynthetically active regions,SAP)。基于处理前(T0d)植株全株各部位的Fv/Fm均大于0且较为均匀,此时植株的光合活性区域面积与植株总面积一致,因此,采用此时各植株的光合活性区域面积作为该植株总面积(SAP(T0d))。
处理各时期植株荧光参数的荧光活性区域相对面积(relative area of fluorescence active regions, RAF)采用该时期植株各荧光参数的荧光活性区域面积(SAF(Treatment),其中Treatment代表T0d、T1d、T5d、T10d、T15d、R1d)与SAP(T0d)比较而得,RAF(%) = SAF(Treatment)/SAP(T0d)×100。全株的光合活性区域相对面积(relative area of photosynthetically active regions,RAP)则为Fv/Fm的RAF。虽然番茄幼苗在低温胁迫下叶片会发生轻微的卷曲和下垂,从而导致植株面积下降,使采用该方法估算植株光合活性区域相对面积和荧光参数活性区域相对面积会稍低于实际值,但不会改变低温对其影响的整体趋势,因此,本研究仍采用这种计算方式。
1.3.4 第2叶和第4叶光合活性区域相对面积的计算 由ImaingWin v2.47软件Report功能导出的Size值为AOI像素值,即AOI面积。配合Options菜单中启用和禁用“Mean over AOI”功能,可获得AOI总面积和AOI光合活性区域面积。启用“Mean over AOI”,Size值为AOI总像素值,即AOI总面积(ST);禁用“Mean over AOI”,Size值则是AOI中具有光合活性区域的像素值,即AOI的光合活性区域面积(SP)。第2叶和第4叶的光合活性区域相对面积RAP(%) = SP/ ST×100。
2 结果
2.1 低温胁迫对光合活性区域相对面积和Fv/Fm的影响
随着低温处理时间的延长,Fv/Fm荧光成像呈现出由叶缘逐渐向主脉收缩变小的趋势,以及叶片叶龄越大其荧光成像面积缩小越明显的特征;低温处理也导致Fv/Fm值的下降,表现为代表Fv/Fm值大小的颜色由深蓝色向绿色和黄色转变,且叶龄越大荧光值越小,同一叶片靠近茎和叶脉中心部分的荧光值越大。低温处理后仅恢复1 d,Fv/Fm荧光成像面积得以迅速恢复,并且新叶靠近茎中心的大部位区域也基本恢复至深蓝色,但老叶则仍有较大面积呈现黄绿色(图2)。这表明新叶对低温胁迫的抵抗能力和恢复能力均高于老叶。由于ImagingPAM荧光成像系统定义Fv/Fm>0部位为光合活性区域,因此,图2也代表了光合活性区域的变化情况。
低温处理对番茄全株、第2叶和第4叶光合活性区域相对面积的影响如图3-A所示。第4叶光合活性区域相对面积在低温处理1 d时并未下降,处理5 d下降6.9%后就不再下降。但番茄全株和第2叶光合活性区域相对面积随着处理时间的延长而持续下降,低温处理1 d即分别下降21.6%和14.2%,处理15 d时则分别下降了55.4%和40.8%。常温下恢复1 d,番茄全株、第2叶和第4叶的光合活性区域相对面积均可完全恢复至处理前水平,说明8℃低温胁迫15 d并未引起番茄幼苗叶片坏死。
低温处理对番茄全株、第2叶和第4叶光合活性区域Fv/Fm的影响如图3-B所示。幼苗全株、第2叶和第4叶的Fv/Fm在处理前均约0.710,低温处理1 d即引起Fv/Fm的迅速下降,处理5 d时达到最低点,分别为0.256、0.229和0.320;但随后的低温处理并未引起全株和第2叶Fv/Fm的下降,第4叶反而有所上升。恢复1 d,第4叶Fv/Fm可完全恢复至处理前水平,而全株和第2叶则恢复至0.620和0.580,仍低于处理前水平。
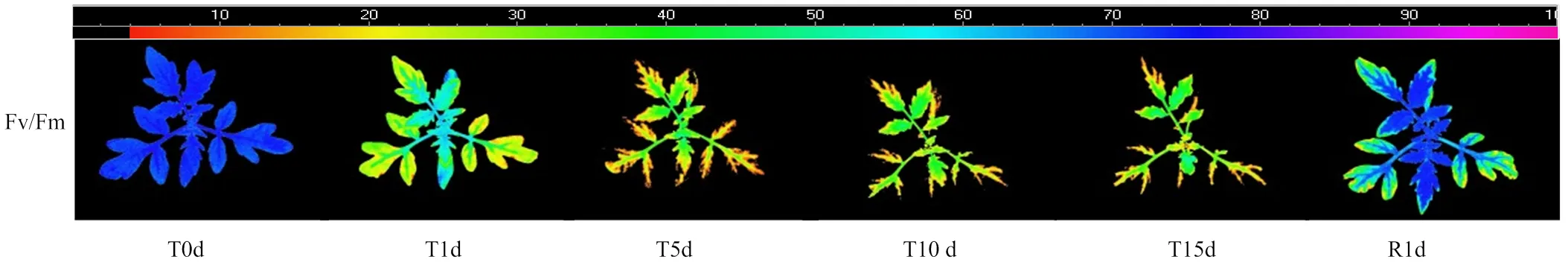
图2 低温胁迫15 d和恢复1 d期间番茄幼苗Fv/Fm的荧光成像(以植株1为例)
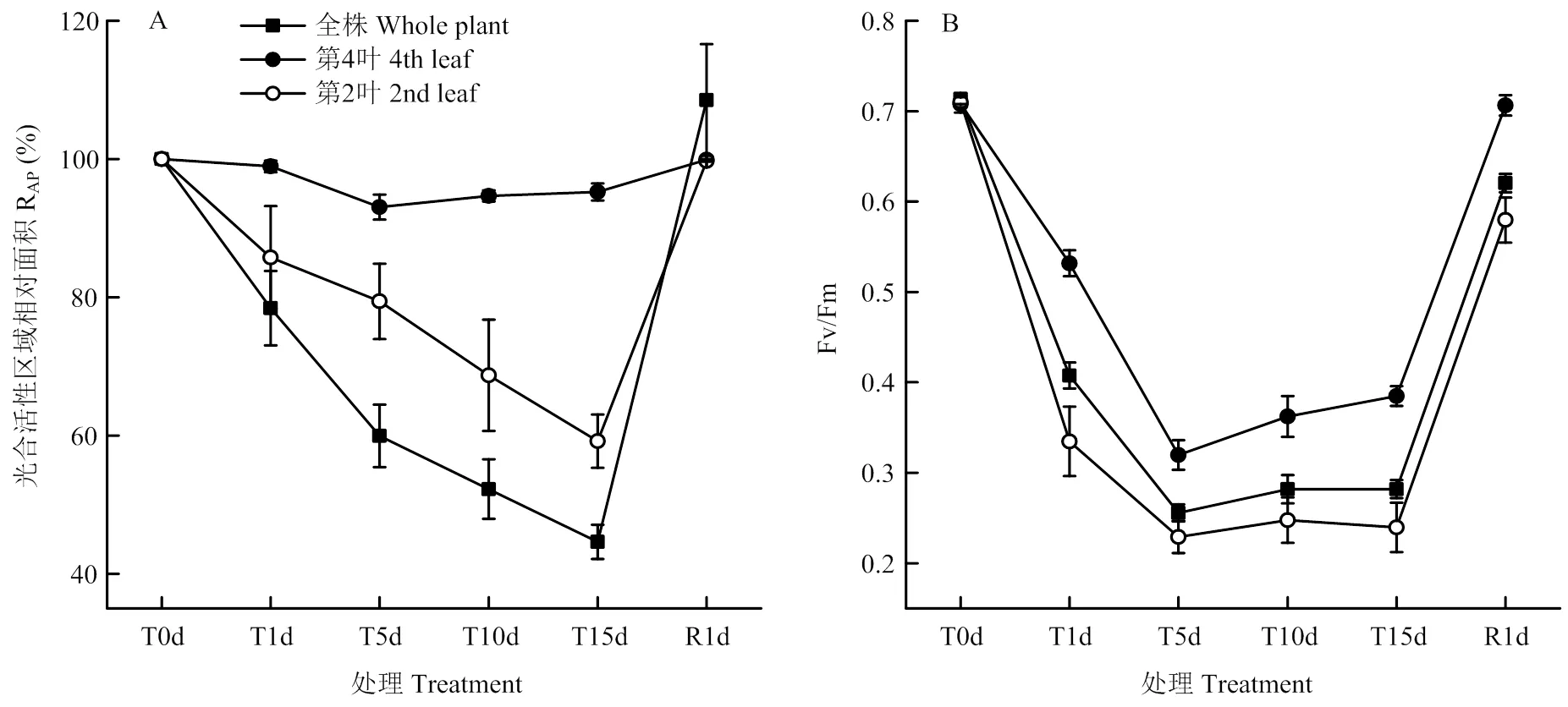
图3 低温胁迫对番茄幼苗光合活性区域相对面积(RAP)和Fv/Fm的影响
2.2 低温胁迫对Y(II)、Y(NPQ)和Y(NO)的影响
由图4和图5-A可知,低温处理可导致Y(II)、Y(NPQ)和Y(NO)荧光成像面积的下降,但对Y(II)的影响更为明显。番茄幼苗Y(II)荧光成像面积随着处理时间的延长而急剧下降,至处理15 d时难以观察到植株基本形态。低温胁迫下Y(NPQ)和Y(NO)的成像面积虽然略有下降,但仍保持了植株基本形态。低温处理期间Y(NPQ)和Y(NO)的荧光活性区域表现出与光合活性区域面积同步下降,在处理15 d时还稍高于光合活性区域面积,而Y(II)荧光活性区域面积则明显低于光合活性区域面积。然而,恢复1 d时,Y(II)、Y(NPQ)和Y(NO)荧光成像面积均可恢复至处理前水平,且与植株光合活性区域面积相一致。
低温处理1 d即导致番茄幼苗光合活性区域Y(II)荧光值大幅下降,随后则呈现小幅升高、降低、再升高的变化(图5-B)。虽然番茄幼苗全株和第2叶光合活性区域的Y(II)荧光值在低温处理前高于第4叶,但低温处理期间第4叶的Y(II)荧光值高于全株和第2叶。恢复1 d,全株和第2叶的Y(II)荧光值可恢复至处理前水平,而第4叶则明显高于处理前水平。由图4-A可知,靠近茎尖生长中心的新叶表现绿色,老叶叶缘处仍表现为明显的黄色,表明长期低温胁迫后番茄幼苗优先恢复生长中心叶片的Y(II)。
处理前番茄幼苗全株和第2叶光合活性区域的Y(NPQ)明显低于第4叶,低温处理期间Y(NPQ)呈现先下降后上升的变化趋势(图5-C)。其中,第4叶的Y(NPQ)在低温处理5 d时下降至最低点后开始上升;而全株和第2叶的Y(NPQ)分别在处理5 d和10 d时降到最低点,然后均从低温处理10 d后开始上升。恢复1 d后,第2叶的Y(NPQ)仍有小幅上升,而第4叶和全株的Y(NPQ)则与低温处理15 d时没有明显变化,但均未恢复至处理前水平。
处理前番茄幼苗全株、第2叶和第4叶光合活性区域Y(NO)未见差异,低温处理则导致了Y(NO)的上升,且全株和第2叶的上升幅度大于第4叶(图5-D)。全株和第2叶的Y(NO)在处理10 d时达到最大值,而第4叶则在低温处理5 d时达到最大值,然后均随着处理时间的延长而明显下降。恢复1 d后,全株、第2叶和第4叶的Y(NO)均显著下降,其中第4叶可恢复至处理前水平,但全株和第2叶的Y(NO)仍稍高于处理前水平。结合图4-C番茄幼苗外围部分Y(NO)荧光成像呈现蓝色,而靠近茎尖生长中心的叶片部分则呈黄绿色,说明位于番茄内侧的茎尖和新叶的Y(NO)更易于恢复。
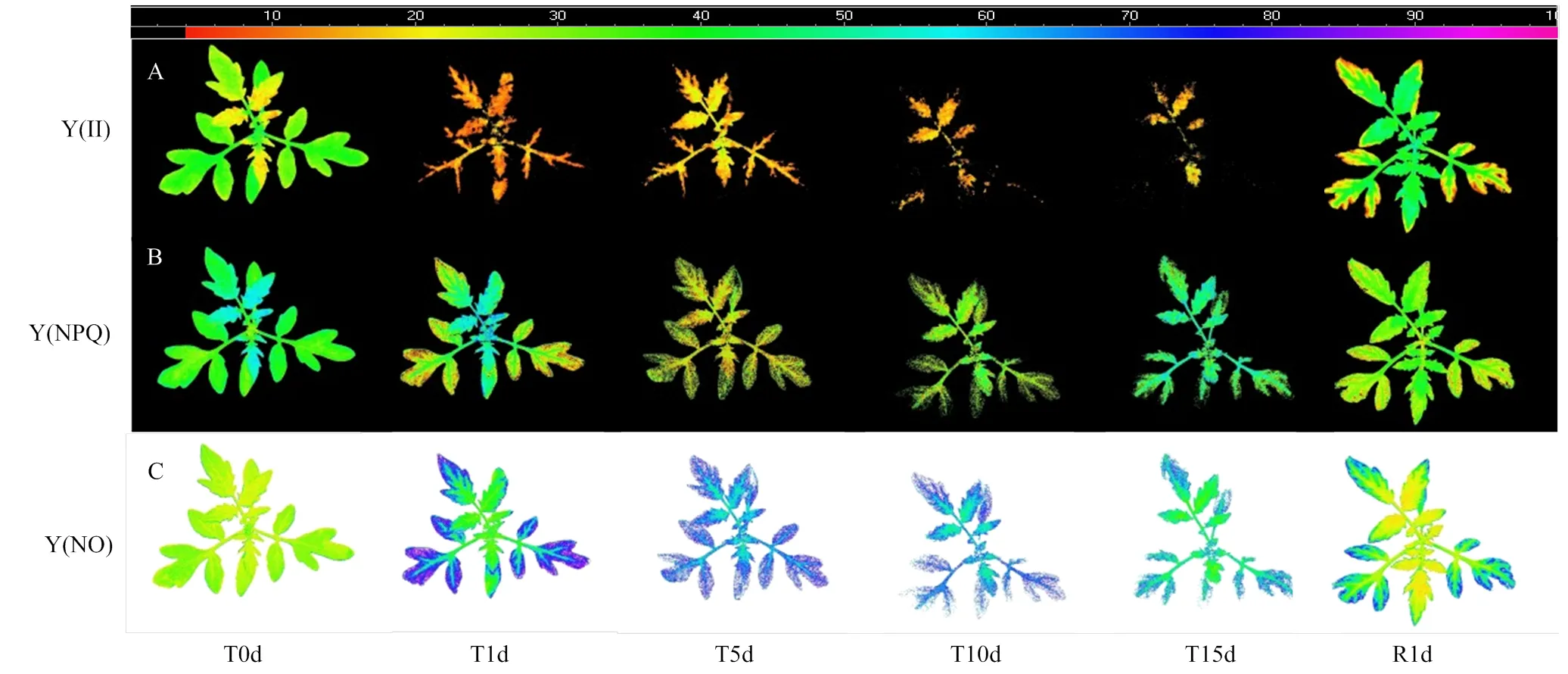
图4 低温胁迫15 d和恢复1 d期间番茄幼苗Y(II)、Y(NPQ)和Y(NO)的荧光成像(以植株1为例)

图5 低温胁迫对番茄幼苗光合活性区域Y(II)、Y(NPQ)和Y(NO)的影响
2.3 低温胁迫对NPQ和qP的影响
由图6和图7-A可知,低温胁迫下番茄幼苗NPQ荧光成像面积虽然略有下降,但仍呈现出植株基本形态,且其荧光活性区域相对面积除了在低温处理15 d时稍高于光合活性区域相对面积外,其他时间均与光合活性区域相对面积没有明显差异。而qP的荧光成像面积在低温处理1 d时即大幅下降,且在低温处理后期难以观察到植株基本形态。但恢复1 d时,NPQ和qP的荧光成像面积均可恢复至处理前水平。

图6 低温胁迫15 d和恢复1 d期间番茄幼苗NPQ和qP的荧光成像(以植株1为例)
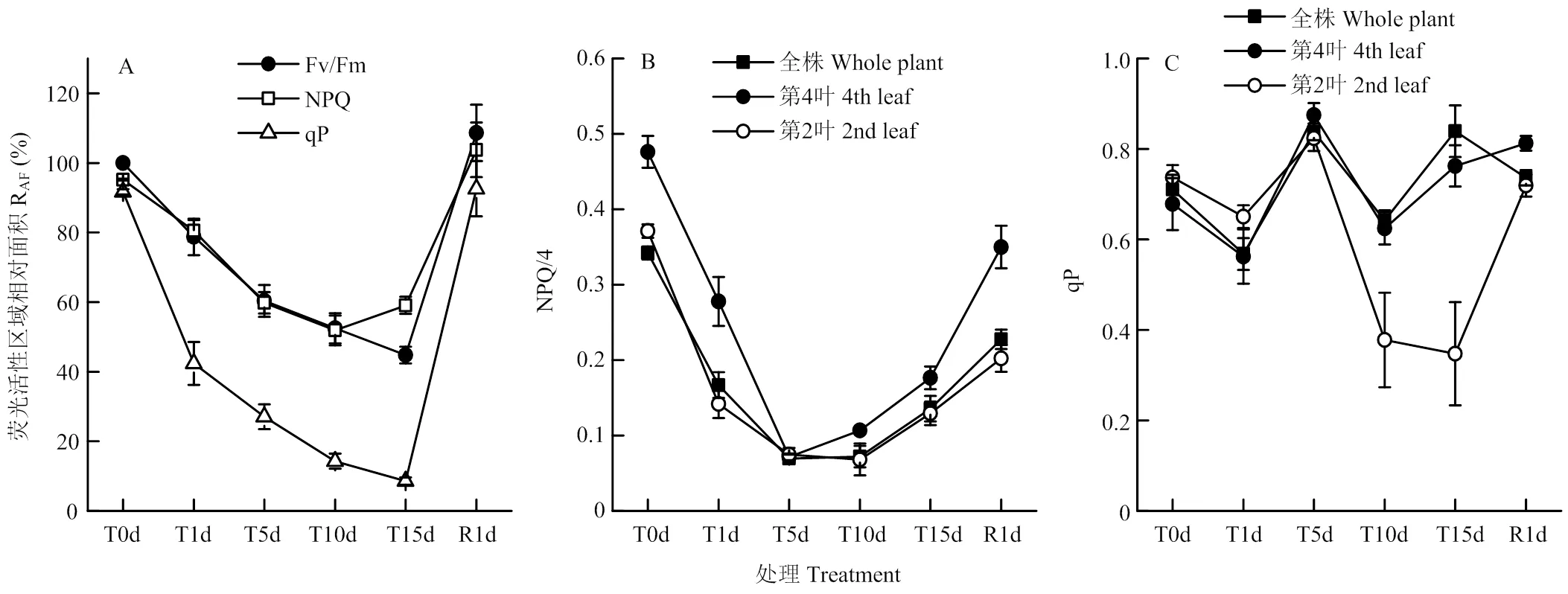
图7 低温胁迫对番茄幼苗光合活性区域NPQ和qP的影响
处理前番茄幼苗全株和第2叶光合活性区域NPQ明显低于第4叶,低温处理期间NPQ呈先下降后上升的变化。幼苗全株、第2叶和第4叶的Y(NPQ)均在低温处理5 d时下降至最低点,随后,第4叶在低温处理5 d后即开始恢复,全株和第2叶从10 d后开始恢复。恢复1 d,全株、第2叶和第4叶的NPQ仍显著上升,但均未恢复至处理前水平(图7-B)。
低温处理前番茄全株、第2叶和第4叶光合活性区域的qP没有明显差异,低温处理1 d导致qP小幅下降,处理5 d时均明显上升至高于处理前水平;随后,低温处理10 d时qP又有所下降,其中第4叶和全株仍保持在不低于处理前水平,而第2叶则下降至处理前的51.3%;低温处理15 d时,全株和第4叶的qP又显著上升至高于处理前水平,而第2叶则变化不大。恢复1 d时,第2叶qP迅速恢复至处理前水平,第4叶也略有上升并高于处理前,而全株qP则下降至处理前水平(图7-C)。
3 讨论
3.1 低温胁迫影响番茄幼苗不同叶龄叶片光合活性区域面积及分布
叶绿素荧光成像技术在作物低温胁迫研究中的应用表明冷害并不是均匀发生在叶片各部分[18,22-23],本研究结果也表明低温处理引起了番茄幼苗所有叶片各荧光参数的异质性增大并且对叶龄大的叶片影响更大。进一步比较各时期不同叶龄叶片的荧光参数荧光成像和荧光活性相对面积,虽然低温导致了幼苗全株和所有叶片的荧光活性区域缩小,但对第2叶的抑制作用更明显,而靠近生长中心的第4叶则显著优于第2叶和全株水平。而且第2叶也表现出光合活性区域主要分布于近茎端和叶脉处,幼苗植株的光合活性区域整体呈现以茎尖生长点为中心向外扩散的分布趋势。这些结果均表明低温胁迫下番茄幼苗优先保护生长点和新生叶。王春萍等[5]的研究也表明低温胁迫下水稻幼苗叶片的叶龄越大越容易受到伤害,叶龄越小则对低温的抵抗能力越强。
与此同时,本研究观察到低温胁迫导致叶片光合活性区域的缩小在常温恢复1 d时即可完全恢复至处理前水平,这意味着低温导致的光合活性区域面积减少是保护性的可逆反应。植物绿色叶片低温光抑制是由于叶片吸收的光能超过碳同化所需,光能吸收与利用的失衡导致光合机构中过剩激发能的积累,最终促进了活性氧的产生和伤害的发生[24-26]。据此,推测低温胁迫下(8℃、200 μmol·m-2·s-1)番茄可以主动关闭叶片部分区域的PSII反应中心光化学活性,通过减少对光能的吸收来主动防御低温伤害,是番茄在低温胁迫下的一种自适应反应。笔者课题组前期研究也表明,番茄叶片单位面积有活性的PSII反应中心数目(RC/CS)在8℃低温处理的第1天即显著下降,并在低温处理4 d后恢复的第1天即大幅上升,也从另一侧面说明低温胁迫诱导了番茄叶片PSII反应中心的可逆失活[14]。这一现象在其他文献中未见报道,因此,需要在更多的植物种类和不同光温胁迫条件下进行研究,进一步验证植物是否具有主动关闭叶片部分区域PSII的光化学反应活性以适应低温胁迫的响应机制。
3.2 低温胁迫影响番茄幼苗不同叶龄叶片光合活性区域叶绿素荧光参数
叶绿素荧光参数反映了植物叶片PSII的功能和吸收光能分配情况。低温胁迫通常会抑制番茄幼苗叶片PSII光化学效率,从而减少叶片吸收光能分配给PSII光化学反应的比例,导致吸收光能中PSII非调节性能量耗散部分的增加和PSII光抑制的发生,表现为Fv/Fm、qP和Y(II)(或ΦPSII)的下降和Y(NO)的上升[27-29]。而低温对番茄叶片热耗散能力的影响则因低温处理条件不同而异,4℃暗处理10 h诱导了番茄品种Micro-Tom叶片NPQ增强[30],夜间5℃处理3 d也诱导了番茄品种‘L-404’叶片Y(NPQ)的增强[18],而低温弱光(15℃白天/7℃夜晚,180 μmol·m-2·s-1)处理15 d导致番茄品种‘合作903’叶片NPQ下降[28]。本研究发现8℃低温处理前期(5 d)对番茄品种‘中蔬4号’叶片光合活性区域光抑制的影响较明显,而处理后期(5—15 d)并未引起光抑制程度的加剧。低温处理后期第2叶光合活性区域面积持续下降,这表明低温处理后期番茄幼苗成熟叶可通过主动缩小叶片光合活性区域来适应低温胁迫。然而,第4叶的光合活性区域面积在低温处理后期并未下降,而其Fv/Fm反而有所上升,这意味着新生叶具有与成熟叶不同的低温光抑制防御机制。
PSII天线色素吸收光能可分为PSII光化学反应利用的能量Y(II)、PSII调节性能量耗散Y(NPQ)和非调节性的能量耗散Y(NO)三部分[31]。高Y(NO)值意味着PSII反应中心过量激发能的积累,并将成为光抑制发生的诱因[31-32]。本研究中所有叶片的Y(NO)在低温处理的前5 d迅速上升,第10 天时第2叶并没有明显变化而第4叶开始下降,第15 d时则全部呈明显下调。该结果证明了低温处理前期番茄叶片PSII反应中心激发能的积累引起了光抑制的发生,而低温处理后期PSII反应中心激发能的积累不但没有进一步加剧反而有所缓解,从而使光合活性区域的光抑制程度并未加剧,新生叶光抑制程度反而有所缓解。低温处理前期Y(NO)迅速上升的原因是由于Y(II)和Y(NPQ)同时大幅下降所致,而后期Y(NO)有所缓解的原因则主要是由于Y(NPQ)恢复上升所致。低温处理1 d即导致Y(II)大幅下降53.7%,并在随后的低温处理中一直保持低水平。Y(II)的下降表明低温降低了PSII反应中心将光能转化为电能进行电子传递的能力[33],这与笔者课题组利用快速叶绿素荧光诱导动力学分析的结果相一致,低温处理降低了番茄叶片单位面积对光能的吸收(ABS/CS)、捕获(TRo/CS)和进行电子传递(ETo/CS)的能力[14]。Y(NPQ)则在处理的前5 d内持续下降至处理前的48.0%,随后第4叶随着处理时间的延长而明显恢复上升,而第2叶和全株则在第10天后明显恢复上升,处理期间NPQ也呈现出相同的变化趋势。这些结果意味着低温处理前期不但没有诱导反而抑制了番茄光合机构热耗散的进行,低温处理后期热耗散才逐渐发挥其光保护作用。
然而,本研究还发现,番茄全株和第4叶光合活性区域qP仅表现为在处理第1 天时分别小幅下降20.1%和17.1%,随后维持在不低于或高于处理前水平。qP反映了PSII反应中心的开放程度[33],取决于QA的氧化还原程度,决定了PSII的激发能捕获速率[34]。这意味着在长达15 d的低温处理期间,番茄新生叶光合活性区域的PSII反应中心只在第1天有较小程度的关闭,随后一直维持着较高开放程度,对激发能的捕获能力增强。多数文献中低温导致植物qP下降,这主要与荧光参数测量采用光纤式荧光仪有关,在这种情况下测得的qP是测量区域内(包括光合活性区域和非光合活性区域)的qP平均值。事实上,如果以番茄全株或第4叶全叶面积(包括光合活性区域和非活性区域)所读取的qP平均值也随着低温处理时间延长而下降(数据未列出)。结合番茄全株和各叶片光合活性区域面积随着低温处理时间的延长而持续下降,而Y(II)和qP荧光活性相对面积显著低于光合活性区域相对面积这一结果,是否意味着低温胁迫除了诱导番茄叶片部分区域PSII反应中心的可逆失活,还导致光合活性区域中部分有活性的PSII反应中心关闭,但刺激了新生叶剩余有活性的PSII反应中心开放程度的提高。有研究表明,低温胁迫在降低作物叶片单位面积有活性的PSII反应中心数目(RC/CS)时会迫使作物剩余有活性的反应中心效率的提高[14,35]。而番茄新生叶对低温的这种响应是否有利于胁迫解除后叶片光合能力的恢复?本研究观察到低温处理后恢复1 d,第4叶的qP即可恢复至处理前的119.8%,荧光成像图也显示此时番茄幼苗绝大部分叶片区域呈现比处理前qP数值更高的蓝紫色,似乎佐证了这种设想。但是,与处理前相比,第2叶在低温处理后期(10、15 d)相比处理前约下降了50%,这意味着长期低温胁迫对番茄成熟叶有活性的PSII反应中心数量和开放程度均有明显的抑制作用。王春萍等[5]的研究也表明,与对照相比,低温胁迫下水稻叶龄最小的第3叶qP有明显上升,而叶龄最大的第1叶qP则显著下降。虽然有关植物低温驯化提高抗寒性有较多研究,例如辣椒在14℃亚适温驯化5 d可促进依赖于叶黄素循环的热耗散能力的增强[36],番茄在12℃/10℃低温驯化3 d后可通过激发H2O2以诱导抗氧化酶的表达与活性的上调[37],并对光合机构起保护作用。而本研究中8℃低温处理后期新生叶光合活性区域维持较高的PSII开放程度这一自适应现象在以往研究中鲜见讨论,值得深入研究。
4 结论
8℃低温处理下,番茄幼苗可通过主动降低叶片光合活性区域面积来适应低温胁迫,处理前期对光合活性区域光抑制影响显著,而处理后期光抑制程度没有加剧;叶片热耗散能力在低温处理前期受到抑制,直到处理后期才逐渐发挥其光保护作用;低温胁迫下番茄幼苗优先保护生长点和新生叶,成熟叶主要通过可逆降低光合活性区域面积来适应低温胁迫,而新生叶则主要通过维持相对较高的PSII反应中心光化学和热耗散能力防御低温光抑制;低温导致新生叶光合活性区域中部分有活性的PSII反应中心关闭的同时,刺激了剩余有活性PSII反应中心开放程度的提高,有利于低温胁迫解除后恢复期光合活性的恢复。
[1] 罗鑫辉, 刘明月, 黄科, 刘玉兵, 彭淼, 王军伟. 不同品种番茄幼苗低温适应性评价及光合特性分析. 中国瓜菜, 2021, 34(8): 49-55.
LUO X H, LIU M Y, HUANG K, LIU Y B, PENG M, WANG J W. Evaluation of low temperature adaptability and analysis of photosynthetic characteristics in different tomato varieties. China Cucurbits and Vegetables, 2021, 34(8): 49-55. (in Chinese)
[2] PARK E J, JEKNIĆ Z, SAKAMOTO A, DENOMA J, YUWANSIRI R, MURATA N, CHEN T H H. Genetic engineering of glycinebetaine synthesis in tomato protects seeds, plants, and flowers from chilling damage. Plant Journal, 2004, 40: 474-487.
[3] ALLEN D J, ORT D R. Impacts of chilling temperatures on photosynthesis in warm-climate plants. Trends of Plant Science, 2001, 6(1): 36-42.
[4] 胡文海, 喻景权. 低温弱光对番茄叶片光合作用和叶绿素荧光参数的影响. 园艺学报, 2001, 41(1): 41-46.
HU W H, YU J Q. Effects of chilling under low light on photosynthesis and chlorophyll fluorescence characteristic in tomato leaves. Acta Horticulturae Sinica, 2001, 28(1): 41-46. (in Chinese)
[5] 王春萍, 雷开荣, 李正国, 林清, 吴红. 低温胁迫对水稻幼苗不同叶龄叶片叶绿素荧光特性的影响. 植物资源与环境学报, 2012, 21(3): 38-43.
WANG C P, LEI K R, LI Z G, LIN Q, WU H. Effects of chilling stress on chlorophyll fluorescence characteristics of seedling leaves with different leaf ages of. Journal of Plant Resources and Environment, 2012, 21(3): 38-43. (in Chinese)
[6] BRÜGGEMANN W, KLAUCKE S, MAAS-KANTEL K. Long-term chilling of young tomato plants under low light.and molecular properties of two key enzymes of the Calvin cycle inMill andMill. Planta, 1994, 194: 160-168.
[7] BYRD G T, ORT D R, OGREN W L. The effects of chilling in the light on ribulose-1,5-bisphosphate carboxylase/oxygenase activation in tomato (Mill.). Plant Physiology, 1995, 107: 585-591.
[8] ARTUSO A, GUIDI L, SOLDATINI G F, PARDOSSI A, TOGNONI F. The influence of chilling on photosynthesis and activities of some enzymes of sucrose metabolism inMill. Acta Physiologiae Plantarum, 2000, 22(2):95-101.
[9] DING F, WANG M L, ZHANG S X, AN X Z. Changes in SBPase activity influence photosynthetic capacity, growth, and tolerance to chilling stress in transgenic tomato plants. Scientific Reports, 2016, 6: 32741.
[10] KEE S C, MARTIN B, ORT D R. The effects of chilling in the dark and in the light on photosynthesis of tomato: Electron transfer reactions. Photosynthesis Research, 1986, 8: 41-51.
[11] HU W H, ZHOU Y H, DU Y S, XIA X J, YU J Q. Differential response of photosynthesis in greenhouse- and field-ecotypes of tomato to long-term chilling under low light. Journal of Plant Physiology, 2006, 163: 1238-1246.
[12] 陈静, 陈启林, 程智慧, 徐春和. 花青苷对低温弱光处理的番茄(Mill.)幼苗光合机构的保护作用. 中国农业科学, 2007, 40(4): 788-793.
CHEN J, CHEN Q L, CHENG Z H, XU C H. Protective effect of anthocyanin on photosynthetic apparatus of tomato (Mill.) seedling leaves exposed to low temperature and low irradiance. Scientia Agricultura Sinica, 2007, 40(4): 788-793. (in Chinese)
[13] ZUSHI K, KAJIWARA S, MATSUZOE N. Chlorophyll a fluorescence OJIP transient as a tool to characterize and evaluate response to heat and chilling stress in tomato leaf and fruit. Scientia Horticulturae, 2012, 148: 39-46.
[14] 胡文海, 胡雪华, 闫小红, 周升团. 低温胁迫及恢复对番茄快速叶绿素荧光诱导动力学特征的影响. 中国农业气象, 2021, 42(10): 859-869.
HU W H, HU X H, YAN X H, ZHOU S T. Response of chlorophyll fluorescence transient in leaves of tomato under chilling stress and subsequent recovery. Chinese Journal of Agrometeorology, 2021, 42(10): 859-869. (in Chinese)
[15] RALPH P J, MACINNIS-NG C M O, FRANKART C. Fluorescence imaging application: Effect of leaf age on seagrass photokinetics. Aquatic Botany, 2005, 81(1): 69-84.
[16] 樊大勇, 付增娟, 谢宗强, 李荣贵, 张淑敏. 调制式荧光影像新技术: 叶片内部最大光化学量子效率及其异质性的活体测定. 植物生态学报, 2016, 40(9): 942-951.
FAN D Y, FU Z J, XIE Z Q, LI R G, ZHANG S M. A new technology of modulated Chl a fluorescence image:measurement of the PSII maximum photochemical efficiency and its heterogeneity within leaves. Chinese Journal of Plant Ecology, 2016, 40(9): 942-951. (in Chinese)
[17] KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42: 313-349.
[18] DONG Z F, MEN Y H, LI Z M, ZOU Q Y, JI J W. Chlorophyll fluorescence imaging as a tool for analyzing the effects of chilling injury on tomato seedlings. Scientia Horticulturae, 2019, 246: 490-497.
[19] 王恒. 应用于植物生理检测的高通量叶绿素荧光成像系统研究[D]. 杭州: 浙江大学, 2018.
WANG H. Research on high throughput chlorophyll fluorescence imaging system applied in plant physiology detection [D]. Hangzhou: Zhejiang University, 2018. (in Chinese)
[20] 董贞芬. 低温胁迫下番茄幼苗叶绿素荧光成像的分析及研究[D]. 沈阳: 沈阳农业大学, 2019.
DONG Z F. Analysis and study on chlorophyll fluorescence imaging of tomato seedlings under low temperature stress [D]. Shenyang: Shenyang Agricultural University, 2019. (in Chinese)
[21] BRESSON J, VASSEUR F, DAUZAT M, KOCH G, GRANIER C, VILE D. Quantifying spatial heterogeneity of chlorophyll fluorescence during plant growth and in response to water stress. Plant Methods, 2015, 11: 23.
[22] HOGEWONING S W, HARBINSON J. Insights on the development, kinetics, and variation of photoinhibition using chlorophyll fluorescence imaging of a chilled, variegated leaf. Journal of Experimental Botany, 2007, 58(3): 453-463.
[23] XIA X J, FANG P P, GUO X, QIAN X J, ZHOU J, SHI K, ZHOU Y H, YU J Q. Brassinosteroid-mediated apoplastic H2O2-glutaredoxin 12/14 cascade regulates antioxidant capacity in response to chilling in tomato. Plant, Cell & Environment, 2018, 41(5): 1052-1064.
[24] ALAM B, JACOB J. Overproduction of photosynthetic electrons is associated with chilling injury in green leaves. Photosynthetica, 2002, 40(1): 91-95.
[25] ORT D R, BAKER N R. A photoprotective role for O2as an alternative electron sink in photosynthesis? Current Opinion in Plant Biology, 2002, 5(3): 193-198.
[26] HU W H, YAN X H, YU J Q. Importance of the mitochondrial alternative oxidase (AOX) pathway in alleviating photoinhibition in cucumber leaves under chilling injury and subsequent recovery when leaves are subjected to high light intensity. The Journal of Horticultural Science and Biotechnology, 2017, 92(1): 31-38.
[27] 杨再强, 张波, 张继波, 彭晓丹, 张婷华, 张静. 低温胁迫对番茄光合特性及抗氧化酶活性的影响. 自然灾害学报, 2012, 21(4): 168-174.
YANG Z Q, ZHANG B, ZHANG J B, PENG X D, ZHANG T H, ZHANG J. Effects of low temperature stresses on photosynthetic charateristics and activity of antioxidant enzymes of tomatos. Journal of Natural Disasters, 2012, 21(4): 168-174. (in Chinese)
[28] SHU S, TANG Y Y, YUAN Y H, SUN J, ZHONG M, GUO S R. The role of 24-epibrassinolide in the regulation of photosynthetic characteristics and nitrogen metabolism of tomato seedlings under a combined low temperature and weak light stress. Plant Physiology and Biochemistry, 2016, 107: 344-353.
[29] WEI D D, ZHANG T P, WANG B Q, ZHANG H L, MA M Y, LI S F, CHEN T H H, BRESTIC M, LIU Y, YANG X H. Glycinebetaine mitigates tomato chilling stress by maintain high-cyclic electron flow rate of photosystem I and stability of photosystem II. Plant Cell Reports, 2022, 41: 1087-1101.
[30] DING F, WANG M L, LIU B, ZHANG S X. Exogenous melatonin mitigates photoinhibition by accelerating non-photochemical quenching in tomato seedlings exposed to moderate light during chilling. Frontiers in Plant Science, 2017, 8: 244.
[31] 胡文海, 张斯斯, 肖宜安, 闫小红. 两种杜鹃花属植物对长期遮阴后全光照环境的生理响应及其光保护机制. 植物生态学报, 2015, 39(11): 1093-1100.
HU W H, ZHANG S S, XIAO Y A, YAN X H. Physiological responses and photo-protective mechanisms of two Rhododendron plants to natural sunlight after long term shading. Chinese Journal of Plant Ecology, 2015, 39(11): 1093-1100. (in Chinese)
[32] KRAMER D M, JOHNSON G, KIIRATS O, EDWARDS G E. New fluorescence parameters for the determination of QAredox state and excitation energy fluxes. Photosynthesis Research, 2004, 79:209-218.
[33] MAXWELL K, JOHNSON G N. Chlorophyll fluorescence- a practical guide. Journal of Experimental Botany, 2000, 51(345): 659-668.
[34] 许大全. 光合作用效率. 上海: 上海科学技术出版社, 2002: 29-37.
XU D Q. Photosynthetic Efficiency. Shanghai: Shanghai Scientific and Technical Publishers, 2002: 29-37. (in Chinese)
[35] XU C, WANG M T, YANG Z Q, ZHENG Q T. Low temperature and low irradiation induced irreversible damage of strawberry seedlings. Photosynthetica, 2020, 58(1): 156-164.
[36] LIU P, MENG Q W, ZOU Q, ZHAO S J, LIU Q Z. Effects of cold-hardening on chilling-induced photoinhibition of photosynthesis and on xanthophyll cycle pigments in sweet pepper. Photosynthetica, 2001, 39(3): 467-472.
[37] ZHOU J, WANG J, SHI K, XIA X J, ZHOU Y H, YU J Q. Hydrogen peroxide is involved in the cold acclimation-induced chilling tolerance of tomato plants. Plant Physiology and Biochemistry, 2012, 60: 141-149.
Effects of Chilling on Chlorophyll Fluorescence Imaging Characteristics of Leaves with Different Leaf Ages in Tomato Seedlings

1School of Life Sciences, Jinggangshan University, Ji’an 343009, Jiangxi;2College of Agriculture and Biotechnology, Zhejiang University, Hangzhou 310058
This study analyzed the characteristics of chlorophyll fluorescence imaging of the 2nd (mature) and 4th (newly born) leaves of tomato seedlings in response to chilling stress, aiming to probe the mechanism of leaves with different ages adapted to chilling stress in tomato seedlings.In this study,L. cv Zhongshu No. 4 was used as the research material. The tomato seedlings in the 4-leaf stage were treated at chilling (8℃, 200 μmol·m-2·s-1) for 15 d and then recovered at normal temperature (26℃ day/20℃ night, 500 μmol·m-2·s-1) for 1 d. The Chlorophyll fluorescence imagings of the whole seedlings were measured at different stages under different treatments, and the characteristics of chlorophyll fluorescence imaging of the 2nd and 4th leaves were compared.The results showed that the relative area of photosynthetically active regions (RAP) on the 4th leaves decreased slowly during the first 5 d of the chilling stress, while the RAPon the 2nd leaves and the whole plants decreased steadily during the whole chilling treatment. The RAPrecovered completely after 1 d of recovery. Under chilling treatment, the relative area of fluorescence active regions (RAF) for quantum yield of regulatory energy dissipation (Y(NPQ)), quantum yield of nonregulatory energy dissipation (Y(NO)), and nonphotochemical quenching (NPQ) showed similar changes as that of RAP. However, the RAFof effective PSII quantum yield (Y(II)) and coefficient of photochemical quenching (qP) were significantly lower than that of RAP. The maximum PSII quantum yield (Fv/Fm), Y(NPQ), and NPQ decreased while Y(NO) increased sharply in the photosynthetically active region in tomato seedlings during the first 5 d of the chilling treatment. In the following days, the Fv/Fm remained unchanged, whereas Y(NPQ) and NPQ increased and Y(NO) decreased. However, Y(II) declined sharply 1 d after chilling stress and then remained unchanged. Interestingly, qP in the photosynthetic active region of the 4th leaves decreased only slightly after 1 d of chilling treatment, and then maintained higher than that before treatment. However, qP of the 2nd leaves increased significantly on the 5th day and then decreased rapidly. Overall, the Fv/Fm, Y(II), Y(NPQ) and qP in the 4th leaves were higher than those in the 2nd leaves, whereas the Y(NO) were relatively lower in the 4th leaves.The study found that tomato seedlings responded to chilling stress by decreasing the area of photosynthetically active regions. The regulatory nonphotochemical quenching, which played a central role in photoprotection, was inhibited in the early stage, but gradually increased during the later stage under chilling treatment. The mature leaves adapted to chilling stress likely by decreasing the size of photosynthetically active regions, while higher capacities of PSII photochemistry and thermal dissipation were maintained in the newly born leaves in response to chilling stress. The protection of shoot apex and newly born leaves might be the priority of tomato seedlings in response to chilling stress. For newly born leaves, the chilling induced the closure of some active PSII reaction centers, but improved the operating efficiency of the remaining active PSII reaction centers, which was potentially beneficial for the recovery of photosynthetic activity.
tomato (L.); chilling stress; chlorophyll fluorescence imaging; photoinhibition; leaf age

2022-04-13;
2022-06-16
江西省自然科学基金重点项目(2019ACB20017)
胡雪华,E-mail:huxuehua1210@126.com。通信作者胡文海,E-mail:huwenhai@jgsu.edu.cn
(责任编辑 赵伶俐)
