化浊解毒活血通络方通过调控核因子E2相关因子2/Kelch样环氧氯丙烷相关蛋白-1通路发挥对脑缺血再灌注损伤大鼠脑组织抗氧化作用的机制研究※
2022-02-01韩宇帆霍瑞卿李芳钊田军彪
韩宇帆 霍瑞卿 李芳钊 孙 阔 田军彪△
(1.河北中医学院第一附属医院脑病科,河北 石家庄 050011;2.河北中医学院2019级博士研究生,河北 石家庄 050091;3.河北中医学院2019级硕士研究生,河北 石家庄 050091)
缺血性脑血管病具有高发病率、高复发率、高致残率的特点,为我国成年人群致死、致残的首位病因[1]。研究表明,脑缺血一定时间,且在恢复血液供应之后,大脑功能不仅难以恢复,反而会出现更为严重的脑功能障碍,称为脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)。CIRI的发病机制十分复杂,主要涉及到氧化应激、钙离子超载、血-脑脊液屏障的损伤、炎性反应、细胞凋亡等多个方面[2],且各个方面之间相互影响,构成了复杂的网络。其中氧化应激在CIRI过程中占有重要地位。研究发现,核因子E2相关因子2(Nrf2)是一种具有神经保护作用的关键转录因子,Nrf2介导的信号通路可通过抗氧化应激途径减轻CIRI,达到治疗缺血性脑血管病的目的[3]。
田军彪教授根据临床经验发现缺血性脑血管病“浊毒闭阻清窍,瘀毒损伤脑络”的病机特点[4]。化浊解毒活血通络方即是以此病机特点为基础而拟定的具有化浊解毒、活血通络之功效的中药复方。本实验研究通过制备大鼠大脑中动脉闭塞(MCAO)模型,观察化浊解毒活血通络方通过Nrf2/Kelch样环氧氯丙烷相关蛋白-1(Keap1)通路发挥对CIRI大鼠脑组织的抗氧化作用,探讨并补充化浊解毒活血通络方可能的神经保护机制,为临床治疗CIRI提供新的思路。
1 材料与方法
1.1 实验动物 清洁级成年雄性SD大鼠80只,体质量250~280 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK(京)2016-0006。均饲养在河北中医学院动物房清洁环境内,自由进食及饮水,适应性喂养7 d后用于后续的实验。
1.2 实验药品及试剂 化浊解毒活血通络方药物组成:石菖蒲15 g,地龙15 g,茯苓15 g,泽泻6 g,黄连6 g,川芎9 g,丹参15 g,赤芍15 g,当归9 g,郁金15 g(颗粒剂,购自广东一方制药有限公司);尼莫地平片(河北医科大学制药厂,国药准字H13022049,20 mg/片);2,3,5-氯化三苯基四氮唑(TTC)染液(北京索莱宝科技有限公司,货号G3005);4%多聚甲醛溶液(武汉谷歌生物科技有限公司,货号LA0427);二甲苯(天津市永大化学试剂有限公司,货号B00102602);水合氯醛(福州文莱生物科技有限公司,货号ST1002);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,货号A003-2-2);丙二醛(MDA)试剂盒(南京建成生物工程研究所,货号A0001-3);过氧化氢酶(CAT)试剂盒(南京建成生物工程研究所,货号A007-1-1);RIPA裂解液(碧云天生物技术有限公司,货号P0013E);发光试剂盒(美国Millipore公司,货号WBKLS0500);β-actin(北京博奥森生物技术有限公司,货号bs-0061R);山羊抗兔二抗(北京中杉金桥生物技术有限公司,货号ZB2301);Nrf2抗体(北京博奥森生物技术有限公司,货号bs-1074R);Keap1抗体(北京博奥森生物技术有限公司,货号bs-4900R)。
1.3 实验仪器 CM1950型冰冻切片机(德国Leica公司);CX21型数码显微镜(日本Olympus公司);2720基因扩增仪(美国ABI公司);CFX96实时荧光定量聚合酶链式反应(PCR)仪(美国BIO-RAD公司);XU027-200型烤箱(佛山市高明温雅精密烤箱有限公司);15K型高速冷冻离心机(美国Sigma公司);S25型电动匀浆机(德国IKA公司);756MC型紫外可见分光光度计(上海精密科学仪器有限公司)。
1.4 造模及分组 采用随机数字表法将80只大鼠分为假手术组、模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组,每组16只。除假手术组外,其余组采用Longa法制备MCAO大鼠模型。大鼠术前禁食12 h,不禁水。10%的水合氯醛(1 mL/250 g)腹腔麻醉大鼠,使大鼠仰卧位固定于操作台上,消毒备皮后于颈部正中切口,分离右侧肌肉、筋膜及神经,充分暴露颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)。于CCA、ICA、ECA下穿线,CCA近心端、ICA及ECA邻近分叉处系活结,ECA近头端系2个死结,CCA近心端、ICA近头端使用微动脉夹阻断血流,在ECA的活结和死结之间用眼科剪小心剪出一个“V”形小口,使用镊子将线栓从开口处插入ECA后稍系紧ECA上近分叉处活结,从两死结中间剪断ECA并去除CCA上的动脉夹;将线栓小心插至CCA后调转方向提起ECA残端将线栓送入ICA后去除ICA上的动脉夹,缓慢沿ICA插入线栓,自分叉处起计算线栓插入约18~22 mm,当感觉有轻微阻力时停止进栓,于ICA近心端结扎该动脉。消毒手术区域后用蘸有0.9%氯化钠注射液的棉球覆盖,缺血2 h后拔出线栓使血液恢复灌注进入大鼠脑组织,结扎血管、消毒并缝合手术区域,形成脑缺血再灌注模型。假手术组大鼠不插入线栓,仅进行血管分离及缝合。各组大鼠于拔栓后1 h参照Zea-Longa评分法[5]对大鼠进行神经功能评分,1~3分的大鼠为有效模型,实验中神经功能评分为0分或4分、生命体征不稳定及死亡动物剔除,并参照随机原则从备用组中补齐实验动物。评分标准参见表1。

表1 Zea-Longa评分法
1.5 给药 根据动物与人体的每公斤体质量计量折算系数表计算出各组的给药剂量为:化浊解毒活血通络方高剂量组25 g/(kg·d)、低剂量组6.25 g/(kg·d)、尼莫地平组9.375 mg/(kg·d),各组灌胃容积2 mL;假手术组和模型组则以0.9%氯化钠注射液2 mL灌胃。每日灌胃1次,连续3 d。
1.6 观察指标及方法
1.6.1 神经功能缺损评分 灌胃3 d后,采用大鼠改良神经功能缺损评分(mNSS)[6]评估各组大鼠神经功能缺损情况。mNSS总分值为18分,0~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
1.6.2 脑梗死体积测定 mNSS评估后,每组随机选取3只大鼠麻醉断头处死,3 min内取出全脑,将脑组织置于-20 ℃冰箱中冷冻10 min后取出,于脑槽中自额极至枕极行冠状切片,连续切取5片,每片厚2 mm。将切片立即置于2% TTC磷酸缓冲液中,37 ℃避光恒温孵育30 min。染色后正常脑组织呈深红色,梗死部分脑组织呈白色。将染色后的脑组织切片置于4%多聚甲醛溶液中固定24 h拍照,应用Image J软件计算脑梗死体积。计算公式:脑梗死体积百分比=(脑梗死部分体积/整个脑组织体积)×100%。
1.6.3 脑组织病理学观察 每组随机选取3只大鼠麻醉处死,取梗死侧脑组织,横向切取约5 mm厚度,放置于4%多聚甲醛溶液固定,石蜡包埋后进行切片,切片常规使用二甲苯脱蜡,经HE染色后于400倍光学显微镜下观察脑组织的病理改变。
1.6.4 脑组织含水量测定 每组随机选取3只大鼠麻醉处死,剥取脑组织,去除小脑、嗅球,用吸水纸将脑组织吸干并称质量为湿质量(W1),恒温95 ℃于烤箱烘烤24 h至恒重后为干质量(W2),脑组织含水量(%)=[(W1-W2)/W1]×100%。
1.6.5 脑组织MDA含量及SOD、CAT活性检测 每组选取7只大鼠麻醉处死,取梗死侧脑组织100 mg,研磨制备成10%组织匀浆,4 ℃下3000 r/min离心10 min,取上清液。分别按试剂盒说明书测定MDA含量及SOD、CAT活性。
1.6.6 蛋白质免疫印迹法(Western Blot)检测脑组织Nrf2、Keap1蛋白表达 每组取3只大鼠梗死侧脑组织(1.6.5中大鼠脑组织)300 mg,剪碎后于液氮中研磨至细粉末状,分装于离心管中,加入RIPA裂解液,充分混匀,4℃,12 000 r/min离心5 min,取上清液,使用Bradford法测定蛋白质的浓度。配制分离胶及浓缩胶进行SDS-聚丙烯酰胺凝胶电泳,电泳结束后将凝胶中的蛋白转移至NC膜上,将NC膜放入封闭液中于室温下缓慢摇动封闭2 h;加入一抗(1∶250稀释)4 ℃孵育过夜;洗膜3次后加入二抗(1∶6500稀释)室温孵育90 min;使用发光试剂反应后充分洗膜,观察蛋白条带并拍照,使用Quantity one软件分析测定各目的蛋白的表达量,以目的蛋白质表达量与内参β-actin灰度值的比值分析实验结果。
1.6.7 逆转录PCR检测脑组织Nrf2、Keap1 mRNA表达 取7只大鼠脑组织梗死侧(1.6.5中大鼠脑组织)约10 mg,液氮研磨后转至1.5 mL离心管,加入0.3 mL RNA裂解液提取总RNA,按照试剂盒说明书进行逆转录合成cDNA,并以此为模板进行PCR扩增。Real-time PCR反应应用两步法反应程序,预变性95 ℃ 10 min,然后44个循环反应:95 ℃ 15 s,60 ℃ 60 s。扩增完毕后,得到各样本各目的基因及内参基因β-actin的Cq值。目的基因Cq值-内参基因β-actin的Cq值=ΔCq,按照公式Q=2-ΔCq,得到每个目的基因的Q值及Q均值,再以每个目的基因的Q值/Q均值,即各目的基因表达的相对定量值(RQ值),RQ值用于最终的统计分析。引物序列见表2。
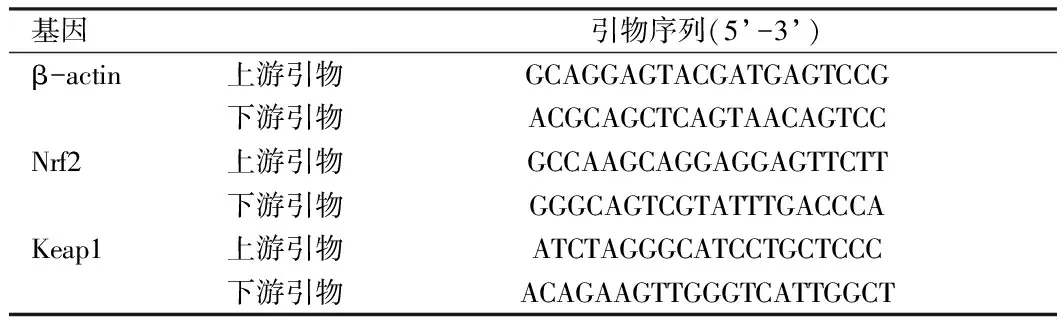
表2 Real-time PCR引物序列
2 结果
2.1 各组大鼠mNSS比较 与假手术组比较,模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组mNSS均升高(P<0.05);与模型组比较,尼莫地平组及化浊解毒活血通络方高、低剂量组mNSS均降低(P<0.05);与尼莫地平组比较,化浊解毒活血通络方高、低剂量组mNSS均升高(P<0.05);与化浊解毒活血通络方高剂量组比较,化浊解毒活血通络方低剂量组mNSS升高(P<0.05)。见表3。
表3 各组大鼠mNSS比较 分,
2.2 各组大鼠脑梗死体积比较 假手术未见明显脑梗死灶,其余组脑组织均见白色梗死灶。与假手术组比较,模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组脑梗死体积均升高(P<0.05);与模型组比较,尼莫地平组及化浊解毒活血通络方高、低剂量组脑梗死体积均降低(P<0.05);与尼莫地平组比较,化浊解毒活血通络方高、低剂量组脑梗死体积均升高(P<0.05);与化浊解毒活血通络方高剂量组比较,化浊解毒活血通络方低剂量组脑梗死体积升高(P<0.05)。见表4,图1。

表4 各组大鼠脑梗死体积比较

图1 各组大鼠脑组织脑梗死体积比较(TTC染色)
2.3 各组大鼠脑组织病理学改变 光镜下可见假手术组大鼠脑组织神经元细胞密集,排列整齐,胞浆丰富,染色均匀,胞核居中,核仁清楚,未见明显异常;模型组缺血区脑组织神经元细胞排列紊乱,水肿明显,胞浆染色变淡,出现核固缩、碎裂、溶解现象。与模型组比较,尼莫地平组及化浊解毒活血通络方高、低剂量组缺血坏死区有所减少,细胞排列紊乱、水肿、胞浆淡染色变淡、细胞核固缩、碎裂、溶解现象均有减轻。尼莫地平组、化浊解毒活血通络方高剂量组缺血坏死区减少更为明显。见图2。
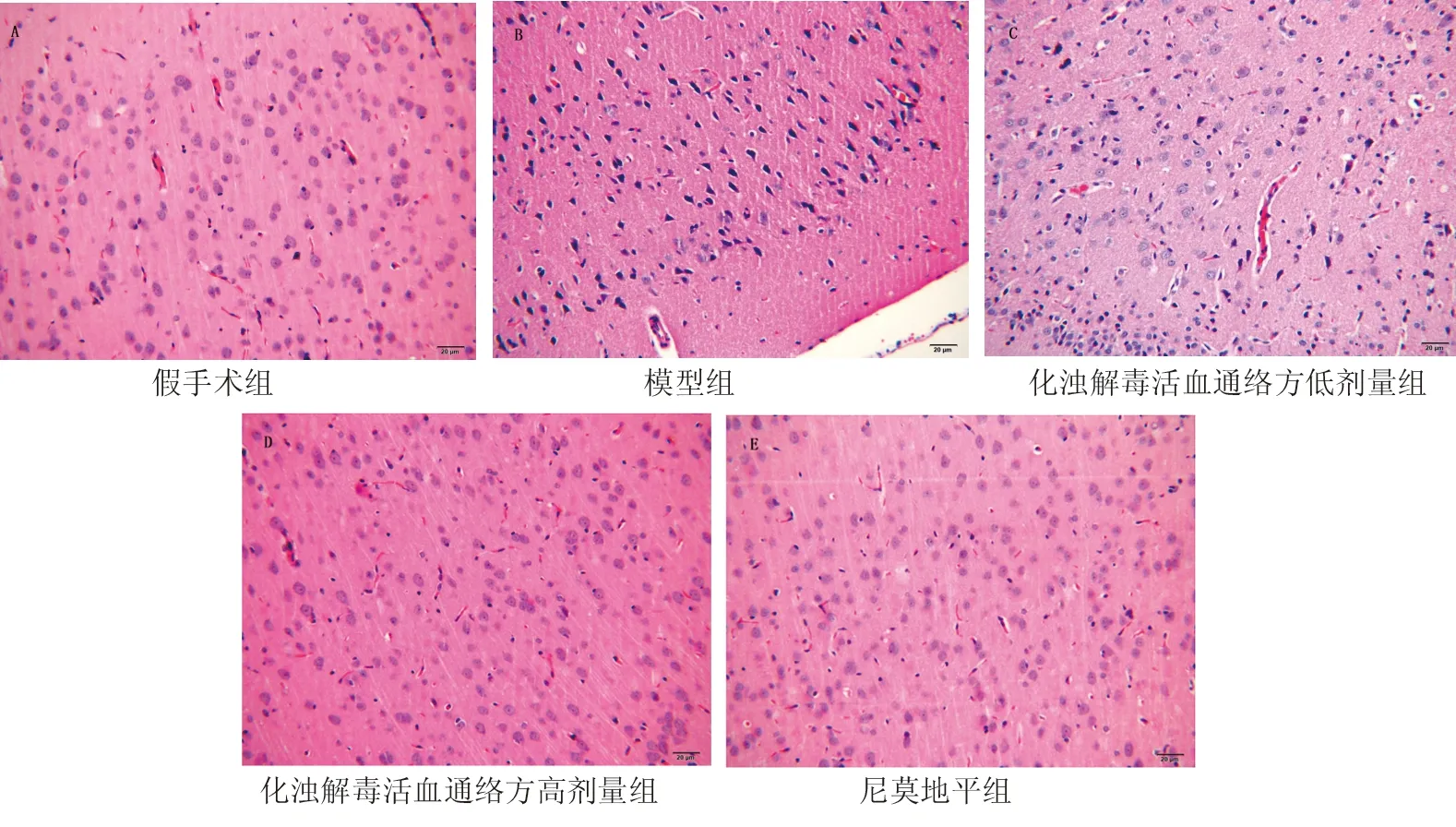
图2 各组大鼠脑组织病理学结构(HE染色,×400)
2.4 各组大鼠脑组织含水量比较 与假手术组比较,模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织含水量均升高(P<0.05);与模型组、化浊解毒活血通络方低剂量组脑组织含水量均升高(P<0.05);与尼莫地平组、化浊解毒活血通络方高剂量组比较,化浊解毒活血通络方低剂量组脑组织含水量均升高(P<0.05)。尼莫地平组与化浊解毒活血通络方高剂量组脑组织含水量比较差异无统计学意义(P>0.05)。见表5。

表5 各组大鼠脑组织含水量比较
2.5 各组大鼠脑组织MDA含量及SOD、CAT活性比较 与假手术组比较,模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织MDA含量均升高(P<0.05),SOD、CAT活性均降低(P<0.05);与模型组比较,尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织MDA含量均降低(P<0.05),SOD、CAT活性均增高(P<0.05);与尼莫地平组、化浊解毒活血通络方高剂量组比较,化浊解毒活血通络方低剂量组脑组织MDA含量均升高(P<0.05),SOD、CAT活性均降低(P<0.05)。尼莫地平组与化浊解毒活血通络方高剂量组脑组织MDA含量及SOD、CAT活性比较差异无统计学意义(P>0.05)。见表6。
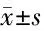
表6 各组大鼠脑组织MDA含量及SOD、CAT活性比较
2.6 各组大鼠脑组织Nrf2、Keap1蛋白表达比较 与假手术组比较,模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织Nrf2蛋白表达水平均降低(P<0.05),Keap1蛋白表达水平均升高(P<0.05);与模型组比较,尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织Nrf2蛋白表达水平均升高(P<0.05),Keap1蛋白表达水平均降低(P<0.05);与尼莫地平组、化浊解毒活血通络方高剂量组比较,化浊解毒活血通络方低剂量组脑组织Nrf2蛋白表达水平均降低(P<0.05),Keap1蛋白表达水平均升高(P<0.05)。尼莫地平组与化浊解毒活血通络方高剂量组脑组织Nrf2、Keap1蛋白表达水平比较差异无统计学意义(P>0.05)。见表7,图3。
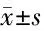
表7 各组大鼠脑组织Nrf2、Keap1蛋白表达比较

图3 各组大鼠脑组织Nrf2、Keap1蛋白条带图
2.7 各组大鼠脑组织Nrf2 mRNA、Keap1 mRNA表达比较 与假手术组比较,模型组、尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织Nrf2 mRNA表达水平均降低(P<0.05),Keap1 mRNA表达水平均升高(P<0.05);与模型组比较,尼莫地平组及化浊解毒活血通络方高、低剂量组脑组织Nrf2 mRNA表达水平均升高(P<0.05),Keap1 mRNA表达水平均降低(P<0.05);与尼莫地平组、化浊解毒活血通络方高剂量组比较,化浊解毒活血通络方低剂量组脑组织Nrf2 mRNA表达水平均降低(P<0.05),Keap1 mRNA表达水平均升高(P<0.05)。尼莫地平组与化浊解毒活血通络方高剂量组脑组织Nrf2 mRNA、Keap1 mRNA表达水平比较差异无统计学意义(P>0.05)。见表8。
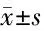
表8 各组大鼠脑组织Nrf2 mRNA、Keap1 mRNA表达比较
3 讨论
缺血性脑血管病为当前我国成年人致死致残的首位病因,其发病率呈爆发式的增长[7]。及时恢复大脑血液供应对缺血性脑血管病患者的治疗有着极为重要的意义。目前,针对缺血性脑血管病的治疗方案主要包括血管内取栓治疗、溶栓治疗、颈内动脉支架成形术、抗凝抗血小板聚集及神经保护药物治疗等[8-9]。这些治疗手段的目的均是为了改善脑血管状况,恢复大脑的供血及供氧。但脑缺血后再灌注除了可以恢复大脑功能外,也给大脑带来了新的损伤,因此,在快速恢复脑组织缺血缺氧状况的同时减轻脑缺血再灌注带来的损伤亦是本病治疗的关键。由于CIRI复杂的病理机制及对其研究方法的局限,目前尚未找到行之有效的治疗方法[10],探讨对CIRI的治疗方案已经成为医学研究的热点之一。中医药具有多方向、多靶点、不良反应小等诸多优点,因此探索能够减轻CIRI且具有神经保护作用的中医药方案对临床治疗缺血性脑血管病具有重要的价值。
氧化应激为CIRI机制研究中的热点[11],其不仅可以直接导致细胞坏死从而造成神经元死亡,而且可以通过影响细胞的基因调控诱导细胞凋亡、自噬、炎性反应等多个方面对机体造成损害。当机体受到有害刺激时,体内高活性分子如活性氧自由基(ROS)的大量蓄积超出机体的清除能力,从而对机体造成损害的过程被称为氧化应激[12-13]。研究发现,Nrf2/Keap1通路是细胞重要的内源性抗氧化通路,可通过激活该通路减轻CIRI[14]。Nrf2是一种具有神经保护作用的因子,属于Cap-n-Collar(CNC)调节蛋白家族,Keap1为Nrf2的负向调节因子[15]。正常生理情况下Nrf2与Keap1偶联形成二聚体,与肌动蛋白结合以低表达水平存在于细胞胞浆中,当机体发生氧化应激反应时,ROS通过修饰Keap1的半胱氨酸残基使其构象发生改变,使二者发生解离。与Keap1解离后的Nrf2进入细胞核内与抗氧化反应元件结合,激活下游靶基因表达,调控Ⅱ相代谢酶、抗氧化酶等基因转录及表达,从而发挥抗氧化损伤的作用,减轻CIRI[16-17]。机体内的抗氧化酶如SOD、CAT等均通过该通路表达[18]。正常生理情况下,SOD可催化超氧阴离子生成H2O2,再经过CAT及其他抗氧化酶的作用生成H2O和O2,从而减轻氧化损伤,其活性的高低可代表机体清除自由基的能力。
CIRI属中医学“中风”范畴,以“风、火、痰、瘀”为主要病理因素。现代人们因嗜食肥甘厚味、作息紊乱、酗酒抽烟等诸多不良生活习惯易形成痰浊体质,痰浊阻滞脉络日久而成瘀,瘀血与痰浊共同损伤脑络则发为中风。田军彪教授认为,“浊毒闭阻清窍,瘀毒损伤脑络”为CIRI的基本病机,结合临床经验拟定化浊解毒活血通络方。方中石菖蒲开窍豁痰,醒神益智,黄连清热解毒,郁金活血行气,三药化浊解毒,祛瘀通络,共为君药;地龙性寒,味咸,长于通行经络,具有清热通络之效,茯苓、泽泻健脾利水,化浊降脂,三药合用共为臣药;佐以赤芍、丹参、当归、川芎活血祛瘀;川芎素有“血中气药”之称,可引诸药上行于头目,亦作使药之用。全方以豁痰开窍、化浊解毒、活血祛瘀药物为主,佐以行气通络的中药,共奏化浊解毒、活血通络之功。现代药理研究显示,当归多糖作为当归的水溶性活性物质之一,可减少模型组大鼠脑组织氧化应激水平[19];黄连提取物主要成分小檗碱可通过抑制核因子κB/Nod样受体Pyrin结构域蛋白信号轴相关靶点从而减轻氧化应激反应及抑制炎性反应,达到对CIRI大鼠的神经保护作用[20];川芎中川芎嗪通过激活Nrf2/ARE通路,促使Ⅱ相酶血红素加氧酶-1(HO-1)释放,发挥清除自由基抗氧化作用[21];静脉注射芍药苷可通过增加全脑缺血模型大鼠脑组织中SOD含量、降低MDA含量减轻脑缺血对大鼠脑组织产生的氧化应激影响[22];丹参酮ⅡA可通过降低MCAO大鼠模型脑组织中MDA、一氧化氮(NO)的含量及提高SOD活性,从而起到抗自由基损伤的作用[23]。
本实验从氧化应激方面探讨化浊解毒活血通络方对MCAO模型大鼠抗CIRI的作用,与其对照的尼莫地平被证明可以通过降低CIRI大鼠脑组织中NO和MDA的含量及增加SOD活性对大鼠起到脑保护作用[24]。脂质、DNA、蛋白质等物质过氧化后产生的过氧化物会对机体造成损伤,MDA为脂质过氧化的最终产物,其含量的高低可以反映机体氧化损伤的程度[25]。本实验结果显示,模型组大鼠mNSS、脑组织梗死体积及脑组织含水量均高于假手术组大鼠(P<0.05),提示造模成功;与模型组大鼠比较,化浊解毒通络方高、低剂量组及尼莫地平组大鼠脑组织MDA含量和mNSS均降低(P<0.05),脑组织水肿均明显减轻(P<0.05),脑梗死体积降低(P<0.05),提示化浊解毒活血通络方具有较好的抗氧化应激损伤的作用;尼莫地平组及化浊解毒活血通络方高、低剂量组大鼠均较模型组大鼠脑组织Nrf2蛋白表达及mRNA转录水平均升高(P<0.05),Keap1蛋白表达及mRNA转录水平均降低(P<0.05),Nrf2/Keap1通路下游抗氧化酶SOD、CAT活性明显升高(P<0.05),表明化浊解毒活血通络方可通过调控Nrf2/Keap1通路激活下游抗氧化酶系统,从而减轻氧化应激反应对脑组织的损伤。另外,在本实验中化浊解毒活血通络方高剂量组较化浊解毒活血通络方低剂量组在降低MDA含量、增加SOD、CAT活性及调节Nrf2、Keap1基因转录和蛋白表达方面的效果更优(P<0.05),与尼莫地平组比较差异无统计学意义(P>0.05),提示化浊解毒活血通络方药物浓度对激活Nrf2/Keap1通路,改善氧化应激状态的效果具有一定影响,但最佳治疗浓度及其与西药治疗效果相比是否存在优势尚需进一步验证。
综上所述,化浊解毒活血通络方可减轻MCAO模型大鼠脑组织水肿,降低脑梗死体积,改善大鼠神经功能缺损症状,具有明显的神经保护作用。本方的作用机制可能与其通过调控Nrf2/Keap1通路激活下游抗氧化酶体系,升高抗氧化酶含量,抑制氧化应激反应对机体的损伤作用有关。
