基于网络药理学的多西他赛治疗绒毛膜癌的作用机制研究
2022-01-28金雪宁冯心怡崔树娜
金雪宁, 林 飞, 冯心怡, 李 岑, 崔树娜
(1. 扬州大学医学院, 江苏 扬州, 225000; 2. 扬州大学附属医院 妇产科, 江苏 扬州, 225009)
绒毛膜癌(CC)简称绒癌,属于高度恶性滋养细胞肿瘤,有50%的妊娠CC发生在葡萄胎之后,其余的发生在自然流产和人工流产、正常足月妊娠或早产以及异位妊娠之后[1-2]。目前常用的化疗药物有甲氨蝶呤、环磷酞胺等,但这些化疗药物毒副作用大。多西他赛与紫杉醇都属于紫杉醇类药物,但多西他赛抗肿瘤活性更高,抗癌谱更广,其机制是加强微管蛋白聚合作用和抑制微管解聚作用,导致形成稳定的非功能性微管束,因而破坏肿瘤细胞的有丝分裂[3], 在临床中被广泛应用于治疗难治性卵巢癌等[4-7]。作者的前期体外实验[8]证实多西他赛能抑制CC细胞的增殖,诱导细胞凋亡并明显抑制其侵袭能力。研究[9]报道多西他赛能降低对常规化疗药物不敏感的CC患者血清人绒毛膜促性腺激素(HCG)水平,但多西他赛治疗CC的作用机制还缺乏深入研究。网络药理学融合了系统生物学、多向药理学和计算机信息学等多门学科,建立“药物-成分-基因-靶点-通路-疾病”的多层次网络关系,探索天然药物与复杂疾病的相互关系[10-11]。本研究基于前期实验研究和临床文献结果,采用网络药理学手段探索多西他赛治疗CC的潜在作用机制,现将结果报告如下。
1 材料与方法
1.1 多西他赛、CC的靶点收集
在Genecards数据库(https://www.genecards.org/)中分别以“Docetaxol” “choriocarcinoma”为关键词检索靶点,并将其导入Excel表格中进行标准化处理,进行统计分析。
1.2 关键靶点筛选
将多西他赛所对应的靶点基因和CC相关的靶点基因进行映射,获得两者的共同基因,即多西他赛治疗CC的作用靶点。
1.3 蛋白质互作(PPI)网络构建
将筛选出的基因输入String 11.0数据库,将蛋白种类设置为人类(homo sapiens), “minimum required interaction score”参数设置为“highest confidence(0.900)”, 其余参数保持初始默认设置,导出PPI数据文件,建立蛋白与蛋白之间的网络。将结果导入Cytoscape软件,对结果进行可视化。
1.4 Hub基因筛选
通过Cytoscape软件的Cytohubba插件中的MCC算法,计算并筛选排名前10位的多西他赛治疗CC的Hub基因。
1.5 基因本体论(GO)富集和京都基因和基因组百科全书(KEGG)通路富集
将共同基因输入DAVID 6.7数据库(http://david.ncifcrf.gov/)进行GO富集分析和KEGG通路分析,研究多西他赛治疗CC的关键靶点的生物功能以及参与的信号通路,以P<0.05和错误发现率(FDR)<0.05作为筛选条件,筛选具有显著差异的生物过程和靶点通路。
2 结 果
2.1 靶点蛋白PPI网络的构建
在Genecards数据库分别以“Docetaxol”和“choriocarcinoma”为关键词检索靶点,分别获得953和1 137个靶点,将1 137个疾病靶点与953个药物靶点输入Venny2.1 软件绘制韦恩图,筛选出294个共同靶点,见图1。将共同靶点在String 11.0 平台分析的数据导入Cytoscape3.6.1软件,构建PPI网络模型。以Combined_score>0.9为筛选条件绘制PPI网络图,其中节点为靶点蛋白,边为各蛋白间互作关系,节点连接边数越多代表其在网络中作用越重要,见图2。通过Cytoscape 软件插件Cytohubba计算排名前10位的Hub基因,其中TP53、AKT1、CASP8、STAT3等是多西他赛治疗CC的关键基因。见图3。

图1 药物和疾病靶点韦恩图
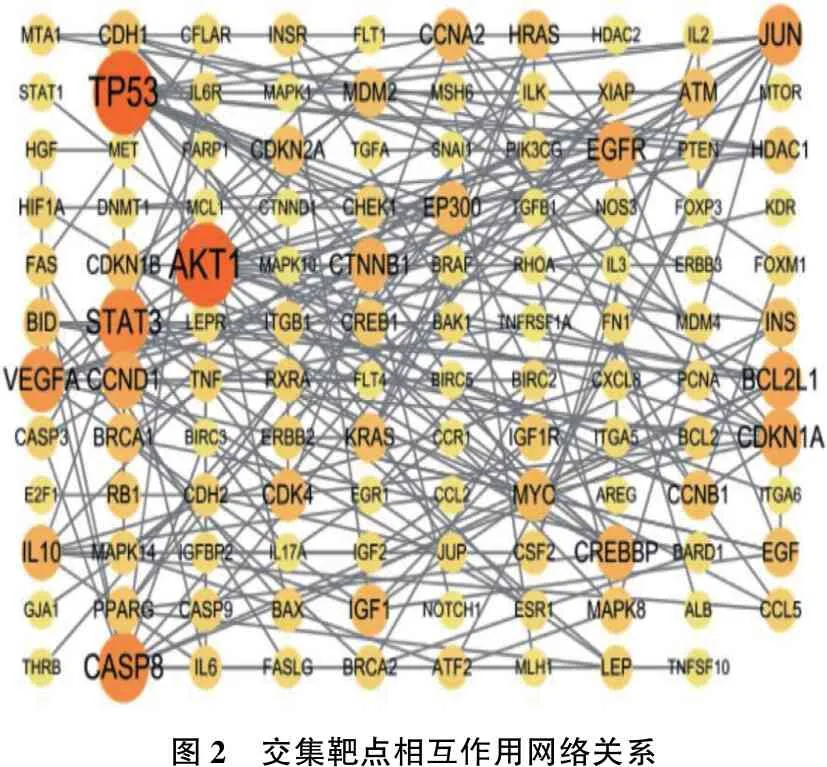
图2 交集靶点相互作用网络关系
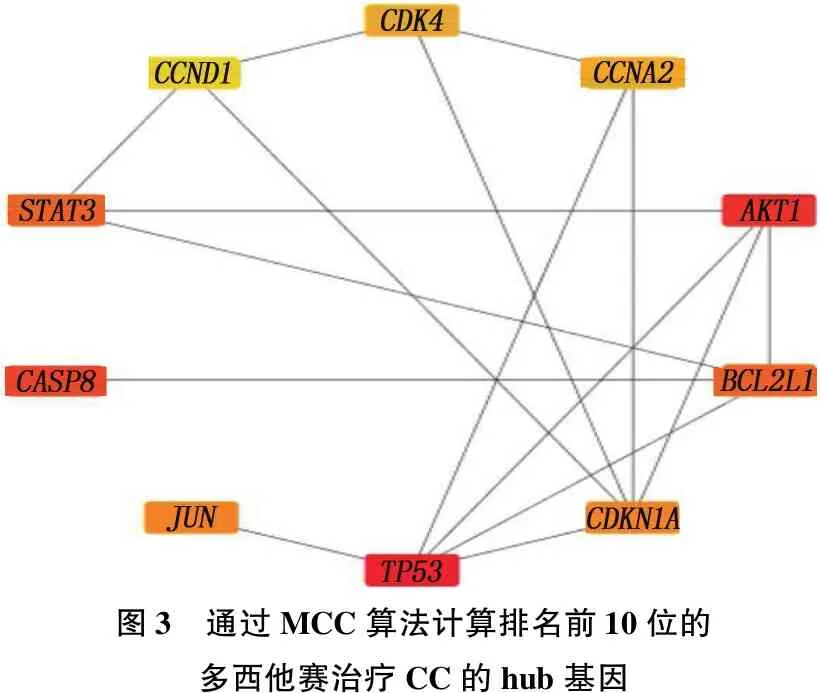
图3 通过MCC算法计算排名前10位的多西他赛治疗CC的hub基因
2.2 GO功能和KEGG富集分析
将294个预测靶点导入DAVID数据库中进行GO富集分析和KEGG通路分析。GO富集分析中,参与的生物过程有409个,主要包括调控细胞增殖(细胞增殖调节)、细胞凋亡(细胞凋亡负调控、细胞死亡的调控、程序性细胞死亡的调控)、信号传导(信号传导的正调控)、调节分子代谢(大分子代谢及合成过程的正调控、有机物质的反应等)。KEGG通路富集分析确定了28条相关信号通路,主要涉及癌症通路、细胞凋亡通路、Focal Adhesion通路和p53、ErbB、MAPK等信号通路。见图4、图5。

图4 多西他赛潜在靶点的富集分析(生物过程)

原点由小到大代表分值逐渐升高,靶点富集数目多,通路显著性逐渐增强; 颜色由蓝变红代表P值逐渐减小。图5 多西他赛潜在靶点的KEGG通路注释图
3 讨 论
CC属于恶性滋养细胞癌,是由滋养层滋养细胞增殖引起的恶性转化,导致这种转化的分子机制尚未确定。CC可继发于葡萄胎妊娠,也可继发于非葡萄胎妊娠,病情发展迅速,病死率高,主要通过血行播散,转移早且易扩散,肺是CC最易转移的部位,其次为阴道、盆腔等,转移部位皆有局部出血灶[1, 12]。
多西他赛也称多西紫杉醇,是紫杉醇类化学药物的衍生物,临床应用广泛,常被用于治疗难治性卵巢癌等,但其应用于CC方面的研究较少[4-6]。作者前期实验研究发现,多西他赛可以抑制CC细胞增殖的能力,并能诱导CC细胞凋亡,其作用浓度与时间呈正相关,并能明显抑制CC细胞体外侵袭的能力[8]。对高度化疗耐药的CC细胞,每周使用单剂多西他赛可快速降低HCG水平(超过95%), 且对人体毒性最小,但其作用机制有待进一步深入研究。
本研究结果发现,多西他赛可靶向P53、AKT1、STAT3、VEGFA等294个基因,参与细胞凋亡与增殖的调控、分子合成与代谢的调控等主要生物过程。抑癌基因TP53编码p53肿瘤蛋白,其能调节细胞周期和避免细胞癌变发生。任何导致TP53失活的突变都会引起其抑癌功能的丧失而导致癌症发生[13]。研究[14]发现女性TP53突变携带者罹患CC的风险更高,且易产生化疗耐药,因此靶向调控p53对于多西他赛治疗CC具有重要的临床价值。蛋白激酶B1(AKT1)是AKT的一个亚型,是生存信号通路PI3K/AKT的关键分子,与肿瘤细胞的生长、增殖、促进细胞侵袭和转移以及促进血管形成密切相关。研究[15]发现,在CC细胞系中,逆转AKT1表达可能通过抑制PI3K/AKT信号通路及靶向负调控VEGFA表达,最终抑制CC细胞增殖、迁移和侵袭。信号转导与转录激活因子3(STAT3)是一类具有信号转导及转录调控双重功能的蛋白质家族,激活后与DNA分子结合发挥作用[16]。多项研究[17-18]证实STAT3是参与恶性细胞转化的信号转导介质, IL-6/STAT3通路与CC细胞增殖密切相关,阻断 STAT3信号通路能够抑制CC细胞的增殖,并诱导CC细胞凋亡。
研究[19-20]表明, p53信号通路与肿瘤发展及预后密切相关,其可以激活多条信号通路,阻碍细胞周期,诱导细胞凋亡,促进细胞衰老以及DNA修复过程,最终抑制肿瘤生长。研究[21]发现p53和p21CIP1是p53信号通路中重要的靶基因,在CC JEG-3细胞中,细胞周期蛋白依懒性激酶抑制剂p21CIPI表达被激活后,使G2细胞周期蛋白依赖性激酶CDK1表达显著降低,同时p53丝氨酸磷酸化水平增加, p53信号通路激活后使细胞周期阻滞在G2/M期,进而激活DNA损伤反应通路,抑制细胞增殖。
本研究借助网络药理学方法对多西他赛和CC进行靶标挖掘和通路分析,得到294个共同靶向基因和CC多条信号通路,包括TP53、AKT1、STAT3、VEGAF等基因以及细胞凋亡通路、p53通路等信号通路,证明了多西他赛可能通过调节多个靶基因、调控蛋白表达和信号传导通路而发挥对CC的治疗作用,初步揭示了多西他赛治疗CC的作用机制,为后续临床研究提供了新思路。
