楸树无糖组织培养快繁技术初探
2022-01-28孙玲凌
张 蕊, 石 娜, 孙玲凌, 李 艺
(周口职业技术学院农牧工程学院,河南周口 466000)
我国自20 世纪 70 年代开展植物组织培养研究以来,组培技术在观赏植物研究中得到了广泛的应用,为优质植物苗木的繁育和工厂化苗木的生产提供了可靠技术。但由于组培苗技术存在培育周期长、对无菌环境要求高、培养过程易污染、组培苗移栽成活率低等不足,使组培技术在生产上的应用受到一定限制。20世纪80年代末日本学者古在丰树教授提出了无糖组织培养技术,人工控制培养条件,特别是在高浓度CO和高光照度的条件下,利用植物自身光合作用合成的碳源为植物自身的生长提供有机物质,而去除培养基中的糖类物质,因此减少了培养基污染的机会,因而能在开放条件下进行培养。由于无糖组织培养技术中植物的生长环境更接近自然环境,因而无糖组培苗移栽减少了训化时间,缩短了育苗周期,并提高了移栽成活率。目前国内外在枣、核桃、毛白杨、棕榈、咖啡、桉树、葡萄、万年青等植物上都有报道。
植物光自养微繁培养苗木需要特殊的容器,操作要求相对严格,投资成本较高,目前主要应用于实验室范畴,生产中大规模应用较小;目前关于楸树组培技术的报道较多,但国内外尚未有关于楸树的无糖组培技术报道。本试验以周楸带叶柄叶片为外植体,研究叶柄部位在不同光照度、基本培养基和外源激素下诱导生根和腋芽再生植株的最适培养条件,在近常规环境下利用叶片进行根诱导和植株再生,旨在为楸树优质苗木生产技术的研究提供理论依据。
1 材料与方法
1.1 材料与处理
供试楸树叶片采集于河南省周口市河南花博士花卉有限公司楸树种植基地。
试验于2020年5月5日在基地采集发育成熟、生长健壮的功能期叶片,用锋利的刀片徒手沿叶柄基部将叶片从母株上切割下来,切割下来的叶片要完整,保留叶片和叶柄及叶柄基部部分木质部组织,同时要注意保留叶柄基部的腋芽,然后对离体材料的叶柄进行处理使分生组织外露;将叶片及叶柄在自来水下冲洗5min,然后用蒸馏水反复冲洗,70%乙醇浸泡30 s后,接种到种子发芽盒中进行水培培养;2020年6月14日栽培到容器中。
1.2 试验设计
试验光照度设2个水平:3 000、5 000 lx;Hogland培养液浓度设2种水平:1/2Hogland+1%大蒜素、1/4Hogland+1%大蒜素;植物生长调节剂萘乙酸(NAA)、细胞分裂素(6-BA) 分别设4个水平:NAA(0、0.1、0.2、0.4 mg/L);6-BA(0、0.2、0.4、0.8 mg/L)共计64个处理。
试验在普通组培室进行,所用种子发芽盒为 13×19×12 cm透明塑料种子发芽盒,每个处理培养叶片10张,每盒2张叶片;水培培养介质为高密度无土栽培水培植物专用泡沫板。
接种前对组培室进行紫外线灭菌处理,种子发芽盒、自封袋和泡沫板进行紫外线处理后,再用无水乙醇处理30 min。所用培养液进行高压灭菌处理。培养温度为25~28 ℃,光照时间为10 h/d,12丝自封袋密封保湿培养3 d,然后打开自封袋口培养,待组培苗生根后去除自封袋,在开放环境进行生长,生根后移栽到容器中培养为独立植株。
1.3 观察记录与数据统计
5 d后观察愈伤组织、根系、腋芽形成及生长情况,记录开始生根时间,培养40 d时统计生根率、腋芽高度、植株干质量和愈伤组织黏化叶片数目:计数法统计全部试验处理生根情况,然后计算生根率;腋芽高度为植株基部至主茎顶部的距离,测量全部试验处理已发芽的植株高度,然后计算不同光照度(3 000、5 000 lx)、不同培养液浓度(1/2Hogland+1%大蒜素、1/4Hogland+1%大蒜素)条件下植株的平均高度;植株干质量测定为随机抽取1个不同植物生长调节剂组合的试验处理(NAA 0 mg/L+6-BA 0.2 mg/L),然后分别统计该处理在不同光照度(3 000、5 000 lx)、不同培养液浓度(1/2Hogland+1%大蒜素、1/4Hogland+1%大蒜素)条件下,去除叶柄后的再生植株的干质量。
1.4 数据分析
试验数据用SPSS 22.0进行统计分析。
2 结果与分析
2.1 不同光照度对楸树叶片生根率、腋芽高度和植株干质量的影响
光照为绿色植物光合作用提供能源,是植物进行光合作用的必要条件,在光照度达到光饱和点之前,随着光照度增加,光合速率提高,大多数木本植物阳生叶片光补偿点为1.0~1.5 klx,光饱和点为20~50 klx。从表1可以看出,楸树离体叶片在光照度5 000 lx时叶片的生根率、腋芽高度和再生植株干质量均高于处理3 000 lx,但差异不显著。
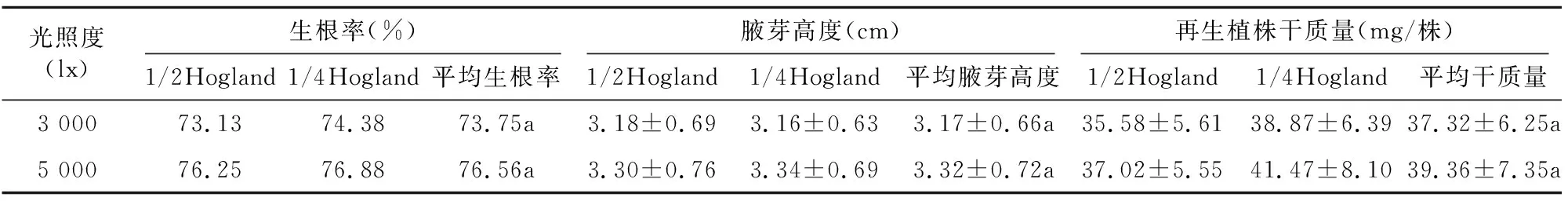
表1 光照度对楸树叶片生根率、腋芽高度和植株干质量的影响
肉眼观察比较不同光照度下根系和腋芽生长情况亦无显著差异,尽管高光强可以提高楸树叶片的光合速率,为楸树植株再生合成更多有机物质,但试验结果表明,光照度3 000 lx条件下植物光合作用合成的有机物即可满足楸树叶片植株再生需求。
2.2 不同浓度培养液对楸树叶片生根率、腋芽高度和植株干质量的影响
离体楸树叶片维持生存并进行植株再生,需要利用叶柄从培养液吸收水分和所必需的矿物质来参与调节生命活动。从表2可以看出,离体楸树叶片对培养液中无机盐要求浓度较低,其生根率和植株干质量在1/4 Hogland培养液浓度下表现均优于1/2Hogland培养液,但二者无显著差异。在1/2 Hogland培养液中,愈伤组织褐化或发黏个体数比较多,愈伤组织生长缓慢甚至停止,愈伤组织迟迟不生根,而进一步影响叶片植株再生;1/2 Hogland培养液中黏化比例达15.00%,1/4 Hogland培养液中黏化比例则为8.13%,2种不同浓度培养液中愈伤组织黏化植株数目差异显著(表2、图1)。

表2 不同培养液浓度对楸树叶片生根率、植株干质量和愈伤组织黏化的影响

2.3 不同组合外源激素对楸树叶片生根时间、生根率和腋芽高度的影响
由表3可知,当培养液中不含NAA,外源激素 6-BA 含量为0~0.4 mg/L时, 楸树叶片生根率和腋芽高度均随着6-BA浓度的增加而增加;随着培养液中NAA浓度的增加,楸树叶片生根和生长所需最适的6-BA浓度逐渐降低。培养液中NAA与 6-BA 不同组合中,NAA 0.1 mg/L+6-BA 0.2 mg/L、NAA 0.2 mg/L+6-BA 0 mg/L和NAA 0.4 mg/L+6-BA 0 mg/L 3个处理中,植株生根率可达90%及以上;腋芽高度在NAA 0.1 mg/L+6-BA 0.2 mg/L、NAA 0.1 mg/L+6-BA 0.4 mg/L、NAA 0.1 mg/L+6-BA 0.8 mg/L及NAA 0.2 mg/L、NAA 0.4 mg/L与6-BA不同浓度组合的处理中均表现较好长势,植株高度均在 3.00 cm 以上。
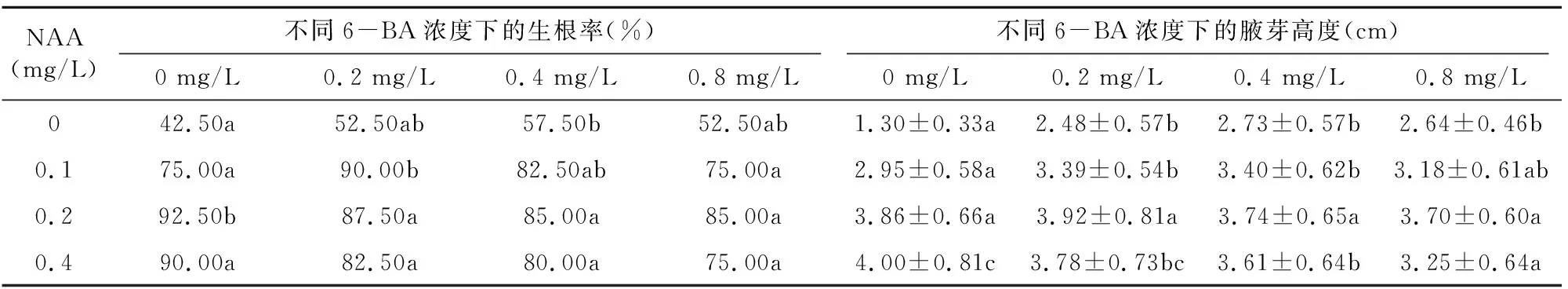
表3 不同组合外源激素对楸树叶片生根率和腋芽高度的影响
从表4可知,在楸树叶片培养中,NAA 0.1 mg/L+6-BA 0.2 mg/L组合,愈伤组织培养5 d出现,出现早且生长快,提高NAA浓度,愈伤组织出现时间反而较晚;NAA 0.2 mg/L+6-BA 0 mg/L 组合和NAA 0.4 mg/L+6-BA 0 mg/L 组合最早生根,低浓度NAA培养液中,愈伤组织需要较长时间的培养才能生根。
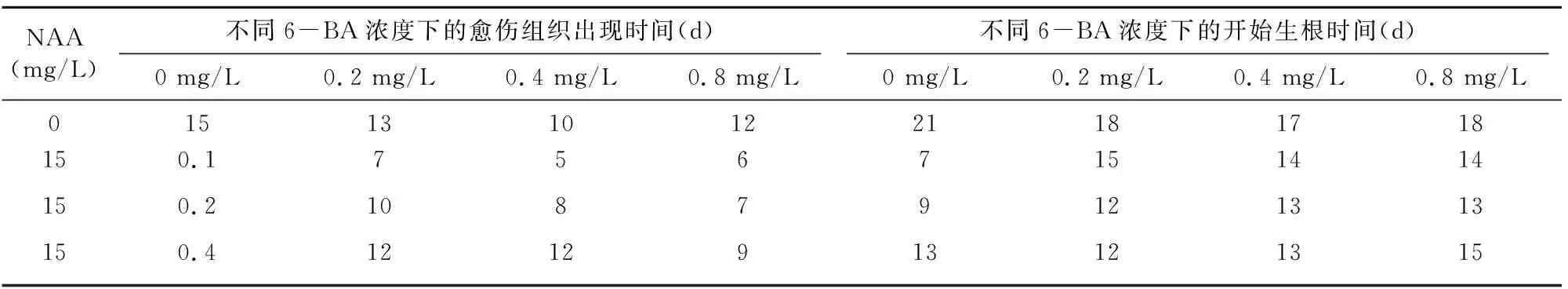
表4 不同组合外源激素对楸树叶片愈伤组织出现时间和生根时间的影响
培养中发现,在较低NAA和适当6-BA的条件下,离体楸树叶片往往先长出腋芽,而后生根形成植株(图2)。当培养液中NAA浓度较高而 6-BA 浓度较低时生根则更容易(图3)。


2.4 移栽条件及管理措施
将培养40 d生根的离体楸树叶片移栽到园土 ∶草炭土=4 ∶1的基质中,然后室外遮阴培养,白天由于气温高、天气炎热要注意多人工洒水降温、增加空气湿度。移栽时可带腋芽移栽,腋芽直接发育成植株(图4-a);移栽时如切去腋芽,在移栽后3 d左右陆续发芽,且诱导芽发育整齐,生长快(图4-b)。

3 讨论与结论
具有一定面积含有叶绿素的叶片能独立进行光合作用,从而合成植物生长所需的有机化合物。无糖组培利用绿色植物通过光合作用合成植物生长所必需的碳水化合物,在光合速率达到饱和前,光照度制约光合作用,通常2 000~3 000 lx的光照度可满足外植体光合作用和对光通量的需求,如周锺信等在对非洲菊再生小茎芽无糖组培培养中发现,2 800、8 000 lx光照度对试验结果无明显影响,认为过度提高光照度会因过多消耗而提高育苗成本。本试验发现,离体楸树叶片培养40 d时的生根率、再生腋芽株高及再生植株的干质量在 5 000 lx 条件下高于3 000 lx,但差异不显著,表明光照度在3 000 lx下,离体楸树叶片合成的碳水化合物等有机物即可以满足植株再生的要求,这可能与楸树叶片为发育成熟的叶片,光合面积比较大、光合效率较高,组培室采光比较好,培养环境更接近自然光照条件有关。这为下一步研究如何更有效地利用人工光源对培养过程进行补光,楸树叶片培养过程中对不同波长光的吸收利用及光周期对根和芽诱导的影响提供了一定的思路。叶片的光合作用不仅能为芽、茎、切口发育源源不断地提供碳水化合物,而且叶片自身产生的内源激素及其他生根促进物,更有利于楸树离体叶片发育成再生植株。
土壤中的矿质元素必须溶于水才能被植物根系吸收,在植物组织培养中常用琼脂作为支撑材料,因其透气性和营养元素移动性差等原因而造成组培苗根系发育慢。采用塑料泡沫、岩棉、蛭石、珍珠岩等多空材料代替琼脂等凝胶类物质可通过改善根系生长环境而促进根系和组培苗的生长,同时固体基质对营养元素的浓度具有一定的缓冲作用,营养元素通过水分逐渐被植物根系吸收一部分,而大部分会随着水分流失;而水培能极大地节约人工,劳动强度小,避免营养元素流失,更适合立体栽培。本试验采用Hogland培养液,研究发现尽管离体楸树叶片的生根率和再生植株干质量在2种不同浓度的培养液条件下无显著差异,但在1/2Hogland培养液条件下,离体楸树叶片愈伤组织黏化植株的数量高于1/4Hogland培养液,差异达显著水平,这可能与培养液中离子浓度过高有关。培养液中的各种营养元素全部溶解在水中,能及时被植物吸收利用,但在培养期间如果培养液中离子浓度超过植物器官忍耐程度,就会对新生长的愈伤组织产生毒害;同时由于楸树叶面积比较大,对于N、P、K、Mg等易移动元素,可被运输到生长中心而被重复利用,能较大地满足再生植株生长需要,所以在试验中1/4Hogland培养液综合优于1/2Hogland培养液,且节约了成本,避免资源浪费。
植物生长调节剂在愈伤组织诱导、生长和分化中起重要作用,同一种植物生长调节剂的不同浓度及不同植物生长调节剂的配比对愈伤组织的诱导和分化会产生不同影响,NAA 和6-BA不同浓度及 6-BA/NAA 不同比值在楸树常规组培的近年研究报道较多。杨燕从筛选楸树各种外植体入手,发现1.0 mg/L NAA对楸树无菌苗诱导生根效果最好;高浓度6-BA和高比值6-BA/NAA条件下形成的愈伤组织质地紧密,但易褐变;低浓度 6-BA 和低比值6-BA/NAA条件下形成的愈伤组织质地疏松,不易褐变,且容易分化不定根。楸树无糖组培培养试验发现:当NAA为 0.1 mg/L,同时6-BA为 0.2 mg/L时,离体楸树叶片的叶柄愈伤组织出现最早,继续提高NAA 和6-BA浓度,愈伤组织出现时间反而推迟,表明较低生长素和适当细胞分裂素的条件下更加适合愈伤组织分化与生长。而相反当培养液中不含6-BA,NAA浓度为0.2、0.4 mg/L时,离体楸树叶片的叶柄最早出现不定根,表明较高生长素浓度和较低的细胞分裂素浓度时愈伤组织生根更容易。同时试验结果表明,楸树无糖组织培养过程中所需NAA 和6-BA浓度比常规组织培养中所需浓度低,这可能与离体叶片能够合成部分内源激素有关,这为下一步对楸树离体叶片无糖组织培养内源激素及生理生化物质变化研究明确了方向。
楸树叶片诱导植株移栽后,去除原有腋芽的再生植株生长速度要快于保留腋芽的再生植株,且去除腋芽的再生植株的生长整齐度高,这可能与切去腋芽更有利于根系发育有关。腋芽的去除减少了地上部分营养成分的消耗,减轻了移栽初期根系的负担,有益于移栽初期根系的发育。
综上所述,本研究通过试验从2个光照度、2个Hogland培养液浓度、植物生长调节剂NAA和6-BA 16个不同浓度组合的64个处理中筛选出较佳培养条件:3 000 lx、1/4Hogland、NAA 0.1 mg/L+6-BA 0.4 mg/L、NAA 0.2 mg/L+6-BA 0 mg/L。该培养方法可以在开放环境中进行,利用离体楸树叶片水培培养再生植株,操作流程简化,节约成本,缩短了育苗周期,可为楸树育苗生产技术提供一种新的方法。
