基于网络药理学探讨北沙参干预糖尿病的分子机制
2022-01-27古军霞孙会改郑玉光严玉平韩晓伟
古军霞, 孙会改, 李 阳, 郑玉光, 郑 倩, 严玉平, 韩晓伟
(河北中医学院,河北省中药炮制技术创新中心,河北 石家庄 050200)
糖尿病是全世界最主要的慢性非传染病之一,近年来发病率呈上升趋势[1]。中医认为,糖尿病是“气阴两虚,气虚血瘀”之症[2],基于多项临床研究[3-4]、名老中医经验总结[5-6]及数据挖掘结果显示[7-8],它主要分为肺胃阴虚热盛、肝肾阴虚、气阴两虚、阴阳两虚等7类,临床治则清热养阴、温阳补肾、祛湿化痰、益气健脾、活血化瘀。北沙参为阴虚及气阴两虚型处方的核心药物之一[9-10],临床上常用于治疗肺热燥咳、劳嗽痰血、胃阴不足、热病伤津、咽干口渴等症[11],含聚炔类、苯丙素类、黄酮类、甾体类、萜类、多糖类等成分[12-14],具有免疫调节、抗肿瘤、抗炎、抗氧化、保肝等作用[15-19],但关于它治疗糖尿病的研究还较少。临床报道,北沙参生脉散可以治疗气阴两虚型的糖尿病,疗效明显[20],但分子机理尚不清楚。
本研究以北沙参8种主要成分为基础,利用网络药理学构建成分-靶点-通路-疾病网络,探讨干预糖尿病的多成分、多靶点、多通路的作用机制,为相关研究奠定基础。
1 材料和方法
1.1 活性成分与中药靶点的筛选 活性成分从TCMSP数据库 (http://lsp.nwu.edu.cn/tcmsp.php)获取,以关键词“北沙参”得到相关信息。以口服生物利用度(OB)、类药性(DL)为标准,筛选出同时满足OB≥30%、DL≥0.18及对应的靶点。
1.2 糖尿病靶点筛选与预测 把“Diabetes Mellitus”关键词输入NCBI(https://www.ncbi.nlm.nih.gov/)GEO数据库中检索糖尿病患者高通量数据,下载了以GPL22448 Phalanx Human lncRNA One Array v1_mRNA为平台,来源包括糖尿病患者与正常人的基因芯片数据集GSE95849,得到糖尿病的差异表达基因。
1.3 蛋白相互作用网络构建与分析 将蛋白靶点导入String数据库(https://string-db.org/),限定物种为人, 进行蛋白互作分析,选取0.7的高置信度并保存结果,从而确保数据的可靠性。利用Cytoscape软件将导出文件中的node1、node2和combined score信息导入并绘制相互作用网络。节点(node)大小表示度值(Degree)的大小,边(edge)的粗细表示combined score的大小。
1.4 生物过程与通路分析 运用cluster Profiler对与糖尿病相关的“活性成分-潜在靶点”网络中的蛋白分别进行GO功能富集分析及KEGG信号通路分析,从而获得显著富集的基因功能和信号通路。
1.5 成分-靶点-通路-疾病网络构建 在Excel表中将58种成分的预测靶点和通路分析构建“药材-药效成分”“药效成分-靶点”“靶点-通路”“通路-疾病”之间的相互关系,以药材、药效成分、靶点蛋白、通路和疾病为5类节点,它们之间有相互关系的分别用边相连, 采用Cytoscape 3.6.1软件的关联 (Merge) 功能构建北沙参-成分-靶点-通路-疾病网络模型。
1.6 分子对接 采用Systems Dock Web Site(http://systemsdock.unit.oist.jp/iddp/home/index)对蛋白相互作用网络中度值靠前的4个靶点与北沙参主要药效成分进行分子对接验证。以二甲双胍(Metformin)为对照,整理对接结果中的docking score并分析。
2 结果
2.1 活性成分 活性成分共8种,见表1。

表1 北沙参中活性成分
2.2 作用靶点筛选(差异基因) 从GEO下载并导出平台文件和矩阵文件,对数据进行注释,将探针名称转换为基因名称,并且将正常组和实验组数据进行分组,原始数据以P<0.05为条件进行过滤后,选取糖尿病组织/正常组织上、下调差异倍数>1.51作为选取条件,共得到5 817个疾病靶点及热图(图1)、火山图(图2)。取北沙参活性成分作用靶点和糖尿病相关靶点的交集,共获得58个靶点。

图1 GEO数据库差异热图
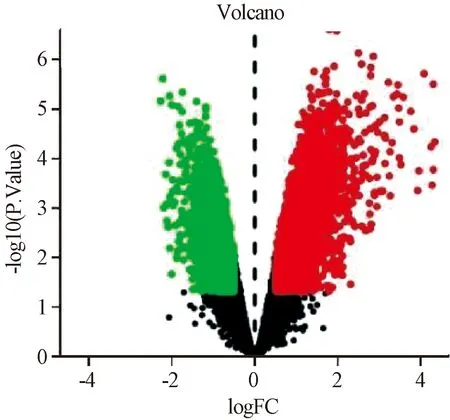
图2 GEO数据库差异火山图

图3 活性成分调控网络图
2.3 活性成分-作用靶点网络 “药物-成分-疾病-靶点”网络图见图3,有61个节点、81条边,红色三角表示靶点基因(共58个),玫红椭圆表示北沙参中的8种活性成分,蓝色菱形为北沙参3种主要成分[甾醇类(Sterol)、香豆素类(Coumarin)和酚酸类(Phenolic Acids)];度值最高的活性成分为槲皮素(Quercetin),其次为豆甾醇(Stigmasterol)、β-谷甾醇(beta-Sitosterol)。
2.4 蛋白相互作用网络与关键靶点
2.4.1 PPI蛋白互作网络 北沙参可与3 320个靶点产生直接或间接作用,不同靶点之间联系达82 802种。
2.4.2 关键靶点 采用Bisogenet插件,以Degree>81、Betweenness≥400为条件,对蛋白互作网络节点进行拓扑结构分析,发现关键靶点56个,见表2,筛选策略见图4。
2.5 GO、KEGG富集分析 GO富集分析见图5,分子功能集中在RNA聚合酶Ⅱ特异性DNA结合转录因子(RNA polymerase Ⅱ-specific DNA-binding transcription factor binding)、DNA结合转录因子(DNA-binding transcription factor binding)、核激素受体结合(nuclear hormone receptor binding)等,生物过程集中在响应营养水平(response to nutrient levels)、响应氧化应激反应(response to oxidative stress)、响应抗生素(response to antibiotic)、细胞响应化学胁迫(cellular response to chemical stress)、细胞响应细菌源的分子(cellular response to molecule of bacterial origin),细胞组成集中在膜区域(membrane region)、膜筏板(membrane raft)和膜微区(membrane microdomain)、转录调节复合体(transcription regulator complex)和内腔囊泡(vesicle lumen)。
KEGG富集分析见图6,58个潜在靶点基因所涉及到的通路共有168条,前10条分别为内分泌抵抗(Endocrine resistance)、NF-kappa B信号通路(NF-kappa B signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、细胞凋亡(Apoptosis)、细胞衰老(Cellular senescence)、Ras信号通路(Ras signaling pathway)、MAPK信号通路(MAPK signaling pathway)、FoxO信号通路(FoxO signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、P53信号通路(P53 signaling pathway)。
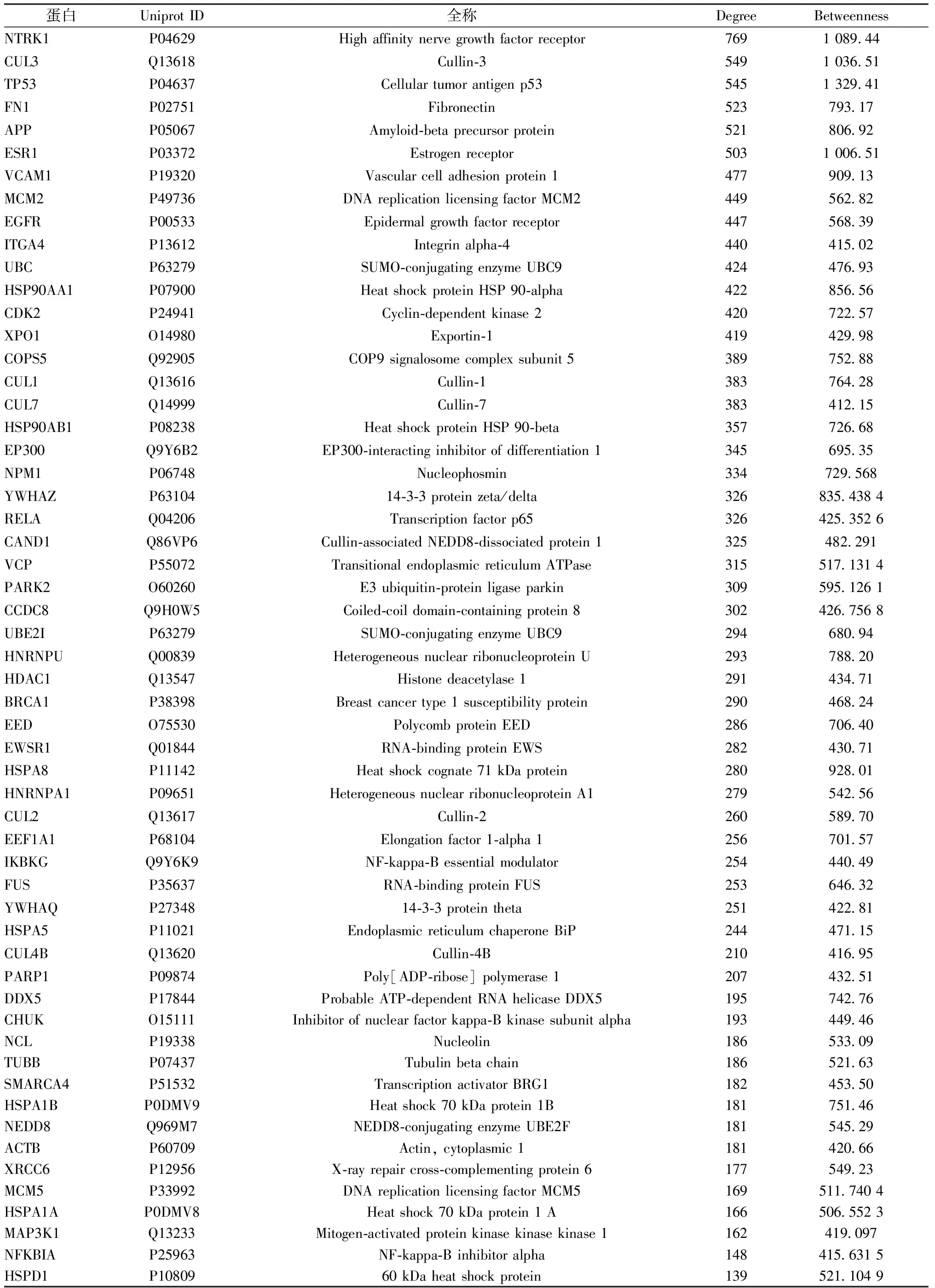
表2 PPI蛋白互作网络关键靶点

图4 核心靶点筛选策略示意图
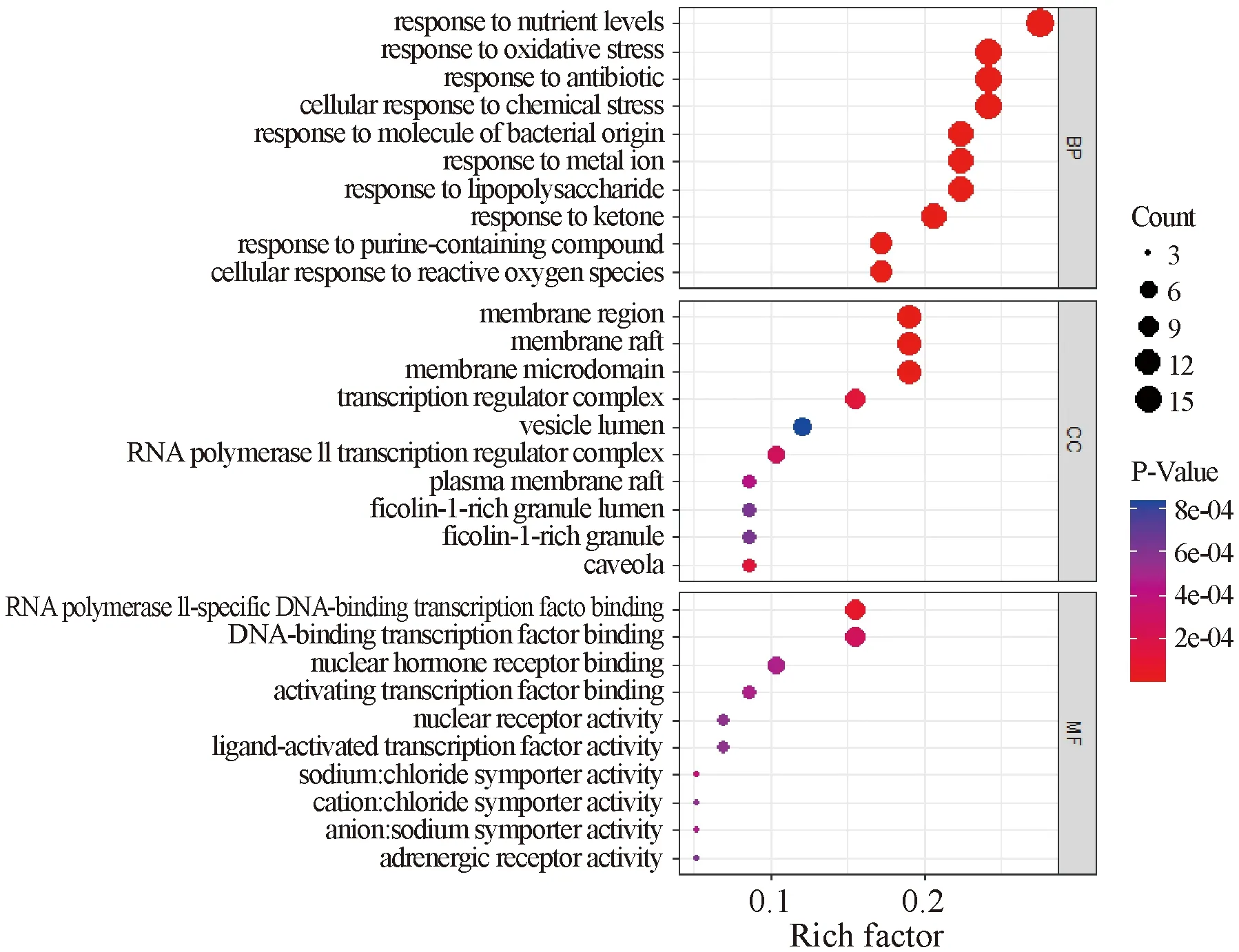
图5 GO富集分析

图6 KEGG富集分析
2.6 KEGG网络 网络见图7,蓝色代表通路,红色代表靶点,可知北沙参作用于金属基质蛋白MMP-9、血管细胞黏附分子VCAM1、B型单胺氧化酶MAOB、丝裂原活化蛋白MAPK、血清高迁移率族蛋白IL1B、紧密连接蛋白CLDN4等多个靶点,通过NF-kappa B信号通路、HIF-1信号通路、Ras信号通路、MAPK信号通路、FoxO信号通路、PI3K-Akt信号通路、P53信号通路等进行协同调控来干预糖尿病。另外,节点面积越大,干预影响越大。
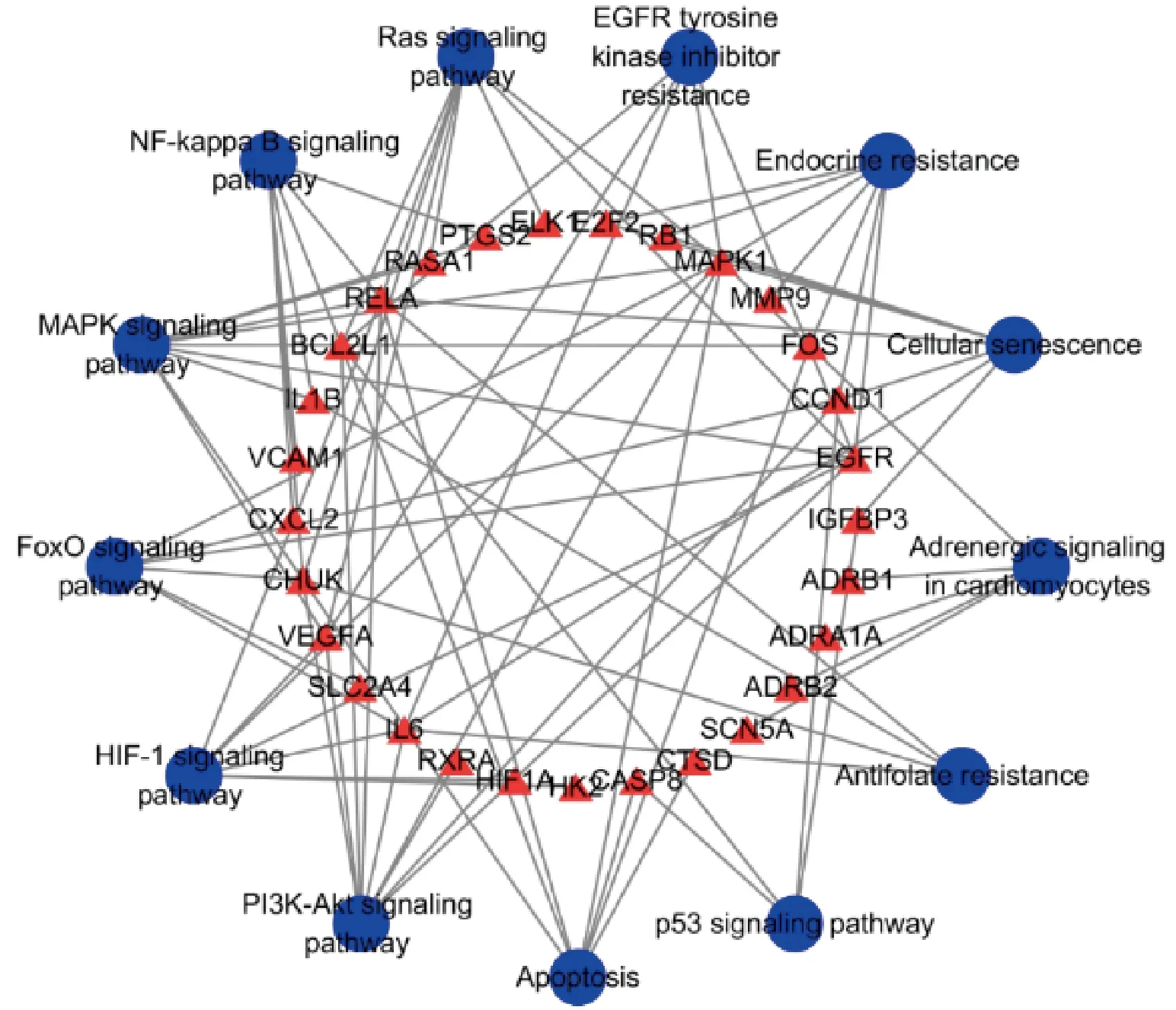
图7 药物-成分-靶点-通路-疾病网络
2.7 活性成分与糖尿病关键靶点的分子对接 在KEGG信号通路中选取4个关键靶点作为靶点蛋白,分别是MAPK1、IL1B、NCOA2和PTGS1,代号(PDB ID)分别为4DEP、4IZ5、4p6x和1cqe,与主要活性成分进行分子对接,见图8,与靶点蛋白的氢键结合力见表3。
槲皮素通过残基ASP-337、THR-181、ALA-26和TYR-62与MAPK1蛋白质分子对接,VAL-233与IL1B蛋白质分子对接,ARG-558、GLY-547、GLU-748与NCOA2蛋白质分子对接,GLY-66、CYS-57和CYS-59与PTGS1蛋白质分子对接。豆甾醇与MAPK1之间无氢键,没有分子对接,通过残基NAG-403与IL1B蛋白质分子对接,VAL-538与NCOA2蛋白质分子对接,LYS-253、GLU-268与PTGS1蛋白质分子对接。β-谷甾醇与MAPK1之间无氢键,没有分子对接,通过残基ASN-229与IL1B蛋白质分子对接,ARG-558与NCOA2蛋白质分子对接,LEU-494与PTGS1蛋白质分子对接。前胡内酯通过残基NAG-403和SER-213与IL1B蛋白质分子对接,LYS-151、ADP-900、GLU-33与MAPK1蛋白质分子对接,ARG-614、GLU-537与NCOA2蛋白质分子对接,GLY-214与PTGS1蛋白质分子对接。别异欧前胡内酯通过残基TYR-310、AGR-308、ALA-325与IL1B蛋白质分子对接,ASP-30、GLU-12与MAPK1蛋白质分子对接,LYS-743、GLU-748与NCOA2蛋白质分子对接,ASP-497、ILE-498、GLN-479与PTGS1蛋白质分子对接。佛手素通过残基NAG-403与IL1B蛋白质分子对接,THR-190与MAPK1蛋白质分子对接,ASP-549、ARG-558与NCOA2蛋白质分子对接,HIS-442、ARG-179与PTGS1蛋白质分子对接。异欧前胡素通过残基ILE225与IL1B蛋白质分子对接,ARG-67、TYR-187、JYR-30与MAPK1蛋白质分子对接,GLY-547和ARG-558与NCOA2蛋白质分子对接,GLU-347与PTGS1蛋白质分子对接。异珊瑚菜素通过残基GLU-217、VAL-233与IL1B蛋白质分子对接,LYS-117与MAPK1蛋白质分子对接,GLY-547、ARG-558、ASP-549与NCOA2蛋白质分子对接,PRO-514、SER-516、HIS-90与PTGS1蛋白质分子对接。

图8 活性成分与靶点分子对接模型

表3 活性成分与靶点蛋白的氢键结合力
3 讨论
本研究发现,北沙参8种活性成分有5 817个疾病靶点,其中58个与糖尿病的治疗相关;可与3 320个疾病靶点产生直接或间接作用,不同靶点之间的相互联系达82 802种,体现了其多成分、多靶点干预糖尿病的特点。
北沙参发挥治疗糖尿病作用的成分可能为香豆素类、酚酸类和甾醇类。研究表明,香豆素类对小鼠2型糖尿病具有一定干预作用,对2型糖尿病相关的生化指标和组织病理具有一定的改善作用,其机制可能通过激活Akt或AMPK磷酸化下游底物,促进GLUT4转位和葡萄糖转运[21];酚酸类虽然不能直接降低血糖,但能够显著改善大鼠血管黏稠度,改善血脂代谢,从而降低糖尿病肾病的发病概率[22];甾醇类化合物可通过减弱自由基诱导的糖毒素来改善高血糖状态,从而改善胰岛素功能[23]。
PPI蛋白互作筛选出56个关键靶点,度值最高的是MAPK、IL1B、PTGS1、NCOA2。MAPK可通过激活外源胰岛素从而调节胰岛素水平来治疗妊娠期糖尿病[24];IL1B能刺激胰岛素分泌、增强胰岛素的活性和促进葡萄糖转运到胞浆,从而达到降低血糖的作用[25];NCOA2在脂肪代谢和糖代谢平衡方面有重要的作用,其多态性与2型糖尿病的发生相关[26];PTGS1与炎症相关,糖尿病患者机体处于低度炎症状态,其程度与血糖高低呈正相关[27-28],四者能与北沙参活性成分进行分子对接,是其治疗糖尿病的核心靶点。
KEGG富集表明,上述靶点主要集中在NF-kappa B信号通路、HIF-1信号通路、Ras信号通路、MAPK信号通路、FoxO信号通路、PI3K-Akt信号通路、P53信号通路等168条信号通路。在糖尿病的治疗过程中,MAPK信号通路是与炎症相关的信号通路;HIF-1是缺氧诱导因子,也是参与细胞应答缺氧基因的关键因子[29],通过调节葡萄糖转运、控制糖酵解、促进糖异生从而影响葡萄糖稳态[30];脂肪酸、炎性因子和活性氧及相关靶蛋白可激活P53继而导致胰岛β细胞功能紊乱甚至凋亡[31],还可通过调节胰岛素信号通路等多条途径来干预胰岛素抵抗[32]。由此可见,北沙参中的多种成分通过作用于多个靶点、调控多个信号通路来改善糖尿病及其并发症。
综上所述,本研究利用网络药理学初步阐述了北沙参干预糖尿病的潜在活性成分、作用靶点、发挥药效的关键生物学通路,从分子水平揭示了可能机制。但上述结果只是预测,还需要通过药理实验作进一步验证。
