半夏泻心汤含药血清对胃癌细胞来源外泌体诱导BMSCs增殖、迁移、侵袭的影响
2022-01-27董俊刚刘喜平李沛清王庆苗朱中博崔国宁
董俊刚, 刘喜平*, 李沛清, 王庆苗, 朱中博, 崔国宁
(1.甘肃中医药大学基础医学院,甘肃 兰州 730000;2.甘肃中医药大学中医临床医学院,甘肃 兰州 730000)
胃癌目前居肿瘤性死亡病因的第2位[1],其发生发展与骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)有关[2]。在胃癌前病变期BMSCs可归巢至胃黏膜部,参与胃黏膜修复,与胃上皮细胞融合转化为胃癌细胞[3];胃癌发生后,BMSCs可归巢至肿瘤部位,成为肿瘤微环境的重要细胞成分[4],能促进肿瘤的生长进展[5]。课题组前期研究表明,BMSCs在胃癌微环境中可发生恶性转化,从而具有体内致瘤特性[5-6]。
外泌体(exosome,Exo)是微环境细胞间生物信息物质传递的生物活性囊泡,它富集、包裹了在细胞外液中易失活或降解的成分,可靶向受体细胞并被摄取,激活胞内相关信号通路,调控受体细胞生物学特性。研究显示,胃癌微环境中的胃癌细胞能通过分泌的外泌体诱导BMSCs促进肿瘤生长转移[7]。音猬因子(sonic hedgehog,Shh)信号通路是调控BMSCs增殖分化的关键信号通路[8],但胃癌来源外泌体能否靶向BMSCs,调控BMSCs胞内Shh信号通路,诱导BMSCs生物学特性的恶性转化,以及上述过程能否被干预目前并不清楚。
胃癌属中医“伏梁”“反胃”“积聚”等范畴,其病机与寒热错杂、正虚痰结有关[9]。半夏泻心汤源自《伤寒论》,功效平调寒热、健脾散结,是治疗胃癌的有效方剂[10]。课题组前期研究表明,半夏泻心汤对荷胃癌裸鼠有明显的抑瘤作用[11],也可抑制人胃癌BGC-823细胞生长增殖[12-13],同时对胃癌微环境中BMSCs的恶变促瘤有明显的抑制作用[14]。本研究在观察半夏泻心汤干预BMSCs摄取胃癌来源外泌体的基础上,探讨该方通过调控Shh信号通路对胃癌来源外泌体诱导BMSCs增殖、侵袭、迁移等生物学特性的影响,从肿瘤外泌体途径阐释BMSCs的恶变促瘤机制,为胃癌临床治疗及相关药物新作用靶点开发提供依据。
1 材料
1.1 细胞与动物 人胃癌NCI-N87细胞,购自中国科学院上海生命科学研究院细胞资源中心;大鼠BMSCs(细胞密度2×105/mL),由重庆威斯腾生物科技公司分离提供。8周龄SPF级雄性SD大鼠40只,体质量180~220 g,由甘肃中医药大学动物实验中心提供,动物生产许可证号SCXK(甘)2020-0001,动物使用许可证号SYXK(甘)2020-0009,饲养于温度23~25 ℃、相对湿度(50 ±10)%的SPF级实验室。研究经甘肃中医药大学实验动物伦理委员会批准(伦理审查号2018-009)。
1.2 试剂与药物 半夏泻心汤组方药材饮片(半夏、干姜、黄芩、黄连、人参、大枣、甘草)均购自甘肃中医药大学附属医院中药房,经甘肃中医药大学药学院景明教授鉴定符合2020年版《中国药典》规定。胎牛血清、无外泌体血清、DMEM培养基(美国Gibco公司,货号分别为HLC0101、10828-028、11995-065);微量BCA蛋白定量试剂盒(上海易色医疗科技有限公司,货号BC201);Exo-Quick-TC(美国SBI公司,货号EXOTC50A-1);MTT试剂盒、兔来源一抗CD63、兔来源一抗CD9、二抗羊抗兔IgG、二抗羊抗鼠IgG、β-actin(英国Abcam公司,货号分别为20140165、ab92726、ab92643、ab6728、ab150077、ab8226);Matrigel基质胶(美国Corning公司,货号356234);兔一抗Gli1(美国Thermo Fisher公司,货号MA5-32553);兔一抗Ptch1(药明康德,货号AP51457);兔一抗c-Myc(美国CST公司,货号9402);小鼠一抗Shh(美国Santa Cruz公司,货号sc-373779);兔一抗Smo(成都正能生物技术有限公司,货号503274);结晶紫、1,1′-双十八烷基-3,3,3′,3′-四甲基吲哚羰花青高氯酸盐(1,1′-dioctadecyl-3,3,3′,3′-tetramethylindocarbocyanine perchlorate,Dil)(美国Sigma公司,货号分别为C6158、41085-99-8);DAPI染色液(上海碧云天生物技术有限公司,货号C1005);Shh阻断剂GANT61(美国MCE公司,货号HY-13901)。
1.3 仪器 透射电子显微镜7500(日本Hitachi公司);电泳仪(美国Bio-Rad公司);多功能酶标仪(美国Thermo Fisher公司);倒置相差显微镜(日本Olympus公司)、激光共聚焦显微镜(日本Nikon公司);8 μm Transwell小室(美国Corning公司);细胞计数板(上海医用仪器厂)。
2 方法
2.1 含药血清制备及大鼠分组、给药 按原方剂量(半夏12 g,干姜9 g,黄芩9 g,黄连3 g,人参9 g,大枣4枚,甘草9 g)称取组方药材饮片[15],混合后浸泡30 min,煎煮2次,第1次加8倍量水煎煮1.5 h,第2次加6倍量水煎煮1 h,合并煎液,离心过滤,滤液分别减压浓缩至生药量2.7、1.35、0.675 g/mL。按照人与动物体表面积折算的等效剂量(中剂量为临床等剂量,低、高剂量组分别是中剂量的0.5、2倍),半夏泻心汤低、中、高剂量组剂量分别为54、27、13.5 g/kg。
参考文献[16]报道的方法,32只大鼠常规适应性饲养1周后,随机数字表法分为空白组及半夏泻心汤低、中、高剂量组,每组8只,实验前禁食不禁水12~24 h,半夏泻心汤低、中、高剂量组大鼠每次分别灌胃给予2.7、1.35、0.675 g/mL的半夏泻心汤,每天2次,每次2 mL,空白组灌胃给予等体积生理盐水灌胃,连续2周。末次给药后1 h麻醉大鼠,腹腔解剖,腹主动脉采集全血,静置分层后3 000 r/min离心10 min,收集血清,56 ℃水浴灭活30 min,0.22 μm微孔滤膜过滤除菌,分装,置于-20 ℃冰箱中保存备用。
2.2 NCI-N87外泌体分离和纯化 收集正常培养的NCI-N87细胞,PBS洗2~3次,更换为无外泌体血清培养基,继续培养48 h后收集上清,4 ℃、3 000 r/min离心15 min,0.22 μm滤膜过滤去除较大的囊泡,将外泌体上清与Exo Quick-TC试剂以5∶1的比例混合,反复颠倒3次,4 ℃孵育过夜,10 000 r/min离心30 min,弃去上清液,沉淀用0.5 mL PBS重悬,获得提取物悬液,按微量BCA蛋白定量试剂盒说明书对提纯后的NCI-N87-Exo进行定量,置于-80 ℃冰箱中保存。
2.3 NCI-N87外泌体鉴定 取分离纯化NCI-N87-Exo溶液20 μL,均匀后滴加于直径2 mm的载样铜网上,在干燥环境中让Formvar膜吸收20 min,将100 μL PBS加到封口膜上,用镊子将铜网放在PBS液滴上清洗。50 μL 2.5%戊二醛滴于铜网上,室温下复染5 min,反差增强及包埋样本后,置于透射电镜下(80 kV)观察拍摄并保存。将NCI-N87外泌体用细胞裂解液处理后,4 ℃离心5 min,取上清液,BCA法检测浓度,Western blot法检测外泌体标志蛋白CD9、CD63及钙网蛋白(calreticulin)表达,加入6×蛋白样品上样缓冲液,100 ℃加热10 min变性。以20 μg总蛋白量进行点样、电泳、转膜、洗涤封闭,结合一抗 (CD9、CD63、calreticulin,稀释倍数均为1∶1 000)4 ℃过夜,洗涤,室温结合二抗 (山羊抗兔IgG按1∶1 000稀释) 孵育2 h,洗涤,ECL化学发光液显影法检测蛋白条带,Image J软件分析灰度值。
2.4 细胞分组及共培养体系建立 将分离纯化后质量浓度为100 μg/mL的NCI-N87外泌体与荧光活性染料Dil按1 000∶1的比例混合,避光放置30 min,4 ℃、100 000 r/min离心90 min,PBS重悬后再次超速离心,弃上清,获得Dil标记的NCI-N87外泌体。实验分为空白组,模型组,半夏泻心汤低、中、高剂量组及Shh阻断剂组,各组上室加入2×105/mL BMSCs悬液1.5 mL(DMEM培养基+100 μg/mL链霉素+100 U/mL青霉素),下室均加入无外泌体血清的培养基(DMEM培养液中+10%无外泌体血清+100 μg/mL链霉素+100 U/mL青霉素)。除空白组外,其他各组下室加入含1 mL质量浓度为100 μg/mL的NCI-N87外泌体,半夏泻心汤高、中、低剂量组上室内各加入10%的半夏泻心汤含药血清,模型组及空白组上室加入10%的空白血清,Shh阻断剂组上室加入含20 μmol/L GANT61的10%空白血清。48 h后终止培养,收集细胞,倒置相差显微镜下观察各组BMSCs的形态变化,并进行其他相关检查。
2.5 激光共聚焦显微镜观察BMSCs对NCI-N87外泌体的摄取 收集各组BMSCs,置于37 ℃、5% CO2培养箱中培养48 h后,吸取培养液,4%多聚甲醛固定,PBS清洗细胞,常温细胞爬片15 min,PBS洗涤3次,每次10 min,滴加含有4′,6-二氨基-2-苯基吲哚(4′,6-diamino-2-pheny-lindole,DAPI)的染液,避光孵育15 min,对细胞核进行复染,PBS洗4次,每次5 min,用含抗荧光淬灭剂封片后在激光共聚焦显微镜下观察各组BMSCs内红色荧光表达,并用Image J pro plus 6.0软件分析各组BMSCs红色荧光标记的MOD。
2.6 MTT法检测BMSCs增殖率 将MTT溶于PBS,配成质量浓度为5 mg/mL的溶液。收集各组BMSCs,0.25%胰蛋白酶消化并吹打成单细胞悬液,细胞培养液调整其密度为1×105/mL,取100 μL接种于96孔板中,每组细胞设3个复孔,置于37 ℃、5% CO2细胞培养箱中分别培养1、2、3、4、5、6、7 d后,每孔加入20 μL MTT溶液,37 ℃、5% CO2细胞培养箱中继续培养4 h后,弃去多余MTT和培养液,每孔加入150 μL二甲基亚砜(DMSO),振荡器振荡10 min,酶联免疫检测仪于570 nm波长处测定吸光度A,计算细胞增殖率,公式为细胞增殖率=[(A实验组-A空白孔)/(A空白组-A空白孔)]×100%。
2.7 Transwell检测BMSCs侵袭及迁移 4 ℃下将Matrigel基质胶与预冷的无血清培养基按1∶8比例稀释,取50 μL均匀铺于Transwell小室上室,在37 ℃培养箱中过夜凝固,每组设3个平行孔,上室加入无血清培养基重悬的密度为2×105/mL的BMSCs细胞悬液150 μL,下室24孔板加入600 μL无外泌体血清培养基,在5% CO2、37 ℃培养箱中孵育24 h后取出Transwell小室,吸弃培养基,棉签擦去上室残留细胞,4%多聚甲醛固定15 min,0.1%结晶紫染色30 min,在100倍视野下观察拍照,显微镜下随机5个视野,计数并评价细胞侵袭能力。迁移实验在Transwell小室腔膜上不铺Matrigel基质胶,其余步骤同侵袭实验。
2.8 Western blot检测BMSCs中Shh、Ptch1、Smo、Gli1、c-Myc蛋白表达 收集各组BMSCs,提取总蛋白,BCA法检测蛋白浓度,100 ℃变性10 min,得到蛋白样品,80 V电泳跑过浓缩胶后电压转为120 V,将电流调整至恒流200 mA后转移2 h,5%脱脂奶粉封闭液室温封闭2 h,封闭液将一抗(Shh、Ptch1、Smo、c-Myc、Gli1)按1∶500稀释,内参一抗β-actin按1∶1 000稀释,4 ℃孵育过夜,用封闭液将二抗按1∶1 000稀释,室温孵育1.5 h,TBST洗4次。将ECL曝光液覆盖在整片膜上反应2 min,采用凝胶图像处理系统软件测灰度值,计算蛋白相对表达。
3 结果
3.1 NCI-N87外泌体鉴定 由图1可见,NCI-N87外泌体有完整的双层包膜,形成呈椭圆或碟状的囊泡结构,内含低密度物质,粒径介于40~80 nm之间(黄色箭头)。外泌体特征性相关蛋白表达分别为CD9的86.47±3.25、CD63的93.82±5.95,高于胃癌细胞的49.15±6.53、77.00±2.56(P<0.05);钙网蛋白(calreticulin)未见明显表达,但在NCI-N87细胞中有明显表达,提示获得了NCI-N87外泌体,符合后续实验要求。
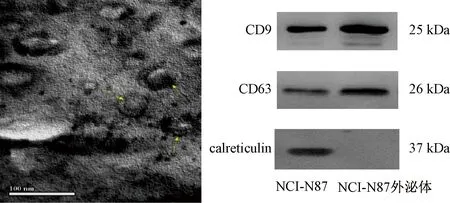
图1 NCI-N87外泌体的鉴定Fig.1 Identification of exosomes in NCI-N87 cells
3.2 BMSCs对NCI-N87外泌体的摄取 由图2可见,与空白组比较,模型组BMSCs内可见大量红色荧光标记,MOD值(25.16±2.38)升高(P<0.05);与模型组比较,半夏泻心汤低、中、高剂量组BMSCs内红色荧光标记减弱,MOD值分别为16.34±3.29、18.97±2.13、24.89±1.25,以高剂量组更明显(P<0.05);Shh阻断剂组BMSCs内红色荧光标记减弱,MOD值(9.22±0.76)降低(P<0.05)。

图2 各组BMSCs对NCI-N87外泌体的摄取(DAPI染色,×400)Fig.2 Uptakes of NCI-N87 cells exosomes by BMSCs in various groups(DAPI staining,×400)
3.3 BMSCs形态变化 由图3可见,空白组BMSCs呈短平长梭形,有序均匀排列,似成纤维细胞样生长,有明显的折光性;模型组BMSCs呈集落样团状生长,细胞排列紊乱,细胞间连接疏松,与人胃癌NCI-N87细胞形态有相似之处;经半夏泻心汤低、中、高剂量含药血清干预后大部分细胞呈梭形,偶见团状生长,但凋亡细胞增多。
3.4 BMSCs增殖率 由表1可见,从第3天开始,模型组相同时间点BMSCs增殖率高于空白组(P<0.05);与模型组比较,半夏泻心汤低、中、高剂量组BMSCs的增殖率均降低(P<0.05),以高剂量组在4、5、6、7 d更明显(P<0.05)。

图3 各组BMSCs形态变化(×100)Fig.3 Morphological changes of BMSCs in various groups (×100)

表1 各组BMSCs增殖率
3.5 BMSCs侵袭及迁移 由图4~5、表2可见,模型组BMSCs穿过Transwell小室滤过膜的细胞数量高于空白组(P<0.05);与模型组比较,半夏泻心汤低、中、高剂量组BMSCs穿过Transwell小室滤过膜的细胞数量减少(P<0.05),以高剂量组更明显(P<0.05)。

图4 各组BMSCs迁移能力(×100)Fig.4 Migration ability of BMSCs in various groups (×100)

图5 各组BMSCs侵袭能力(×100)Fig.5 Invasion ability of BMSCs in various groups (×100)
3.6 BMSCs中Shh、Ptch1、Smo、Gli1、c-Myc的蛋白表达 由表3、图6可见,与空白组比较,模型组BMSCs中Shh、Ptch1、Smo、Gli1、c-Myc蛋白表达升高(P<0.05);与模型组比较,半夏泻心汤低、中、高剂量组BMSCs中Shh、Ptch1、Smo、Gli1、c-Myc蛋白表达降低(P<0.05),以高剂量组更明显(P<0.05)。

表2 各组BMSCs穿膜细胞数
4 讨论
BMSCs被认为是胃癌细胞的起源之一[17],在前期阶段能够靶向迁移至胃黏膜的受损位置,参与损伤修复,而在后期阶段其失控性增殖产生癌肿[18]。临床胃癌组织及裸鼠体内致瘤组织分离得到胃癌细胞时,其生物学特性与BMSCs相似[19]。进一步研究显示,处于胃癌微环境中的BMSCs,其基因表达、分化能力、扩增潜能和免疫表型等生物学特性已发生改变来适应肿瘤微环境[20]。

表3 各组BMSCs中Shh、Ptch1、Smo、Gli1、c-Myc蛋白表达
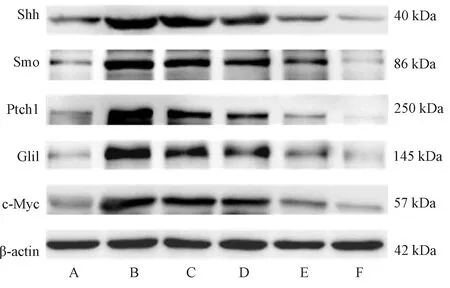
注:A为空白组,B为模型组,C为半夏泻心汤低剂量组,D为半夏泻心汤中剂量组,E为半夏泻心汤高剂量组,F为Shh阻断剂组。图6 各组BMSCs中Shh、Ptch1、Smo、Gli1、c-Myc蛋白表达Fig.6 Protein expressions of Shh, Ptch1, Smo, Gli1 and c-Myc of BMSCs in various groups
肿瘤微环境是由肿瘤细胞、基质细胞(间充质干细胞、成纤维细胞等)、细胞外基质及生长因子、细胞因子、其他小分子等共同构成的一个复杂的动态环境系统[21]。研究表明,肿瘤微环境中非肿瘤细胞在调控肿瘤发生发展及侵袭转移中起关键作用[22],BMSCs是构成肿瘤微环境重要的非肿瘤细胞成分之一[23]。肿瘤外泌体参与肿瘤微环境的调控,其富集、包裹了多种生物信息物质,被肿瘤微环境中的非肿瘤细胞摄取后能够激活胞内信号通路对受体细胞进行多途径、多位点的精细调节,在促进非肿瘤细胞增殖恶化方面具有重要作用[24]。
c-Myc是Shh信号通路核转录因子蛋白Gli的下游8号染色体癌基因[25],为癌症相关细胞过度增殖更明显的标志之一[26],在激活端粒酶活性、促进BMSCs恶性转化方面发挥着重要作用[27]。Shh通路由分泌型信号糖蛋白Sonic hedgehog配体(Shh)、12次跨膜受体蛋白Patched1(Ptch1)、G蛋白偶联受体样蛋白Smoothened(Smo)及下游核转录因子蛋白Gli(Gli1、Gli2、Gli3,主要为Gli1)组成,Shh与Ptch1结合使Ptch1与Smo脱离,Smo活化后激活Gli,Gli进入细胞核调控靶基因的转录[28]。通过激活Shh信号通路下游的关键分子Gli1,可促进BMSCs生长增殖与分化[29]。
本研究结果表明,NCI-N87外泌体能够被正常BMSCs摄取,BMSCs细胞形态发生变化,增殖、迁移能力明显增强,有恶性转化的趋势。半夏泻心汤含药血清能够抑制BMSCs对NCI-N87外泌体的摄取,经半夏泻心汤干预后,BMSCs呈梭型生长,凋亡增多,增殖及侵袭能力均降低,同时发现BMSCs细胞内Shh信号通路相关蛋白Shh、Ptch1、Smo、Gli1及c-Myc表达下降,表明半夏泻心汤含药血清阻抑胃癌细胞来源外泌体诱发的BMSCs恶性转化,其机制与抑制Shh信号通路与下游信号分子c-Myc蛋白的表达有关。
