复垦土壤细菌群落结构及其与土壤肥力的关系
2022-01-27张世文宋桂芳祝亚飞鲁胜军夏沙沙
刘 俊,张世文,2※,宋桂芳,王 阳,祝亚飞,鲁胜军,兰 淼,夏沙沙
复垦土壤细菌群落结构及其与土壤肥力的关系
刘 俊1,张世文1,2※,宋桂芳1,王 阳1,祝亚飞1,鲁胜军1,兰 淼1,夏沙沙1
(1. 安徽理工大学地球与环境学院,淮南 232001;2. 安徽省高潜水位矿区水土资源综合利用与生态保护工程实验室,淮南 232001)
为了解两淮煤矿区复垦状况及其对土壤微生物的影响机制,合理人工干预,快速有效提高复垦土壤生产力,本研究以煤矸石充填复垦土壤为研究对象,通过野外调查与采样分析,采用Illumina MiSeq 高通量测序分析土壤细菌特定基因片段V4 区域,基于非度量多维尺度分析、冗余分析、方差分析、肥力指数、回归模型方法,对矸石充填土壤不同复垦方向的土壤细菌优势群落和生物多样性进行了探索,明晰土壤细菌群落及其与土壤肥力的响应作用。研究结果表明:细菌群落组成上,不同复垦方向对细菌优势群落分布并无显著性影响,变形菌门、酸杆菌门和放线菌门菌群为主要优势菌群。土壤微生物多样性层面上,表层土壤微生物有较高的丰富度和多样性,均匀度并无显著性差异。微生物多样性在不同复垦方向不存在显著性差异,Shannon_Wiener指数介于6.19~6.85之间,Chao1指数为3131.97~4938.37,Pielou指数介于0.79~0.84之间,表中层同深层土壤的细菌群落结构具有差异性。TN、SOM、AP和AK是影响土壤细菌群落的主要肥力因子,土壤肥力质量指数与奇古菌门相对丰度呈显著正相关(<0.01),同链霉菌属呈显著负相关(<0.05),在一定程度上可将二者的相对丰度作为评价复垦土壤肥力状况的重要生物指标。研究成果可为两淮矿区矸石充填复垦土壤在微生物层面提高肥力质量提供理论支持。
复垦;细菌;高通量测序;群落结构;土壤肥力
0 引 言
两淮矿区作为中东部重要的能源基地,矿产资源开采导致了一系列的矿区土地生态环境问题,对此需要采取人工和生态措施等合理有效措施对矿区采煤塌陷破坏耕地进行修复,优化矿区生态环境。煤矸石充填复垦不仅能恢复采煤沉陷区的土地资源,而且能处理消化煤矸石,经济环境效益显著[1]。然而由于充填导致的复垦土壤与原始土壤的理化性质差别较大,使得土壤微生物的生长环境发生巨大的变化,导致土壤肥力发生明显变化。土壤微生物作为土壤环境中最重要的组成部分,容易受环境影响[2],当土壤环境发生变化时,土壤微生物能迅速做出反应,其群落结构发生变化,对土壤肥力变化具有重要指示作用。土壤细菌参与土壤养分的转化[3],在土壤微生物中占绝对优势,对矿区生态复垦起到重要的作 用[4]。因此,土壤微生物可以用来衡量复垦土壤肥力质量,监测矿区土壤环境变化[5-6]。
目前,高通量测序技术因其能够充分揭示微生物群落优势菌群的分布情况,同时还能发现土壤微生物的群落结构特征及多样性变化[7],而在土壤微生物的研究领域中应用广泛。王继玥等[8]利用宏基因组学测序技术,测定了不同Pb浓度梯度下三叶草根际土壤中的细菌群落结构,发现1菌群是具有Pb污染抗性的优势菌群。侯湖平等[9]采用 Illumina PE250 测序方法测定微生物群落组分,对比分析发现复垦土壤在各个分类水平的细菌种类数量减少,群落多样性降低。王瑾等[10]利用454高通量测序技术,发现土壤细菌群落对不同复垦区域的采煤沉陷复垦土壤响应大同小异。Li等[11]研究了黄土高原西北部露天煤矿复垦土壤微生物相对丰度和多样性,揭示了细菌等微生物群落演替对于不同复垦方案的响应敏感程度存在显著差异。由此可见,土壤细菌群落在衡量土壤质量方面发挥着重要作用。
综上,当前研究主要集中于土壤细菌及其群落结构等方面,土壤肥力指数作为各项土壤理化性质的综合反映,与土壤微生物的响应关系研究较少。因此,本文以两淮矿区采煤沉陷复垦土壤为研究对象,结合Illumina Nova 6000 平台对构建的扩增子文库进行PE250测序,分析土壤细菌特定基因片段V4区域,研究矸石充填复垦土壤在不同复垦方向的细菌群落结构及生物多样性,并基于土壤肥力评价结果,探讨土壤细菌群落同土壤肥力指数之间的关系,旨在探寻细菌群落对土壤肥力的响应作用。研究成果可为两淮矿区在微生物层面提高复垦土壤生产力提供理论依据。
1 材料与方法
1.1 研究区概况
研究区域位于安徽省两淮采煤塌陷区,属暖温带半湿润季风气候,是中国重要的煤炭生产基地之一。煤炭开采带来的地面沉降、地表裂缝及熔岩塌陷等现象,对土壤造成了严重损伤。基于两淮矿区实际情况,采取了煤矸石充填复垦模式,以此缓解塌陷带来的各种影响。复垦工艺为:首先用推土机将原地表土推至工作面,然后填充矸石,用振动碾压机进行振动碾压,再用推土机将堆放的地表土覆盖矸石[12]。煤矸石充填至标高 +13.40 m,再覆土60 cm左右,农田平均标高为+14.00 m,复垦年限为15a、复垦面积 23 hm2,土壤pH整体呈弱碱性。覆土层土壤质地为砂质黏壤土,煤矸石质地为砂壤土,颗粒间差异较大,化学成分以SiO2为主,土壤孔隙较小。在分层回填过程中,为保证回填土地的保水性能,将粒径大的矸石回填到塌陷区的底部,然后依次回填小粒径矸石,在将矸石倒入塌陷坑的同时,人工将黄土铲入矸石中混合。复垦区主要分为三种复垦方向:一是复垦为草地,主要种植大滨菊草本植物;二是复垦为耕地,常年采取小麦-玉米轮作模式;三是复垦为林地,主要种植池杉等杉科、落羽杉属植物。本研究在复垦区 内主要选取草地、耕地和林地3种不同复垦方向土壤 进行分析,分别记为C、G和L,具体情况和布置见 图1。
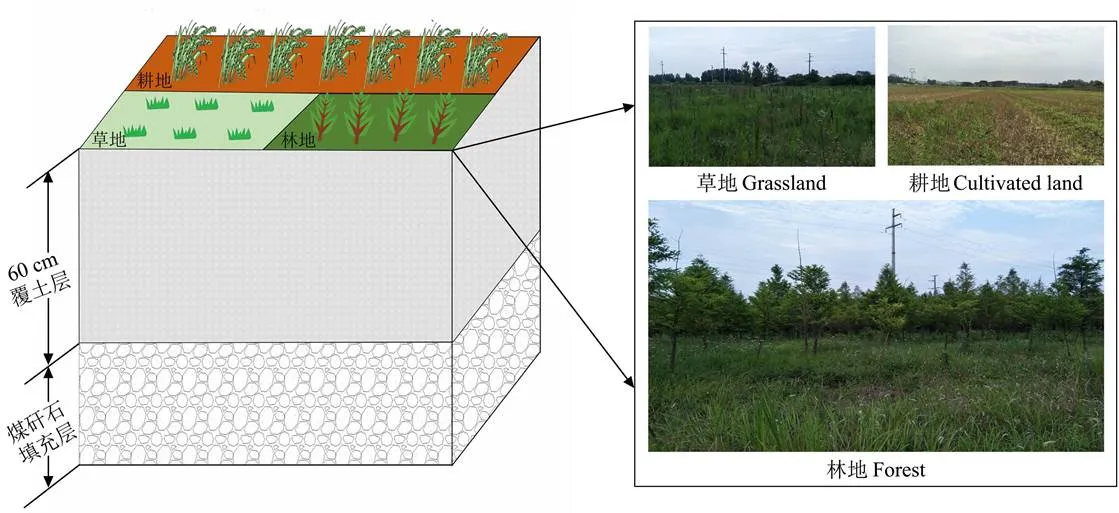
图1 研究区试验布置与样点图
1.2 样品采集
土样采集时间为 2019 年6月,采取五点采样法,进行3次重复采样,按照S型选取5个采样点。用土钻按照表层(0~20 cm)、中层(20~40 cm)、深层(40~60 cm)进行土壤分层取样(分别标为1、2、3),取5点混合由此形成1个样品。去除石头、植物残留物、动物和其他杂物后将其分为两份,一部分土壤样品在-80℃的环境中冷冻保存,用于高通量测序;另一部分则置于阴凉、通风且无阳光直射的房间内,将样品倒在铺垫有牛皮纸的风干盘中,摊成2~3 cm的薄层,并将样品标签粘贴在牛皮纸上。当土壤样品半干时,用磨土棍将大土块碾碎,以免完全风干后结成硬块,难以磨细。样品风干后,按四分法弃去多余部分,保留300 g左右。依据肥力指标测定需求,分别过2、0.85、0.15 mm筛子,将过完筛子的土样分别装袋保存,贴标签、编号并尽快进行测定。
1.3 土壤肥力指标测定
参照《土壤农化分析》[13],土壤有机质(Soil Organic Matter,SOM)含量采用重铬酸钾容量法-外加热法测定;对于全氮(Tonal Nitrogen,TN)含量,将土壤经过浓硫酸-高氯酸消解后,采用凯氏定氮法测定;对于速效磷(Available Phosphorus,AP)含量,采用0.5 mol/L NaHCO3浸提-钼锑抗比色法测定;对于速效钾(Available Kalium,AK)含量,采用1 mol/L NH4OAc浸提-火焰光度法测定;土壤pH值用BPH-252pH计测得,土壤提取液采用 1:2.5土水比浸提。
1.4 土壤细菌16S rRNA 基因序列分析
1.4.1 DNA提取及PCR 扩增
采用E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒提取、纯化种子总DNA,利用Thermo NanoDrop One 检测DNA的纯度和浓度,试验从DNA提取到测序分析均设置3个重复[14]。PCR扩增及产物电泳检测以基因组DNA为模板,根据测序区域的选择,使用带barcod的特异引物及TaKaRa Premix Taq®Version 2.0(TaKaRa Biotechnology Co., Dalian, China)进行PCR 扩增。PCR反应体系为2x Premix Taq 25L、Primer-F(10 μM)1L、Primer-R(10 μM)1L、模板DNA50ng,总体积50L[15]。PCR产物检测合格后,采用引物序列为5’-GTGCCAGCMGCCGCGGTAA-3’和5’- GGACTACHVGGGTWTCTAAT-3’,扩增样品中原核生物V4 可变区构建高通量测序文库,使用Illumina Nova 6000平台对构建的扩增子文库进行PE250测序(16S rRNA测序委托广州美格基因科技有限公司完成)。
1.4.2 OTU聚类与物种注释
在序列相似性97%的参数水平上对每个质量阈下序列参数进行一个相似性参数聚类,以用于测序所有一个质量阈下序列的参数的均值并过滤OTU(Operational Taxonomic Units),同时去除嵌合体[16]。选取OTU的代表性序列,利用usearch-sintax对每个OTU的代表序列进行物种分类,设定置信度阈值为0.8,与SILVA(16S)数据库进行比对获得物种注释信息,获得分类学信息并分别在界、门、纲、目、科、属、种水平统计群落组成。
1.5 数据处理
所得数据采用Excel 2019进行记录。基于门、纲分类水平的物种注释和丰度信息,绘制物种丰度堆叠图。使用R vegan 软件包计算Alpha多样性指数,包括Shannon_Wiener指数、Chao1指数、Pielou指数及Coverage指数。Alpha多样性、土壤肥力指标差异采用单因素方差分析(ANOVA),在<0.05时观察到显著性,多重比较采用Dunnett’s-t检验。利用Beta多样性分析细菌群落组成的差异,采用R vegan 软件包做基于bray-curtis差异矩阵的非度量多维尺度分析(Non-metric Multidimensional scaling,NMDS)以比较和可视化土壤样本之间的相似性。基于冗余分析(RedunDancy Analysis, RDA)探讨细菌群落与土壤肥力因子之间的关系。利用皮尔森相关分析(Pearson correlation)和线性回归模型(Linear Regression Model,LRM)揭示土壤细菌群落同土壤肥力指数之间的响应作用。本文统计学检验使用SPSS 24.0软件,绘图使用软件Origin Pro2021、R×64 3.6.3。
2 结果与分析
2.1 不同复垦方向土壤细菌多样性分析
2.1.1 细菌群落组成
为明确矸石充填复垦土壤的细菌优势群落信息,对不同复垦方向的土壤细菌群落在门、纲分类水平获得的OTU 序列进行划分,相对丰度>0.01%的主要细菌种类有10种,相对丰度<0.01%的细菌种类合并为其他(others),结果如图2所示。门分类水平上,不同复垦方向土壤细菌相对丰度前5的优势群落为变形菌()(37.72%)、酸杆菌()(12.66%)、放线菌()(12.63%)、绿弯菌()(8.26%)、拟杆菌()(7.41%),共占细菌总数的78.68%。C2相比C1、G2,变形菌的相对丰度分别增加5.32%、3.67%(<0.05);L3较G3变形菌相对丰度增加8.06%(<0.05);与L2相比,L1酸杆菌相对丰度增加2.49%(<0.05);G2较G1放线菌相对丰度增加0.31%(<0.05);L3相比L1绿弯菌相对丰度增加61.10%(<0.05)。
纲分类水平上(图2 b)相对丰度前5的细菌优势群落自高向低依次为-变形杆菌()(29.30%)、-变形杆菌()(13.07%)、拟杆菌()(9.76%)、放线菌()(9.23%)、-变形杆菌()(8.51%)。G1较L1-变形杆菌的相对丰度增加27.90%(<0.05);与C3相比,C2拟杆菌的相对丰度增加71.77%(<0.05);C2较C1放线菌的相对丰度增加10.95%(<0.05)。
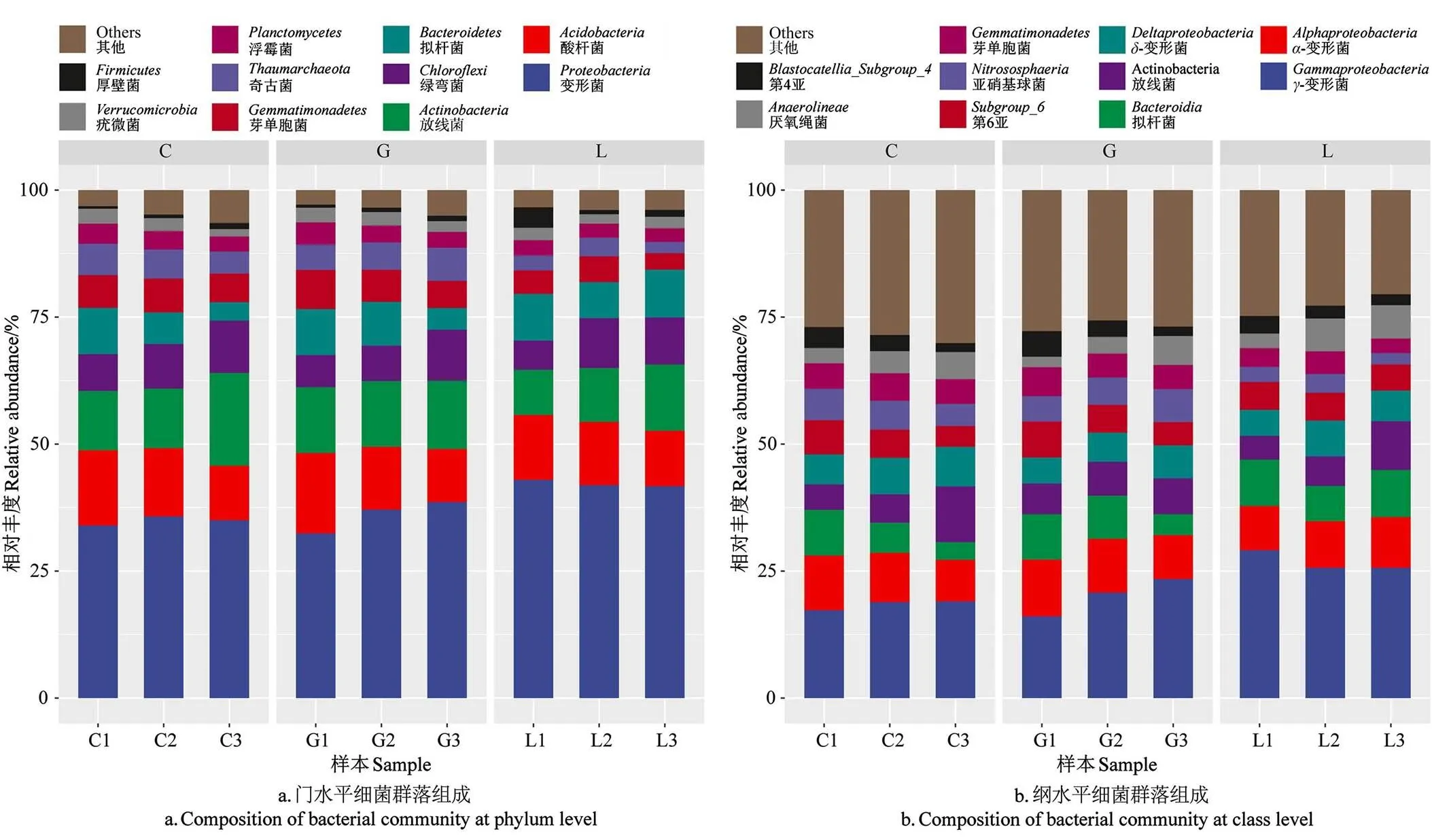
注:C1,草地0~20 cm;C2,草地20~40 cm;C3,草地40~60 cm;G1,耕地0~20 cm;G2,耕地20~40 cm;G3,耕地40~60 cm;L1,林地0~20 cm;L2,林地20~40 cm;L3,林地40~60 cm。下同。
2.1.2 细菌Alpha多样性
为明晰矸石充填复垦土壤细菌群落丰富度、均匀度的差异性,本文基于单因素方差分析,以Chao1指数、Shannon_Wiener指数、Pielou指数及Coverage指数衡量煤矸石充填土壤细菌Alpha多样性的变化(表1)。
结果显示,0~20 cm和20~40 cm土层,草地Chao1指数和Shannon_Wiener指数大于耕地和林地。随着土层深度的逐渐增加,细菌丰富度逐渐降低,这可能是由于深层土壤缺乏通透性,其土壤温度、氧气、活性碳库等状况变差[17]。在不同土层深度下,多样性指数波动并不大,耕地深层土壤与表中层存在显著性差异(<0.05)。表层土壤Pielou指数在不同复垦方向上存在差异性,耕地显著大于林地(<0.05),林草地表层土壤均匀度低于深层,这可能是因为植物根系分泌物中富含有机酸、维生素、氨基酸等多种物质,影响着土壤细菌群落组成,而不同植物的根系分泌物不同,从而有选择地影响着土壤细菌群落[18]。由反映测序深度的Coverage 指数知,本次测序各样本均在97%以上,样品检测到的样本覆盖率高,说明可以直接检验到土壤环境细菌中的绝大多数土壤细菌物种,充分反映了样品中各种细菌的真实情况。
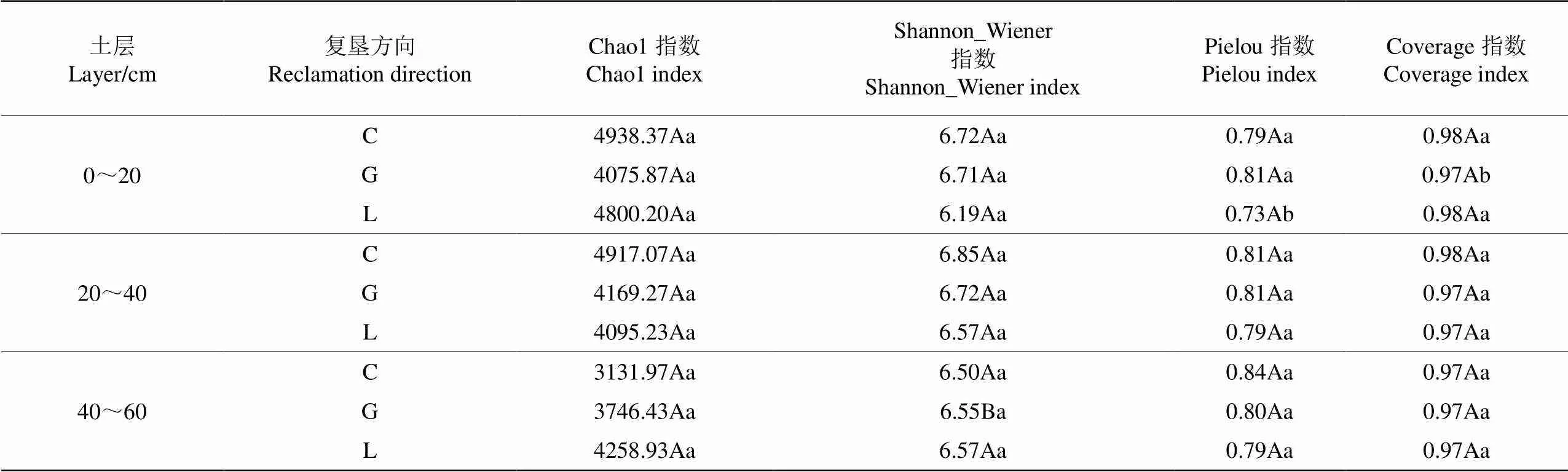
表1 不同复垦方向土壤细菌Alpha多样性比较
注:不同小写字母表示同一土层中不同复垦方向之间差异显著(<0.05),不同大写字母表示同一复垦方向不同土层间差异显著(<0.05)。
Note: Different lowercase letters indicate significant differences between different reclamation directions in the same soil layer at the<0.05 level, different capital letters indicate significant differences between different soil layers in the same reclamation direction at the<0.05 level.
2.1.3 细菌Beta多样性
为了更加清晰地反映不同复垦方向细菌群落结构存在的差异性,本研究基于bray_curis距离矩阵对OTU分类水平的细菌群落进行非度量多维尺度分析(NMDS),通过二维排序图描述细菌群落组成之间的差异性(图3)。每个点代表1个土壤样本,不同颜色的点属于不同组,两点之间的空间距离越接近,表明两样本之间的细菌群落组成相似度越高,差异越小。图3显示,NMDS分析图的应力函数值stress=0.10(<0.2),认为NMDS二维空间的拟合结果可以准确反映不同复垦方向细菌群落的真实情况。对比同一方向不同土壤样本细菌群落组成之间差异性小,对比不同方向的土壤细菌样本,细菌群落之间距离较近,相似性大。C1、C2之间差异性小,相似性大,都与C3 具有差异性。G1、G2和G3之间,细菌群落组成相似程度较近,各样本间差异性小,相似性大,同G3 具有差异性。L1、L2 和L3 之间,L1与L2差异性小,相似性大,同L3具有差异性。由以上可知,各土壤样本在空间上距离较近,表层和中层的土壤细菌群落相似性大,差异性小,表层、中层同深层土壤的细菌群落具有差异性,这是由于表中层土壤与深层土壤水分、通气性、温度、养分等土壤细菌生存状况不同,导致土壤细菌组成产生差异[19]。
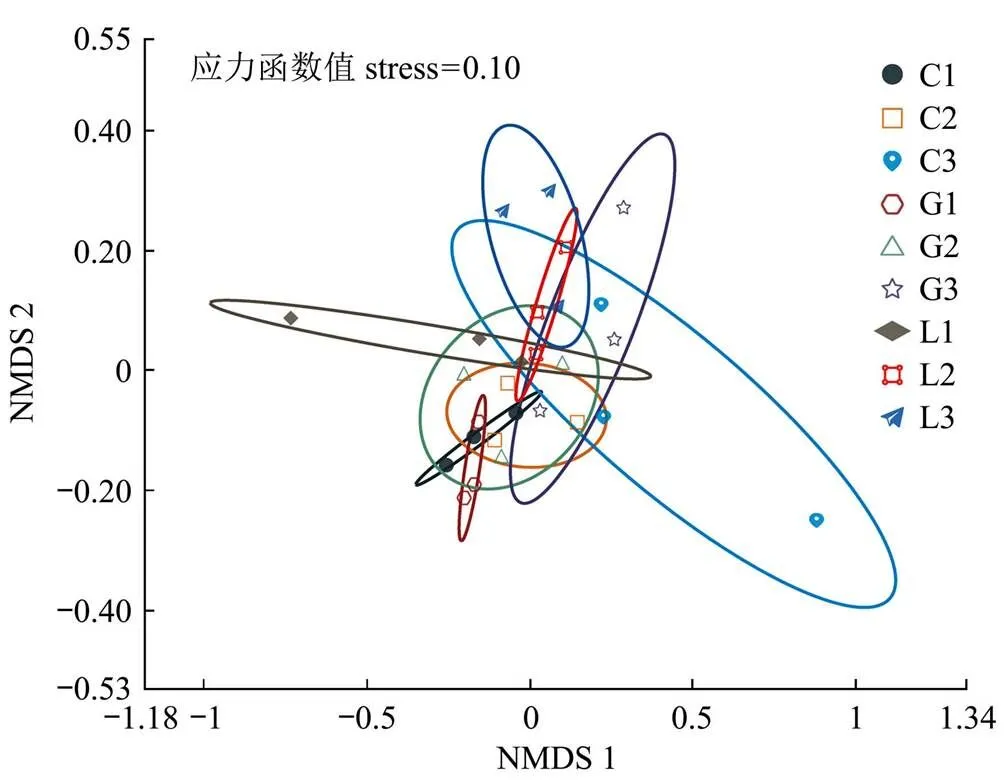
图3 基于bray_curis距离的细菌群落非度量多维尺度(NMDS)分析图
2.2 不同复垦方向土壤肥力特征分析
2.2.1 土壤肥力指标差异性
综合考虑土壤肥力的影响因素并结合试验条件,以方差分析为手段,选取全氮、速效磷、速效钾、有机质、pH对土壤肥力影响较大的肥力指标,明晰不同复垦方向土壤肥力特征,结果见表2。
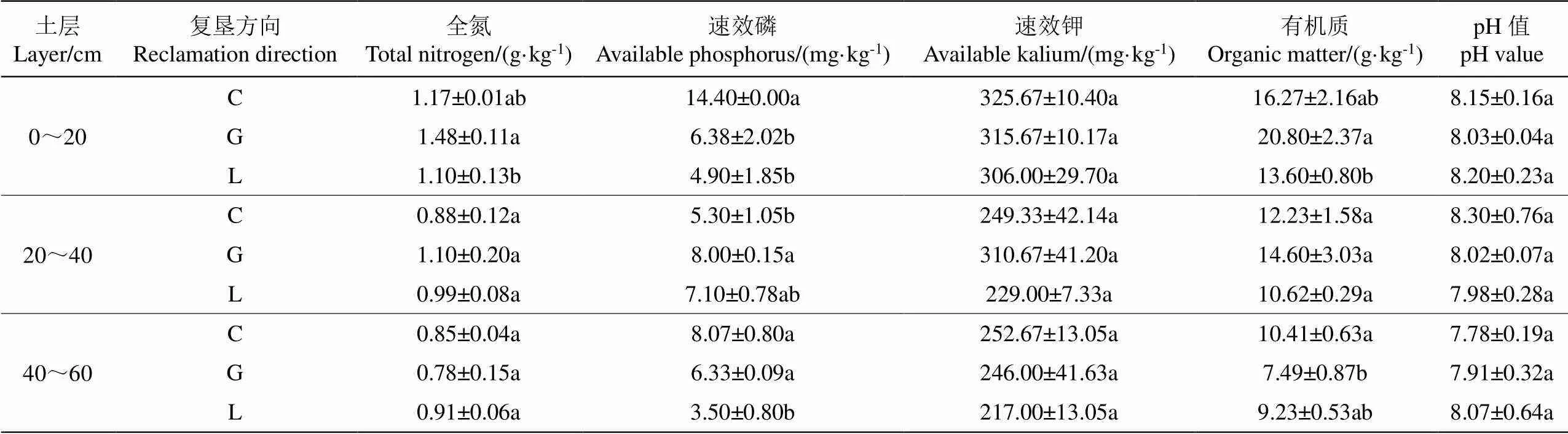
表2 不同复垦方向土壤肥力指标统计特征值
注:同列数据后不同小写字母表示<0.05 水平存在显著性差异。
Note: The different letters indicates significant differences at the level of<0.05.
表层(0~20 cm)土壤,速效钾在3种土壤复垦方向上变化波动不大,在306.00~325.67 mg/kg之间,并不存在显著性差异;耕地全氮、有机质含量为1.48 g/kg、20.80 g/kg,分别是林地的1.35倍、1.53倍;草地速效磷含量最高,相比于林地,增加了1.94倍;草地显著高于耕地、林地(<0.05);中层(20~40 cm)土壤,除速效磷外,不同复垦方向波动不大,并无显著性差异;耕地速效磷含量最高,为8.00 mg/kg,是草地(5.30 mg/kg)的1.51倍,各样地之间存在显著性差异(<0.05)。深层(40~60 cm)土壤,速效磷、有机质在3种复垦方向上,均呈现出不同类型的差异性,草地含量最高,分别为8.07 mg /kg、10.41 g/kg,高于林地1.31倍,耕地0.39倍,各样地之间存在显著性差异(<0.05)。样本pH值介于7.78~8.30之间,呈弱碱性,在不同复垦方向上并不存在显著性差异。
对照全国土壤养分含量分级标准表[20],研究区内土壤全氮含量介于0.78~1.47 g/kg之间,属中等水平;速效磷含量介于3.50~14.40 mg/kg之间,大部分处于中等水平,林地深层土壤较为缺乏;速效钾含量介于217~325.67 mg/kg之间,处于极高水平,含量较为丰富;有机质含量介于7.49~20.80 g/kg之间,大部分处于中等水平,耕地深层土壤较为缺乏。
2.2.2 土壤肥力指数
依据全国土壤养分含量分级标准表,选取全氮、速效磷、速效钾、有机质作为肥力评价因子,进行隶属度计算,消除量纲影响。查阅相关文献[21],选择S 型隶属度函数,同时参照《全国第二次土壤普查技术规程》,确定各指标隶属度函数转折点。采用变异系数法确定指标权重,根据各指标的隶属度和权重,然后将两者相乘并进行累加,即可得到复垦土壤肥力指数(Integrated Fertility Index,IFI),指数越大,表明区域土壤肥力越好。图4为不同复垦方向土壤肥力指数。
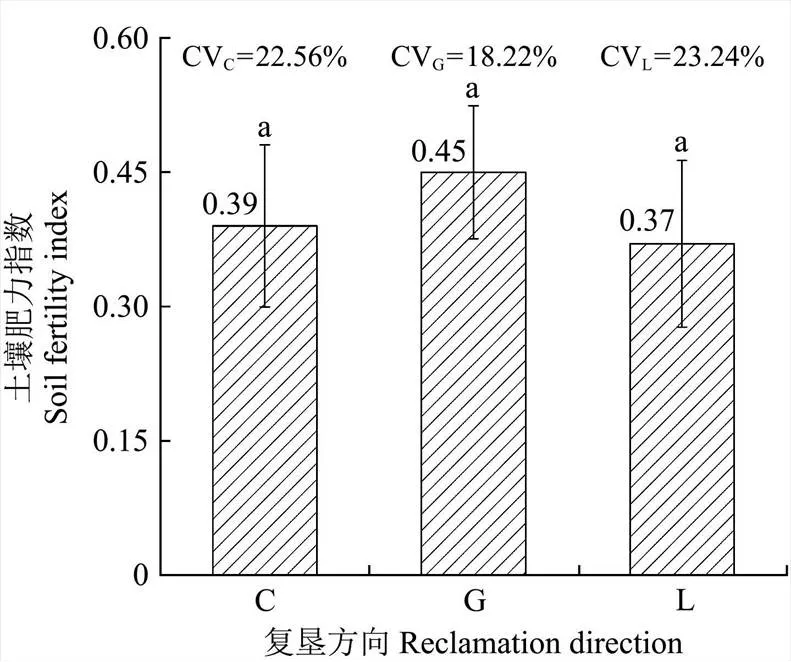
图4 不同复垦方向土壤肥力指数比较分析
图4显示,土壤肥力指数在不同复垦方向间并不存在显著性差异。耕地IFI值最高,为0.45,高于草地和林地,变异系数最低,为18.22%,说明在三种复垦方向中,耕地不同土层深度的土壤肥力相差较小,接近于平均水平,表明该地区最佳复垦方向为耕地。草地局部区域IFI值最大,标准差最高,变异系数偏高,说明草地不同土层深度土壤肥力存在差异性,偏差较大。林地IFI值最低,变异系数却为最高,说明林地土壤肥力最差,不同土层深度土壤肥力不均衡且偏低。
2.3 微生物多样性对土壤肥力响应作用
本研究将煤矸石充填复垦土壤细菌相对丰度视为衡量微生物多样性的测度指标,土壤肥力指数作为土壤肥力的评价指标,以此探讨微生物多样性对土壤肥力的响应作用。以土壤细菌相对丰度为响应变量,肥力因子为解释变量,基于RDA开展复垦土壤细菌相对丰度与肥力因子的冗余分析。
图5显示,第一排序轴(RDA1)解释了75.23%,第二排序轴(RDA2)解释了12.66%。前2个轴土壤肥力因子解释量达到了85%以上,说明轴1和轴2能解释绝大部分土壤细菌的分布情况。图中肥力因子各自所在射线与各土壤细菌群落相对丰度所在射线之间的夹角大小及其射线长度说明了土壤肥力因子对煤矸石充填复垦土壤细菌的影响程度:全氮(TN)与酸杆菌门()、鞘脂单胞菌属()、呈显著正相关(<0.05),与绿弯菌门()、固氮弓菌属()呈极显著负相关(<0.01);速效磷(AP)与变形菌门()、固氮弓菌属、呈显著负相关(<0.05);速效钾(AK)与酸杆菌门()、芽单胞菌门()、呈极显著负相关(<0.01),与绿弯菌门、固氮弓菌属极显著负相关(<0.01),与假单胞菌属()、、链霉菌属()显著负相关(<0.05);土壤有机质(SOM)与酸杆菌门呈显著正相关(<0.05),与拟杆菌门()、芽单胞菌门()呈极显著正相关(<0.01),与绿弯菌门、固氮弓菌属、链霉菌属极显著负相关(<0.01);土壤肥力指数(IFI)作为土壤肥力指标的综合反映,与奇古菌门()呈极显著正相关(<0.01),与链霉菌属呈显著负相关(<0.05),说明在土壤肥力的影响因子中,细菌相对丰度较低的菌群对土壤也有不可忽视的作用[22]。
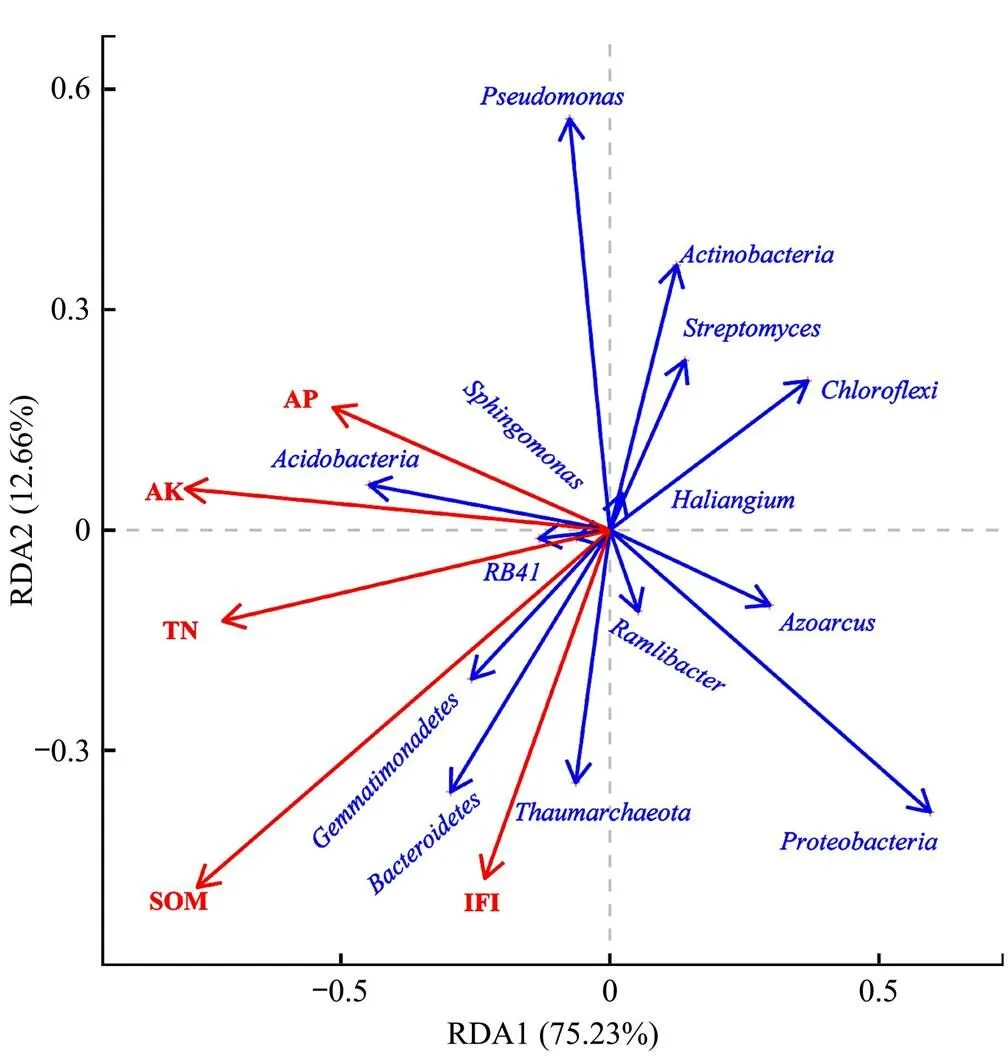
图5 细菌群落与肥力因子RDA分析
基于冗余分析结果,为进一步优选出对土壤肥力指数具有响应作用的细菌,利用皮尔森相关分析和线性回归模型探究主要细菌群落同土壤肥力指数之间的关系,结果见图6。
图6显示,土壤肥力指数与奇古菌门相对丰度极显著正相关(<0.001,2=0.55,图6a),与链霉菌属相对丰度显著负相关(=0.009,2=0.24,图6b),表明奇古菌、链霉菌可以在一定程度上影响研究区复垦土壤肥力。马静等[23]研究发现,奇古菌可以参与硝化作用,氧化铵应对采矿沉陷导致的土壤养分贫瘠环境,改善采煤沉陷区的土壤肥力。链霉菌属在微生物学上从属于放线菌门,何文[24]认为放线菌抗逆性强,产生的抗生素及次生代谢产物,可以大量地进行人工繁殖,喷施或者施入土壤,调节土壤微环境,并能长时间定殖,部分菌株还具有一定的促生作用等。这表明奇古菌、链霉菌可以改善土壤环境,增强土壤肥力。图6c、图6d表明变形菌门、放线菌门等主要优势菌群同土壤肥力指数的相关性并不显著,解释量为2≤0.1,>0.05,这可能与土壤环境的复杂性及矸石充填覆土的特殊性等多方面因素相关[25]。
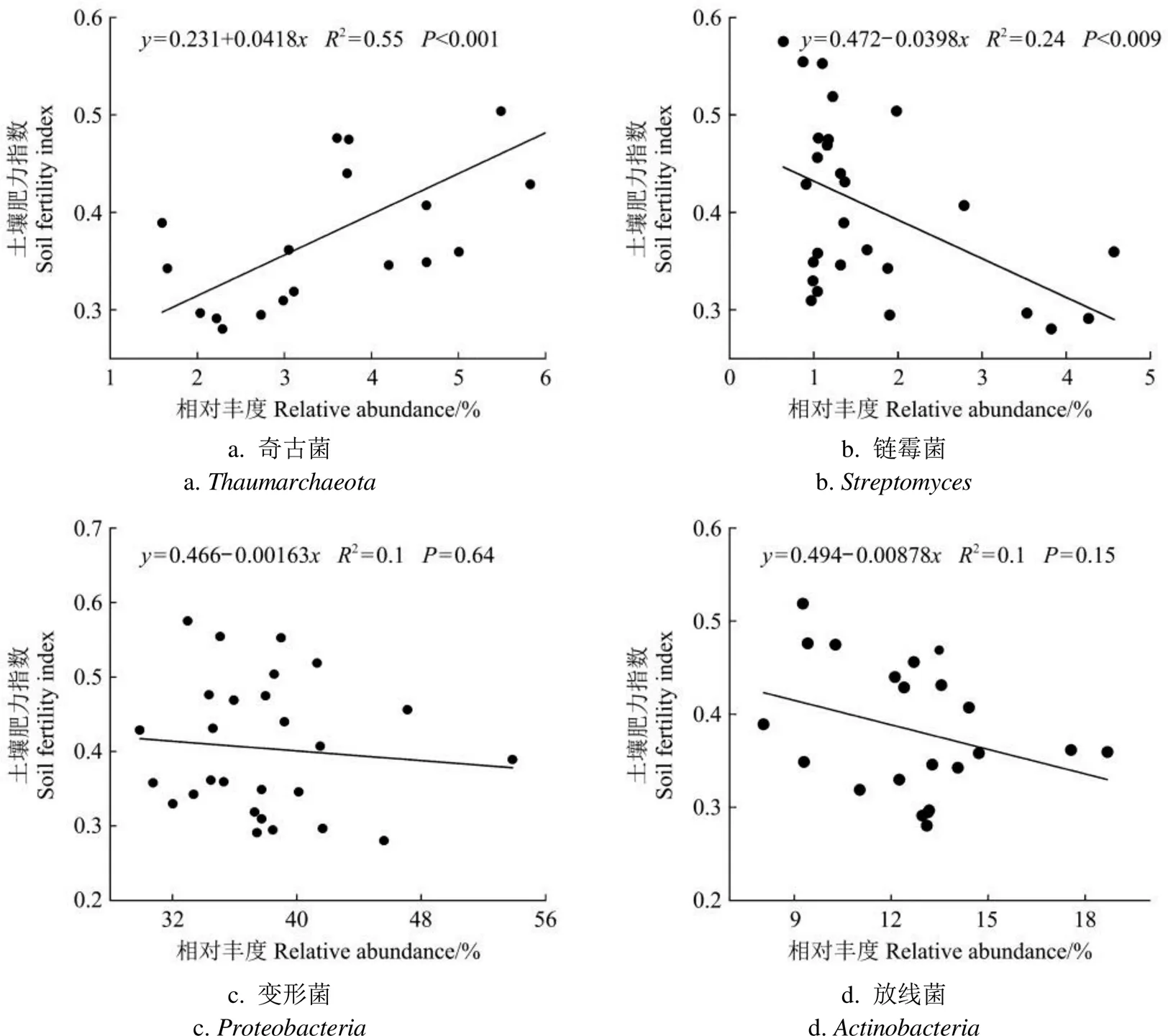
图6 土壤细菌相对丰度与土壤肥力指数的线性回归模型
综合考虑值、2因素,矸石充填不同复垦方向土壤肥力指数与奇古菌、链霉菌的相对丰度具有强相关性,对土壤肥力指数有一定响应作用,在研究区可通过二者的相对丰度变化表征土壤肥力的优劣,可采取措施合理人工干预,改善复垦土壤肥力,提高土地生产力。
3 讨 论
细菌是土壤微生物中占比最大,数量最多的种群[26],对于森林、草原及农田等的生态系统环境具有重要的影响,是一种驱动和保护地球的生物化学过程的关键因 素[27]。本研究发现,不同复垦方向中相对丰度最高的菌种保持一致,优势门类群(相对丰度前3)均为变形菌门(32.42%~42.97%)、酸杆菌门(10.47%~15.87%)、放线菌门(8.90%~18.28%),与孙瑞波等[28]和Liu等[29]在不同类型土壤中得到的细菌优势菌群相似。已有研究发现,变形菌以善于利用各种有机物的独特性而在营养丰富的环境中更易受到青睐[30],变形菌的相对丰度最高,这与一些研究所报道的结果相一致[31-32],证实了矸石充填复垦土壤细菌群落结构中变形菌呈绝对优势,仅是在不同复垦方向土壤细菌群落间比例存在差异。纲分类水平下的优势菌种-变形杆菌()(29.30%)、-变形杆菌()(13.07%)在细菌分类上从属于变形菌门,也证实了变形菌在矸石充填复垦土壤中占据主导地位。该细菌作为土壤微生物中最丰富的种群之一,在农田[33]、矿区[34]等均属于优势群落,是土壤中最主要的细菌类群,其代谢活动是土壤中最主要的细菌活动。酸杆菌门广泛分布于各种恶劣的自然环境中,可以改变土壤的酸性条件,对矿山土壤酸化生态起着重要作用[35]。放线菌门具有降解和利用有机物的潜在能力[36],是土壤养分供给的主要来源,在矿山恶劣环境中分布广泛。Alpha多样性分析表明,表中层草地土壤细菌Shannon_Wiener指数高于耕地、林地,Huang等[37]认为土壤表面的残渣、土壤有机物等创造了有利于微生物的栖息地。研究区草地种植大滨菊等草本植物,具备了较为丰富的植物群落,土壤养分供给充足,有利于土壤微生物的活动,与Huang等[37]的发现类似;Chao 1指数,总体趋势为林地>草地>耕地,这与蔡进军等的研究结果一致[38]。Beta多样性分析结果显示,煤矸石充填复垦土壤在不同复垦方向细菌群落并无明显差异性,土壤细菌群落组成与土层深度呈负相关,是因为随着土壤深度的増加,能被土壤微生物分解利用的动植物残体逐渐减少,这与焦赫等[25]的研究结果比较一致。本文研究发现,pH值同Chao1指数的变化一致,在一定程度上影响着复垦土壤微生物种群分布,但在不同复垦方向上差异不显著,可能是由于pH值变化较为平缓(7.78<pH<8.30),对微生物的生长影响不明显。
土壤细菌不仅能快速有效地分解和转化养分[39],影响植物对土壤肥力的获取,而且细菌群落结构的差异和变化规律还可以反映土壤的现状和演变,可以用来反映土壤肥力的质量[40]。本研究采取因子加权综合法对不同复垦方向土壤肥力进行综合评价,并依据肥力评价结果,基于冗余分析、线性回归模型揭示了土壤细菌群落同土壤肥力指数之间的关系。冗余分析阐明了RDA模型的解释量超过了85%,说明本研究所选取的肥力指标囊括了大部分对细菌群落作出贡献的因子。奇古菌门、链霉菌属对土壤肥力指数具有显著的相关性,说明二者对土壤肥力的提升有着重要的作用。肖玉娜等[41]研究发现奇古菌属于有氧氨氧化功能群和硝化功能群,可以氧化极低浓度的铵以应对采矿沉陷导致的土壤养分贫瘠环境。Brochier-Armanet等[42]认为奇古菌类微生物属于化能自养型微生物,在氮代谢循环中起着非常重要的作用,其分类下的氧化氨生成硝酸盐而进行化能自养生活[43]。以上研究结果证实奇古菌可以通过硝化作用促进氮代谢循坏,间接改善土壤肥力。链霉菌作为放线菌的主要构成类群,在自然界分布广泛,具有代谢多样性,能够产生细胞外水解酶代谢糖、氨基酸和芳香族等化合物,其产生的抗生素、多氧酶素等在现代农业中应用广泛。Dias等[44]研究发现施用链霉菌菌肥对干旱胁迫下种植的玉米产量有显著影响,将耐旱的链霉菌接种到Cd千穗谷(),通过增加谷胱甘肽,提高过氧化氢酶活性及减少叶片中的丙二醛含量,以此增强植物对Cd的耐受性[45]。文一等[46]认为链霉菌具有较强的抗砷毒害能力,可作为强化蜈蚣草修复砷污染土壤的材料。这些研究结果表明,尽管链霉菌是产生各种抗生素的主要来源,但其产生的抗生素类物质可以特异性地作用于某些病原菌,降低其生长和繁殖速度,优化土壤微生物生存环境,间接促进土壤肥力的提升。
复垦土壤微生物多样性和群落结构不仅受到复垦方向的影响,复垦年限、充填基质同样会对其产生影响。侯湖平等[9]发现随着时间的推移,复垦土壤的微生物群落结构组成会逐渐发生变化。在煤矸石充填复垦0~6a细菌群落多样性较低,复垦15a后土壤各种性质、微生物群落均已接近正常农田土壤的水平[47]。Dangi 等[48]分析了不同复垦阶段土壤微生物群落结构的变化特征,发现微生物群落结构在复垦14a基本恢复为正常土壤水平。Dimitriu等[49]的研究表明,尾矿砂充填复垦土壤中微生物量较自然土壤明显降低,不适宜土壤微生物结构和功能的改善。董梦阳等[50]发现在以蛭石、粉煤灰为充填基质的土壤微生物中,代谢产酸能力较强的酸杆菌、放线菌等细菌成为优势种群。目前的研究证实,复垦土壤细菌群落结构及其多样性受到诸多因素共同影响,而多因素影响下的土壤微生物环境较为复杂。本文采取控制变量法,旨在揭示同一年限(15a)、同种充填基质(煤矸石)条件下不同复垦方向(草地、耕地、林地)对微生物多样性及种群结构的影响,对复垦年限、充填基质及其相互影响下的微生物研究将作为下一步研究的重点。
4 结 论
1)变形菌门、酸杆菌门、放线菌门为所有样本中的主要优势菌门,其中变形菌门占据绝对优势,在不同复垦方向占比均高达30%以上,优势菌在不同样本间变动不大,但比例会随着土层深度增加而产生变化。
2)土壤细菌群落多样性与丰富度整体上随土层深度增加呈下降趋势,40~60 cm土层细菌群落多样性与丰富度明显低于其他土层,在不同复垦方向不存在显著差异性。0~20 cm和20~40 cm土层,草地Chao1指数和Shannon_Wiener指数大于耕地和林地,但差异不显著。深层土壤细菌群落组成明显不同于其他土层。
3)RDA分析表明,TN、SOM、AP和AK是影响土壤细菌群落组成的主要肥力因子,但部分优势菌群对肥力因子的响应并不明显,可能与土壤微生物群落的高度复杂性以及矸石充填的特殊性等多方面因素相关。基于回归模型,土壤肥力指数与奇古菌门相对丰度呈极显著正相关(<0.01),同链霉菌属呈显著负相关(<0.05),二者可作为复垦土壤肥力的响应细菌,通过其相对丰度的变化衡量土壤肥力状况,助力于两淮矿区采煤沉陷地复垦土壤生产力的提高。
[1] 徐良骥,黄璨,李青青,等.煤矸石粒径结构对充填复垦重构土壤理化性质及农作物生理生态性质的影响[J]. 生态环境学报,2016,25(1):141-148.
Xu Liangji, Huang Can, Li Qingqing, et al. Study on the physical-chemical properties of reconstructed soil in filling area affected by the substrate made of coal gangue with different particle size distributions and the crop effect[J]. Ecology and Environmental Science, 2016, 25(1): 141-148. (in Chinese with English abstract)
[2] 陈孝杨,王芳,严家平,等. 覆土厚度对矿区复垦土壤呼吸昼夜变化的影响[J]. 中国矿业大学学报,2016,45(1):164-169.
Chen Xiaoyang, Wang Fang, Yan Jiaping, et al. Effects of soil cover thickness on diurnal variation of soil respiration during reclamation in mining area[J]. Journal of China University of Mining & Technology, 2016, 45(1): 164-169. (in Chinese with English abstract)
[3] 安丽芸,李君剑,严俊霞,等. 微生物多样性对土壤碳代谢特征的影响[J]. 环境科学,2017,38(10):4420-4426.
An Liyun, Li Junjian, Yan Junxia, et al. Effects of microbial diversity on soil carbon mineralization[J]. Environmental Science, 2017, 38(10): 4420-4426. (in Chinese with English abstract)
[4] 樊文华,白中科,李慧峰,等. 不同复垦模式及复垦年限对土壤微生物的影响[J]. 农业工程学报,2011,27(2):330-336.
Fan Wenhua, Bai Zhongke, Li Huifeng, et al. Effects of different vegetation restoration patterns and reclamation years on microbes in reclaimed soil[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2011, 27(2): 330-336. (in Chinese with English abstract)
[5] Li Y Y, Chen L Q, Wen H Y, et al. Pyrosequencing-based assessment of bacterial community structure in mine soil affected by mining subside[J]. International Journal of Mining Science and Technology, 2014(24): 701-705.
[6] 曹梦,张兰兰,李贞,等.复垦年限及植被模式对煤矿复垦土壤微生物多样性的影响(英文)[J]. 农业工程学报,2019,35(5):278-285.
Cao Meng, Zhang Lanlan, Li Zhen, et al. Effects of regenerated periods and vegetation modes on soil microbial functional diversity in regenerated land of opencast coal mine[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(5): 278-285. (in English with Chinese abstract)
[7] Kim K Y, Kim H T, Kim D, et al. Distribution characteristics ofairborne bacteria and fungi in the feedstuff-manufacturing factories[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1054-1060.
[8] 王继玥,刘燕,刘勇,等. 基于高通量测序检测Pb污染对三叶草根际土壤细菌多样性的影响[J]. 环境科学研究,2018,31(1):102-110.
Wang Jiyue, Liu Yan, Liu Yong, et al. Effect of lead pollution on bacterial diversity in rhizosphere of clover based on high-throughput sequencing[J]. Research of Environmental Sciences, 2018, 31(1): 102-110. (in Chinese with English abstract)
[9] 侯湖平,王琛,李金融,等. 煤矸石充填不同复垦年限土壤细菌群落结构及其酶活性[J]. 中国环境科学,2017,37(11):4230-4240.
Hou Huping, Wang Chen, Li Jinrong, et al. Variation of bacterial community structure and enzyme activities in reclaimed soil filled with coal gangues along a relamation chronosequence[J]. China Environmental Science, 2017, 37(11): 4230-4240. (in Chinese with English abstract)
[10] 王瑾. 西部煤矿区开采扰动对根际微生态影响及微生物复垦效应[D]. 北京:中国矿业大学(北京),2015.
Wang Jin. Impacts of Coal Mining Disturbance on Rhizosphere Micro-ecological and Microbial Reclamation Effect in Western Area of China[D]. Beijing: China University of Mining & Technology, (Beijing), 2015. (in Chinese with English abstract)
[11] Li J J, Zhou X M, Yan J X, et al. Effects of regenerating vegetation on soil enzyme activity and microbial structure in reclaimed soils on a surface coal mine site[J]. Applied Soil Ecology, 2015, 87: 56-62.
[12] 徐良骥,黄璨,章如芹,等. 煤矸石充填复垦地理化特性与重金属分布特征[J]. 农业工程学报,2014,30(5):211-219.
Xu Liangji, Huang Can, Zhang Ruqin, et al. Physical and chemical properties and distribution characteristics of heavy metals in reclaimed land filled with coal gangue[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(5): 211-219. (in Chinese with English abstract)
[13] 鲍士旦. 土壤农化分析(第三版)[M]. 北京:中国农业出版社,2000.
[14] 严婷婷,赵艳,王超霞,等. 水稻种子内生细菌16S rDNA基因高通量测序PCR引物筛选和菌群结构分析[J]. 农业生物技术学报,2021,29(2):316-326.
Yan Tingting, Zhao Yan, Wang Chaoxia, et al. Screening of PCR primers targeted 16S rDNA gene for high throughput sequencing of endophytic bacteria in rice (oryza sativa) seeds and analysis of bacterial community structure[J]. Journal of Agricultural Biotechnology, 2021, 29(2): 316-326. (in Chinese with English abstract)
[15] Li P, Liang H B, Lin W T, et al. Microbiota dynamics associated with environmental conditions and potential roles of cellulolytic communities in traditional Chinese cereal starter solid-state fermentation[J]. Applied and Environmental Microbiology, 2015, 81(15): 5144-5156.
[16] Nottingham A T, Fierer N, Turner B L, et al. Microbes follow Humboldt:temperature drives plant and soil microbial diversity patterns from the Amazon to the Andes[J]. Ecology, 2018, 99(11): 2455-2466.
[17] Agnelli A, Ascher J, Corti G, et al. Distribution of microbial communities in a forest soil profile investigated by microbial biomass, soil respiration and DGGE of total and extracellular DNA[J]. Soil Biology and Biochemistry, 2004, 36(5): 859-868.
[18] Stursová M, Baldrian P. Effects of soil properties and management on the activity of soil organic matter transforming enzymes and the quantification of soil-bound and free activity[J]. Plant Soil, 2011, 338(1/2): 99-110.
[19] 蔡芸霜. 桂西北峰丛洼地典型农区不同耕作模式对土壤微生物群落特征的影响研究[D]. 南宁:南宁师范大学,2020.
Cai Yunshuang. Response to Soil Microbial Characteristics on Different Tillage Models in the Typical Farming Area of Peak-cluster Depression, Northwest Guangxi[D]. Nanning: Nanning Normal University, 2020. (in Chinese with English abstract)
[20] 全国土壤普查办公室. 中国土壤普查技术[M]. 北京:农业出版社,1992.
[21] 孙海运,李新举,胡振琪,等. 马家塔露天矿区复垦土壤质量变化[J]. 农业工程学报,2008,24(12):205-209.
Sun Haiyun, Li Xinju, Hu Zhenqi, et al. Variance of reclamation soil quality in Majiata opencast mine region[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 24(12): 205-209. (in Chinese with English abstract)
[22] 李文广,杨晓晓,黄春国,等. 饲料油菜作绿肥对后茬麦田土壤肥力及细菌群落的影响[J]. 中国农业科学,2019,52(15):2664-2677.
Li Wenguang, Yang Xiaoxiao, Huang Chunguo, et al. Effects of rapeseed green manure on soil fertility and bacterial community in dryland wheat field[J]. Scientia Agricultura Sinica, 2019, 52(15): 2664-2677. (in Chinese with English abstract)
[23] 马静,卢永强,张琦,等.黄土高原采煤沉陷对土壤微生物群落的影响[J]. 土壤学报,2021,58(5):1278-1288.
Ma Jing, Lu Yongqiang, Zhang Qi, et al. Effects of coal mining subsidence on soil microbial community in the loess plateau[J]. Acta Pedologica Sinica, 2021, 58(5):1278-1288.(in Chinese with English abstract)
[24] 何文. 农用黄赭色链霉菌菌剂的制备工艺及应用效果研究[D]. 泰安:山东农业大学,2017.
He Wen. Preparation of Agricultural Agent withSilaceus and Its Application Effect[D]. Taian:Shandong Agricultural University, 2017. (in Chinese with English abstract)
[25] 焦赫,李新举.煤矸石充填复垦土壤细菌群落变化[J].煤炭学报,2021,46(10):3332-3341.
Jiao He, Li Xinju. Variation in the soil bacterial community of reclaimed land filled with coal gangue[J]. Journal of China Coal Society, 2021, 46(10): 3332-3341. (in Chinese with English abstract)
[26] 厉桂香,马克明. 北京东灵山树线处土壤细菌的PICRUSt基因预测分析[J]. 生态学报,2018,38(6):2180-2186.
Li Guixiang, Ma Keming. PICRUSt-based predicted metagenomic analysis of treeline soil bacteria on Mount Dongling, Beijing[J]. Acta Ecologica Sinica, 2018, 38(6): 2180-2186. (in Chinese with English abstract)
[27] Veresoglou S D, Halley J M, Rillig M C. Extinction risk of soil biota[J]. Nature Communications, 2015, 6(1): 8862
[28] 孙瑞波,郭熙盛,王道中,等. 长期施用化肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 微生物学通报,2015,42(10):2049-2057.
Sun Ruibo, Guo Xisheng, Wang Daozhong, et al. The impact of long-term application of chemical fertilizers and straw returning on soil bacterial community[J]. Microbiology China, 2015, 42(10): 2049-2057. (in Chinese with English abstract)
[29] Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113-122.
[30] Goldfarb K C, Karaoz U, Hanson C A, et al. Differential growth responses of soil bacterial taxa to carbon substrates of varying chemical recalcitrance[J]. Frontiers in Microbiology, 2011, 2(94): 94.
[31] Tang Z X, Fan F L, Wan Y F, et al. Abundance and diversity of RuBisCO genes responsible for CO2fixation in arid soils of Northwest China[J]. Pedosphere, 2015, 25(1): 150-159.
[32] Xiao H B, Li Z W, Chang X F, et al. Microbial CO2assimilation is not limited by the decrease in autotrophic bacterial abundance and diversity in eroded watershed[J]. Biology and Fertility of Soils, 2018, 54(5): 595-605.
[33] Xue K, Wu L Y, Deng Y, et al. Functional gene differences in soil microbial communities from conventional, low-input, and organic farmlands.[J]. Applied and Environmental Microbiology, 2013, 79(4): 1284-1292.
[34] Rodionov A, Dubchak I, Arkin A, et al. Reconstruction of regulatory and metabolic pathways in metal-reducing delta-proteobacteria.[J]. Genome Biology, 2004, 5(11): R90
[35] Liu J J, Sui Y Y, Yu Z H, et al. Diversity and distribution patterns of acidobacterial communities in the black soil zone of northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 212-222.
[36] Banerjee S, Walder F, Buchi L, et al. Agricultural intensification reduces microbial network complexity and the abundance of keystone taxa in roots[J]. ISME Journal: Multidisciplinary Journal of Microbial Ecology, 2019, 13(4): 1722-1736.
[37] Huang Y, Yesilonis I, Szlavecz K. Soil microarthropod communities of urban green spaces in Baltimore, Maryland,USA[J]. Urban Forestry & Urban Greening, 2020, 53(1/2): 126676.
[38] 蔡进军,董立国,李生宝,等. 黄土丘陵区不同土地利用方式土壤微生物功能多样性特征[J]. 生态环境学报,2016,25(4):555-562.
Cai Jinjun, Dong Liguo, Li Shengbao, et al. The characteristics of soil microbe function diversity in semi-arid loess hilly region[J]. Ecology and Environmental Sciences, 2016, 25(4): 555-562. (in Chinese with English abstract)
[39] Bardgett R D, Putten W H V D. Belowground biodiversity and ecosystem functioning[J]. Nature, 2014, 515(7528): 505-511.
[40] 张文文,刘秉儒,牛宋芳. 引黄灌区不同种植年限紫花苜蓿土壤养分与细菌群落特征研究[J]. 草业学报,2019,28(5):46-54.
Zhang Wenwen, Liu Bingru, Niu Songfang. Correlation between soil nutrient status and the bacterial community composition in alfalfa stands of different ages in the Yellow River irrigation area[J]. Acta Prataculturae Sinica, 2019, 28(5): 46-54. (in Chinese with English abstract)
[41] 肖玉娜,钟信林,王北辰,等. 通辽科尔沁地区土壤微生物群落结构和功能及其影响因素[J]. 地球科学,2020,45(3):1071-1081.
Xiao Yuna, Zhong Xinlin, Wang Beichen, et al. Microbial community structure and function and their influencing factors in the soil of Horqin Area of Tongliao City, Inner Mongolia[J]. Earth Science, 2020, 45(3): 1071-1081. (in Chinese with English abstract)
[42] Brochier-Armanet C, Boussau B, Gribaldo S, et al. Mesophilic crenarchaeota: Proposal for a third archaeal phylum, the Thaumarchaeota[J]. Nature Reviews Microbiolpgy, 2008, 6(3): 245-252.
[43] Arp D J, Stein L Y. Metabolism of inorganic N compounds by ammonia-oxidizing bacteria[J]. Critical Reviews in Biochemistry and Molecular Biology, 2003, 38 (6): 471-495.
[44] Dias M P, Bastos M S, Xavier V B, et al. Plant growth and resistance promoted by Streptomyces spp. in tomato[J]. Plant Physiology and Biochemistry, 2017, 118: 479-493
[45] Cao S M, Wang W K, Wang F, et al. Drought-tolerant Streptomyces pactum Act12 assist phytoremediation of cadmium-contaminated soil by Amaranthus hypochondriacus: Great potential application in arid/semi-arid areas[J]. Ecology, Environment & Conservation, 2016, 23(15): 14898-14907.
[46] 文一,廖晓勇,阎秀兰. 链霉菌的抗砷特性及其对蜈蚣草富集砷的作用[J]. 生态毒理学报,2013,8(2):186-193.
Wen Yi, Liao Xiaoyong, Yan Xiulan. Arsenic-resistance ofsp. andits effects on arsenic enrichment of pteris vittata L. [J]. Asian Journal of Ecotoxicology, 2013, 8(2): 186-193. (in Chinese with English abstract)
[47] 李金融,侯湖平,王琛,等. 基于高通量测序的复垦土壤细菌多样性研究[J]. 环境科学与技术,2018,41(12):148-157.
Li Jinrong, Hou Huping, Wang Chen, et al. Soil bacteria diversity of reclaimed soil based on high throughput sequencing[J]. Environmental Science & Technology, 2018, 41(12): 148-157. (in Chinese with English abstract)
[48] Dangi S R, Stahl P D, Wick A F, et al. Soil microbial community recovery in reclaimed soilson a surface coal mine site[J]. Soil Science Society of Ameriacn Journal, 2012, 76(3): 915-924.
[49] Dimitriu P A, Prescott C E, Quideau S A, et al. Impact of reclamation of surface-mined boreal forest soils on microbial community composition and function[J]. Soil Biology and Biochemistry, 2010, 42(12): 2289-2297.
[50] 董梦阳,董远鹏,徐子文,等. 赤泥改良过程中微生物群落及酶活性恢复研究[J]. 中国环境科学,2021,41(2):913-922.
Dong Mengyang, Dong Yuanpeng, Xu Ziwen, et al. Resilience of soil microbiome and enzyme activity with soil amelioration of Bayer process red mud[J]. China Environmental Science, 2021, 41(2): 913-922. (in Chinese with English abstract)
Bacterial community structure of reclaimed soil and its relationship with soil fertility
Liu Jun1, Zhang Shiwen1,2※, Song Guifang1, Wang Yang1, Zhu Yafei1, Lu Shengjun1, Lan Miao1, Xia Shasha1
(1.,,232001,;2.,232001,)
Reclaimed soil can be utilized to quickly and effectively produce under reasonable manual intervention. This study aims to clarify the influence of the reclamation on soil microorganisms in the Lianghuai coal mine area. The coal gangue filling reclaimed soil was also taken as the research object in the field investigation and sampling. Illumina MiSeq high-throughput sequencing was used to analyze the V4 region of specific gene fragments of soil bacteria. Biodiversity was then explored to clarify the soil bacterial community and the response to soil fertility using non-metric multi-dimensional scale analysis, redundancy analysis, variance analysis, fertility index, and regression. The results show that there was no significant effect of reclamation directions on the distribution of bacterial dominant communities from the composition, but there were different proportions of reclamation directions. Specifically,(32.42%-42.97%),(10.47%- 15.87%),(8.90%-18.28%) were the main dominant bacteria groups. Among them,occupied the most, accounting for more than 30%. Alpha diversity demonstrated that there was no significant difference in the abundance and diversity of bacterial soil samples in different reclamation directions. Some indexes also maintained stable, where the Shannon_Wiener index ranged from 6.19 to 6.85, while Chao1 index ranged from 3131.97 to 4938.37, and the Pielou index of each sample fluctuated around 0.8. Beta diversity analysis showed that there was also no significant difference in the composition of bacterial communities in different reclamation directions. Furthermore, the composition of soil bacterial communities was negatively correlated with the soil depth. The composition of soil bacteria was attributed to different living conditions in the top, middle, and bottom soil layers, such as moisture, aeration, temperature, and nutrients. The pH value was consistent with the change of the diversity index, indicating only a slight influence on the dominant microbial flora and biodiversity. A one-way analysis of variance was carried out on the soil fertility indexes of reclamation directions. It was found that the content of fertility indexes in the surface soil was much higher than that in the bottom soil in general. The fertility quality was evaluated in the order of the cultivated land > grassland > forest, where the cultivated land performed the best reclamation direction. The redundancy analysis showed that the TN, SOM, AP, and AK were the main fertility factors to determine the composition of soil bacterial communities. But some dominant bacterial communities presented no response to the fertility factors, due to the high complexity of the soil microbial community and the regional conditions. The regression model showed that the soil fertility index was positively correlated with the relative abundance of the(<0.01), and thewas negatively correlated (<0.05). Moreover, there was no strong correlation with the main dominant phylum, due to the complexity of the soil environment of the coal gangue reclaimed land. Consequently, the relative abundance ofandcan be selected as important biological indicators to evaluate soil fertility, according to the linear regression and the functional effects ofand. The finding can also provide strong theoretical support to improve the fertility and quality of the reclaimed soil with the gangue at the microbial level in the Lianghuai mining area.
reclamation; bacteria; high-throughput sequencing; community structure; soil fertility
10.11975/j.issn.1002-6819.2021.21.015
S154.3
A
1002-6819(2021)-21-0124-10
刘俊,张世文,宋桂芳,等. 复垦土壤细菌群落结构及其与土壤肥力的关系[J]. 农业工程学报,2021,37(21):124-133.doi:10.11975/j.issn.1002-6819.2021.21.015 http://www.tcsae.org
Liu Jun, Zhang Shiwen, Song Guifang, et al. Bacterial community structure of reclaimed soil and its relationship with soil fertility[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(21): 124-133. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.21.015 http://www.tcsae.org
2021-06-05
2021-09-24
安徽省自然资源科技项目(2020-K-8);国家重点研发计划项目(2020YFC1908601);淮北矿业集团科技研发项目(No.2020-113)
刘俊,研究方向为矿区生态修复。Email:2020200081@aust.edu.cn
张世文,教授,博导,研究方向为矿区土地复垦与生态修复。Email:shwzhang@aust.edu.cn
