发酵虫草多糖提取工艺优化及其体外抗氧化、免疫活性研究
2022-01-26王兰英李绍平
王兰英,姜 玲,赵 静,李绍平*
1.珠海科技学院 药学与食品科学学院,广东 珠海 519041
2.澳门大学 中药质量研究国家重点实验室, 澳门 999078
冬虫夏草(C.sinensis)作为药用真菌中的珍稀品种,主要是麦角菌科真菌冬虫夏草菌寄生在蝙蝠蛾幼虫上,侵染后使虫体僵化在幼虫顶部长出子座和僵虫菌核,形成干燥的虫和菌的复合体[1],其内含丰富的生物活性物质,具有广泛药理作用。目前,由于自然环境的破坏和人为过度采伐等诸多因素导致野生虫草资源远远不能满足市场的需求。发酵虫草菌粉是从青海野生冬虫夏草中人工分离获得的麦角菌科真菌冬虫夏草(C.sinensis(Berk.)Sae.)的无性世代——中华束丝孢(SynnematumsinenseYinetShen sp.now)经人工液体深层发酵、干燥加工获得菌丝体的干燥粉末[2]。发酵虫草菌粉成分、药理作用与天然冬虫夏草基本一致[3],是天然冬虫夏草最好的替代品[4]。发酵虫草菌粉主要由多糖类、核苷类、氨基酸及其衍生物、甾醇类、醇类、鞘脂类等多种成分构成[5-6],其中多糖研究一直以来都是新资源功能食品及保健食品研发的热点,具有提高机体免疫[7]、抗氧化[8-9]、保肝护肝[10]、抗肿瘤[11]、平衡血脂血糖[12]等作用。本试验中所用发酵虫草菌粉样品分离自青海野生冬虫夏草,鉴定菌株后并已成功投入规模发酵培养,以菌丝体生产活性多糖及生物量为指标获得稳定高产发酵工艺。从发酵虫草菌粉中提取得到的虫草多糖样品具有浓郁奶香味,是菌粉中主要活性成分之一。作者通过对该菌株发酵生产虫草菌粉及发酵液样品提取的多糖进行体外抗氧化活性及免疫活性能力的比较,以期为该菌株发酵虫草菌粉及发酵液的利用和开发提供科学参考。
1 材料
1.1 菌种及菌粉样品
虫草菌由澳门大学中华医药研究院提供。发酵虫草菌粉取自100 L发酵罐中稳定发酵、离心干燥处理后的样品。
1.2 主要试剂
脂多糖(LPS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、modified griess:Sigma-Aldrich Lab and Production Materials;三羟基氨基甲烷、联苯三酚、水杨酸、铁氰化钾、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、抗坏血酸:上海源叶生物科技有限公司;浓盐酸:茂名市雄大化工有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):上海思域化工科技有限公司;二甲基亚砜(DMSO):阿法埃莎(中国)化学有限公司;无水乙醇:国药集团化学试剂有限公司;七水硫酸亚铁:巩义市金源化工有限公司;30%过氧化氢:武汉纯度生物科技有限公司;磷酸二氢钾、磷酸氢二钠:北京福瑞生物科技有限公司;三氯乙酸、三氯化铁、过硫酸钾:西陇化工股份有限公司。
1.3 主要仪器与设备
FA2204B型精密天平:上海精密仪器仪表有限公司;PS-10AD型超声仪:深圳市良谊实验室仪器有限公司;移液枪:赛默飞世尔科技公司;HWS-24型水浴锅:上海一恒科学仪器有限公司;XH-B型旋涡混合器:江苏天翎仪器有限公司;UV-2600型紫外光谱仪、IRPrestige-21型红外光谱仪:日本岛津;酶标仪:珀金埃尔默企业管理(上海)有限公司。
2 试验方法
2.1 多糖提取工艺优化
2.1.1 多糖提取方法
将虫草菌丝体干燥至恒质量,粉碎过50目筛。精确称取0.100 g菌丝体粉末,以30∶ 1 (mL/g)的液料比加入蒸馏水,并于80 ℃水浴锅中浸提2 h。4 000 r/min条件下离心10 min,收集上清液,残渣重复上述操作3次,合并滤液,浓缩至原体积的1/3。三氯甲烷-正丁醇(体积比为4∶ 1)与多糖浓缩液以1∶ 5进行振荡充分混合,4 000 r/min离心5 min除蛋白层。用活性炭(0.02 g/mL)除色素,40 ℃搅拌脱色2 h,重复3次后过滤收集滤液。滤液以1∶ 3逐滴、振摇加入无水乙醇,于4 ℃冰箱静置过夜。4 000 r/min离心获得沉淀,分别用乙醚、丙酮、无水乙醇洗涤,烘干即得多糖样品。
2.1.2 单因素试验
以液料比30∶ 1 (mL/g),提取温度80 ℃,提取时间2 h为考察基础条件。精确称取0.100 g菌丝体粉末,分别以液料比20∶ 1、30∶ 1、40∶ 1、50∶ 1、60∶ 1、70∶ 1、80∶ 1、90∶ 1、100∶ 1 (mL/g),提取温度30、40、50、60、70、80、90 ℃,提取时间0.5、1、1.5、2、2.5、3 h进行提取,考察各因素对多糖提取的影响。
2.1.3 正交试验
在单因素试验的基础上以提取时间、液料比、提取温度为因素,每个因素取3个水平,使用L9(33)正交表进行试验。
2.1.4 多糖含量测定
从上述提取获得的多糖样品溶液中吸取0.01 mL,补水至1.00 mL,采取蒽酮-硫酸法测定多糖含量[13]。以葡萄糖为对照绘制质量浓度梯度为0.00、0.02、0.04、0.06、0.08、0.10 mg/mL的葡萄糖标准曲线,在0~0.10 mg/mL范围内,线性关系良好,其拟合线性回归方程为y=2.625 7x-0.001,决定系数R2=0.999 9。按下式计算虫草多糖含量(W):
式中: C为样品糖含量,mg/mL;D为样品溶液稀释倍数;V为所测样品提取液总体积,mL;m为样品质量,mg。
2.2 多糖样品制备
按上述优化后的提取工艺对发酵虫草菌粉和发酵液进行多糖提取及纯化处理,获得虫草胞内粗多糖、胞内纯化多糖、发酵液粗多糖、发酵液纯化多糖样品。精确配制4种多糖样品溶液质量浓度为10mg/mL,超声辅助振荡使其溶解完全,即得虫草多糖样品母液。
2.3 虫草多糖特征吸收峰的检测
2.3.1 紫外光谱法分析多糖样品
按2.2中步骤配制4种多糖样品母液,以超纯水为对照,使用岛津UV-2600在200~800nm波长范围内间隔为1nm进行多糖样品光谱扫描。
2.3.2 红外光谱法分析多糖样品
采用傅里叶红外色谱法,分别称取提前干燥至恒定质量0.001g4种虫草多糖样品和0.100gKBr粉末,在研钵中研磨均匀并压制成待测片剂样品,在4 000~400cm-1范围进行光谱扫描。
2.4 多糖样品的抗氧化能力分析
2.4.1 虫草多糖对DPPH自由基清除能力的测定
配制抗坏血酸和多糖样品(0.00、0.10、0.20、0.40、0.60、0.80、1.00、2.00、4.00、6.00、8.00、10.00mg/mL),取上清液。参考刘城移等[14]的方法,加1.00mLDPPH(2mmol/L)溶液,涡旋混合5s,避光放置30min,测定多糖样品反应液于517nm下的吸光度Ax;以样品溶液与无水乙醇反应液为对照组,吸光度为Ad;空白参比溶液为蒸馏水,和DPPH溶液混合,测得的吸光度为Ao。阳性对照抗坏血酸组按上述操作进行处理,按下式计算DPPH自由基清除率。

2.4.2 虫草多糖对羟基自由基清除能力的测定
配制抗坏血酸和多糖样品(同2.4.1),取上清液。参考Chen等[15]的方法略加修改,等体积依此加入1.00mL硫酸亚铁(9mmol/L)、H2O2(8.8mmol/L)和邻羟基苯甲酸溶液(9mmol/L),混匀后在水浴37 ℃下反应30min,静置25min后测定510nm处样品溶液吸光度Ax;空白参比溶液以等体积H2O代替多糖样品反应,测得的吸光度为Ao;对照组以等体积H2O代替邻羟基苯甲酸、硫酸亚铁和H2O2溶液反应,测得的吸光度为Ad。阳性对照抗坏血酸组按上述操作进行处理,按下式计算样品羟基自由基清除率。

2.4.3 虫草多糖总还原能力测定
配制抗坏血酸和多糖样品(同2.4.1),取上清液。参考何晋浙等[16]的方法进行总还原力测定,空白参比溶液为2.500mLH2O代替多糖样品进行同样反应,测定各组溶液700nm下的吸光度。抗坏血酸组按多糖样品的操作进行处理作为阳性对照。
2.4.4 虫草多糖对超氧阴离子自由基清除能力的测定
配制抗坏血酸和多糖样品(同2.4.1),取上清液。参考何晋浙等[16]的方法略加修改,依次加入2.250mLTris-HCl缓冲溶液、2.00mL样液、0.050mL60mmol/L联苯三酚溶液,振荡摇匀后加入0.020mLHCL溶液(10mol/L)终止反应,测定反应溶液325nm下的吸光度Ax。空白组以2.00mLH2O取代样品反应测得的吸光度为Ao。对照组以H2O取代联苯三酚反应测得的吸光度为Ad。抗坏血酸组按上述操作进行处理作为阳性对照,按下式计算超氧阴离子自由基清除率。
2.4.5 虫草多糖对ABTS自由基清除能力的测定
配制抗坏血酸和多糖样品(同2.4.1),取上清液。参考梁红敏等[17]的方法,分别取1.00mL样品溶液,加3.000mLABTS溶液,黑暗条件下放置1h,测定734nm处的吸光度Ax。空白参比溶液为等体积H2O代替多糖样品反应测得的吸光度为Ao。对照组以磷酸盐缓冲液代替ABTS,吸光度为Ad。抗坏血酸组按上述操作进行处理作为阳性对照,按下式计算ABTS自由基清除率。

2.5 虫草多糖免疫活性能力测定
2.5.1 多糖对RAW264.7巨噬细胞增殖能力的影响
用PBS溶液配制虫草胞内及发酵液粗多糖样品(500、250、125、62.500、31.250、15.625、7.813、3.906μg/mL)和阳性对照组脂多糖(LPS,0.4μg/mL)。参考Deng等[18]的方法进行试验,于570nm下测定吸光度。细胞活力表示为多糖处理组和未经多糖处理的空白试验组之间的吸光度的比值。
2.5.2 多糖对巨噬细胞释放NO的影响
配制脂多糖(LPS)和多糖样品(同2.5.1),取上清液。参考Wu等[19]的方法进行试验,于540nm下测定吸光度。细胞NO的产生量表示为多糖处理组与LPS处理组之间的吸光度之比。
2.6 统计学分析
每次试验重复测定3次,采用Origin软件处理数据作图,用Excel、SPSS软件进行结果分析。
3 结果与讨论
3.1 单因素试验结果及分析
液料比对多糖提取的影响如图1a所示,随着液料比增加多糖含量随之增加,当液料比达到90∶ 1 (mL/g)时达到最高值。提取时间对多糖提取的影响如图1b所示,当提取时间低于1.5h时,多糖含量显著增加,在1.5h达到最高值,超过1.5h后多糖含量降低。提取温度对多糖提取的影响如图1c所示,随着温度的上升,多糖含量随之增加,在60 ℃达到最高值。因此,在单因素优化试验中液料比为90∶ 1 (mL/g)、提取时间为1.5h、提取温度为60 ℃条件下粗多糖百分含量最高。
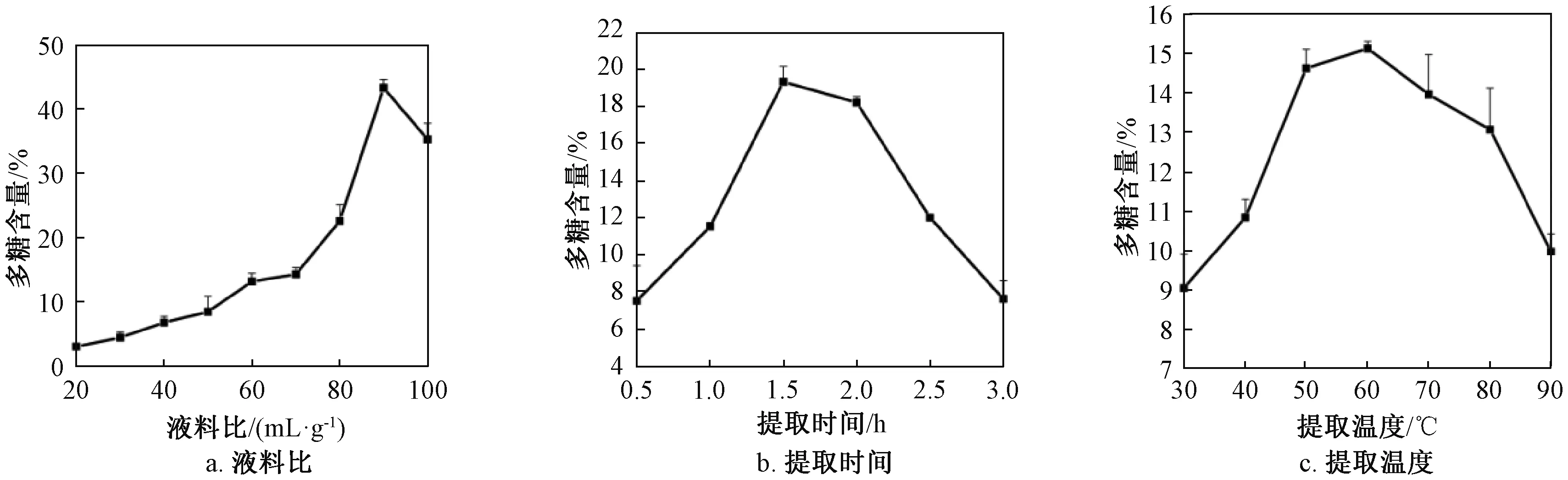
图1 单因素对多糖含量的影响
3.2 正交试验结果及分析
正交试验因素与水平见表1。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test design
正交试验结果如表2所示,影响发酵虫草菌粉多糖提取的因素重要性排序为A>B>C,最佳热水浸提条件组合为A3B3C2,即提取温度为65 ℃,液料比为95∶ 1 (mL/g),提取时间为1.5h。

表2 正交试验结果Table 2 Results of orthogonal experiment
3.3 虫草多糖紫外光谱分析
如图2所示,4种多糖样品在200nm附近出现强吸收峰,从发酵虫草菌粉提取的2种多糖样品在260nm和280nm处有较强吸收峰,纯化处理后的胞内纯化多糖样品的核酸(260nm)、蛋白质及多肽(280nm)含量相对较少。从发酵液中提取的多糖在260nm和280nm处无明显吸收峰,但胞外多糖相较于胞外纯化多糖紫外光谱来看,在260nm和280nm处有较小的凸起峰,判断可能存在少量的核酸及蛋白质[20-21]。

图2 发酵虫草菌粉及发酵液提取多糖的紫外光谱
3.4 虫草多糖红外光谱分析


图3 发酵虫草菌粉及发酵液提取多糖红外光谱
3.5 总还原力的测定结果
各组样品还原能力如图4a所示,随着质量浓度递增抗坏血酸还原能力逐渐增强,明显优于4种多糖样品,当质量浓度达到4mg/mL时抗坏血酸吸光度达到1.941,对应此质量浓度的还原能力达到最高,随后趋于稳定。在0~10mg/mL内4种多糖样品还原能力整体属于上升趋势,但胞内及发酵液多糖存在显著性差异,且胞内多糖相较于发酵液多糖在还原能力上具有明显优势,而同来源粗多糖和纯化多糖相差不大。在10mg/mL下,抗坏血酸组吸光度达到1.919,4种多糖总还原力强弱依此为胞内多糖(0.257)>胞内纯化多糖(0.250)>发酵液多糖(0.075)>发酵液纯化多糖(0.071)。
3.6 对超氧阴离子清除能力的测定结果
各组样品对超氧阴离子的清除能力如图4b所示,各组样品与质量浓度呈明显量效关系,整体上来看抗坏血酸的清除能力较好,在0.2mg/mL下清除率达到100%。4种多糖样品对超氧阴离子的清除能力相差不大,在10mg/mL下胞内多糖、胞内纯化多糖、发酵液多糖、发酵液纯化多糖的清除率可达到95.49%、80.74%、69.23%、75.73%。发酵液提取的2种多糖在1.5~5mg/mL范围内,粗多糖清除能力较强,4mg/mL以后发酵液纯化多糖清除能力无限接近胞内纯化多糖,且在5mg/mL以后发酵液纯化多糖清除能力优于发酵液多糖。综合来看,各组样品间清除能力强弱依次为胞内多糖>胞内纯化多糖>发酵液纯化多糖>发酵液多糖。
3.7 对羟基自由基清除能力的测定结果
各组样品对羟基自由基的清除能力如图4c所示,抗坏血酸及4种多糖样品在0~10mg/mL范围内随着溶液质量浓度递增呈现出较好的清除能力。在2mg/mL下,抗坏血酸清除率达到99.42%;在8mg/mL下胞内多糖、胞内纯化多糖、发酵液多糖、发酵液纯化多糖清除率可达到65.66%、89.36%、78.94%、48.44%。在4~8mg/mL范围内,虫草多糖样品清除能力整体趋势从大到小依此为胞内纯化多糖>发酵液多糖>胞内多糖>发酵液纯化多糖。
3.8 对DPPH自由基清除能力的测定结果
各组样品对DPPH自由基的清除能力如图4d所示,以抗坏血酸作为阳性对照,溶液质量浓度达到0.1mg/mL时清除率达到96.34%,随后趋于稳定。整组多糖样品随质量浓度的递增清除率随之增大,胞内多糖样品在0~6mg/mL范围内清除率上升至93.86%,随后呈现下降趋势。原因可能是,多糖样品在高浓度下溶解达到饱和,采用超声搅拌促溶方法导致多糖结构发生变化。胞内多糖及胞内纯化多糖的趋势相近,在8mg/mL下胞内多糖的清除率高于胞内纯化多糖,具有较高的清除能力。发酵液纯化多糖相较于发酵液多糖清除活性更强,在4mg/mL下发酵液纯化多糖清除率达到98.25%。在10mg/mL下4种多糖样品清除能力大小依此为发酵液纯化多糖(102.41%)>胞内纯化多糖(81.70%)>发酵液多糖(59.78%)>胞内多糖(48.51%)。
整组数据存在波动是由于DPPH适用于有机溶剂,当多糖达到一定浓度时,可能造成多糖溶液沉淀从而影响吸光度的测定。
3.9 对ABTS自由基清除能力测定结果
各组样品对ABTS自由基的清除能力如图4e所示,在样品质量浓度为0~10mg/mL范围内,阳性对照及4种多糖样品均具有较好活性,随着样品质量浓度的增加,清除能力呈现不同程度的增加。阳性对照组在0.1mg/mL时清除率可达到99.94%,胞内纯化多糖和胞内粗多糖的清除率分别在2mg/mL、4mg/mL达到100%,发酵液多糖及其纯化多糖在8mg/mL达到97.17%、97.73%。从检测结果来看,发酵液与发酵虫草菌粉提取的多糖均可达到较高的清除能力,相比之下胞内多糖在ABTS自由基清除能力上优于发酵液提取多糖。

图4 虫草多糖样品体外抗氧化活性
3.10 多糖样品抗氧化能力指标的对比
4种多糖样品抗氧化能力的EC50(抗氧化指标清除率达到50%的多糖样品有效质量浓度[22])和RP0.5 AU(总还原力测定中反应液吸光度达到0.5时多糖样品的质量浓度[23])对比如表3所示。从表3中的EC50来看,综合比较4种自由基中胞内提取多糖抗氧化能力优于发酵液多糖。在ABTS自由基组EC50中,胞内多糖、胞内纯化多糖、发酵液多糖、发酵液纯化多糖的EC50分别为0.75、0.43、1.67、1.40mg/mL,其对应清除率大小顺序为胞内纯化多糖>胞内多糖>发酵液纯化多糖>发酵液多糖;且从本组EC50来看,纯化处理后多糖纯度增大会明显提高多糖ABTS自由基清除能力。对DPPH自由基清除能力大小顺序为发酵液纯化多糖>胞内多糖>胞内纯化多糖>发酵液多糖,对超氧阴离子自由基清除能力大小顺序为胞内多糖>发酵液纯化多糖>胞内纯化多糖>发酵液多糖,对羟基自由基清除能力大小顺序为胞内多糖>发酵液多糖>胞内纯化多糖>发酵液纯化多糖。4种多糖样品在4个指标中以超氧阴离子自由基的EC50最小,清除率最高,差异性最小。发酵液多糖的DPPH自由基EC50最大,清除能力最弱,其次为发酵液纯化多糖的羟基自由基EC50,其余组EC50也略有差异,但差异不显著。从各个多糖样品总还原力的RP0.5AU来看,抗氧化能力大小顺序为胞内多糖>胞内纯化多糖>发酵液纯化多糖>发酵液多糖,可以明显看出从发酵虫草菌粉中提取的多糖在总还原力指标和抗氧化能力上显著优于发酵液提取的多糖。

表3 不同虫草多糖样品抗氧化能力EC50和RP0.5 AU比较
3.11 细胞存活率测定结果
由图5a可知,在3.906~500 μg/mL范围内,发酵虫草菌粉胞内及发酵液多糖细胞存活率随多糖质量浓度递增先增大后减小。与空白组细胞相比可知,2种多糖对细胞没有毒性,并且在31.25~125 μg/mL浓度范围内与空白组有显著性差异。与LPS组相比,在31.25~125 μg/mL下两种多糖样品细胞存活率比LPS组高(P<0.01),说明这2种多糖会显著性增大巨噬细胞的存活率,促进巨噬细胞增殖。
3.12 NO产生量测定结果
由图5b可知,2种虫草多糖均随质量浓度的递增而产生更多的NO,具有明显的量效关系。2种虫草多糖样品与空白组相对比,都能有效地增强细胞NO产生量。与LPS组进行比较发现,胞内多糖样品产生NO的活性在3.906~500 μg/mL范围内低于LPS组,但从试验结果数据趋势来看,多糖样品在高于500 μg/mL下可能会达到甚至超过LPS组产NO量;而相比之下,发酵液多糖的NO产生量更多,并且在大于250 μg/mL时与LPS组没有显著性差异,500 μg/mL时NO产生量优于LPS组,并且质量浓度与NO产生量呈现明显正相关趋势。通过2种虫草多糖样品对细胞NO产生量比较发现,发酵虫草菌粉胞外多糖产生NO的量要大于发酵虫草菌粉胞内多糖。
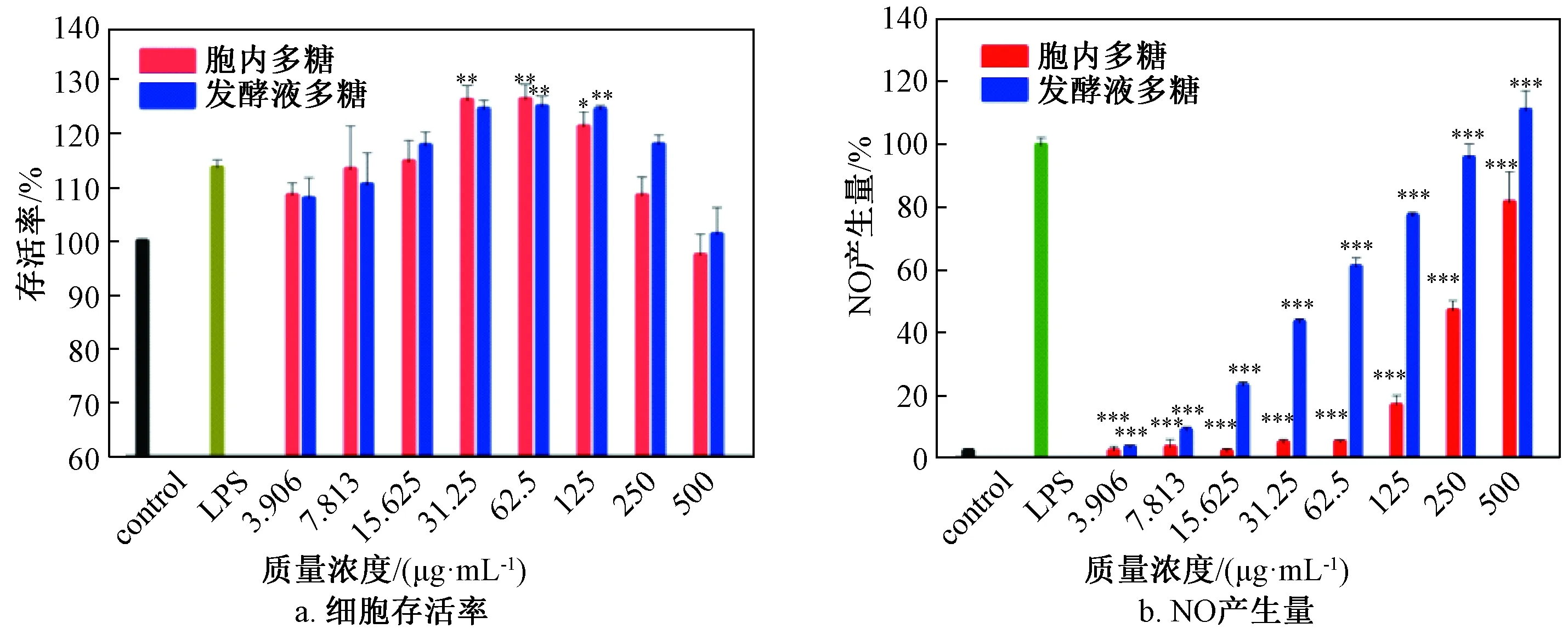
注:a图中*表示与control组之间P<0.05;**表示与control组之间P<0.01。b图中**表示与LPS组之间P<0.01;***表示与LPS组之间P<0.001。
4 结论
通过对液体深层发酵工艺生产的发酵虫草菌粉及发酵液提取的多糖样品进行紫外和红外光谱进行分析,并对该菌株发酵生产不同来源提取的虫草多糖进行活性比较。紫外光谱扫描结果表明4种多糖样品都存在不同程度的核酸及蛋白质残留,简单的纯化处理能大幅度降低多糖样品中核酸及蛋白质含量,且发酵液提取多糖尤其是发酵液纯化多糖在260 nm和280 nm处无明显核酸及蛋白质吸收峰,相较于发酵虫草菌粉提取多糖纯度较高。红外光谱扫描结果表明4种多糖样品是以β-糖苷键连接且具有吡喃糖环的酸性杂多糖,纯化后多糖有机质含量降低。由虫草多糖样品抗氧化能力指标EC50和RP0.5 AU可知,发酵虫草菌粉及发酵液提取的多糖均具有较好的抗氧化活性,且胞内多糖抗氧化活性整体最高,ABTS自由基、DPPH自由基、超氧阴离子自由基、羟基自由基清除能力的EC50和总还原力的RP0.5 AU分别为0.75、2.12、0.13、1.77和156.30 mg/mL。在免疫活性测定中发现这两种不同来源提取多糖不仅能较好地促细胞增殖,还能增强细胞产NO的能力。
