系统性红斑狼疮患者血清中HMGB1与IFNα的表达水平及其临床意义
2022-01-26李鑫
李 鑫
天津市南开区三潭医院检验科,天津 300193
系统性红斑狼疮(SLE)是一种由于机体免疫调节紊乱所致的慢性炎症性疾病,其临床表现多样[1],体内积聚的致病性自身抗体与抗原结合形成免疫复合物(ICs)沉积于靶器官,ICs可激活树突细胞(DCs)上的Toll样受体(TLR),引起Ⅰ型干扰素(IFN)系统的变化,通过促进CD4+T淋巴细胞、CD8+T淋巴细胞和B细胞的一系列自身免疫反应,引起免疫调节异常,尤其是细胞凋亡异常、细胞因子分泌异常等[2]。此过程中,高迁移率族蛋白-1(HMGB1)的释放增加,后者可维持免疫复合物的稳定,促进HMGB1进入内涵体,与TLR接触后引起进一步的自身免疫反应[3]。HMGB1活化DCs,促其产生大量IFNα,后者进一步活化免疫细胞,促进细胞因子生成[4]。HMGB1与IFNα可能在SLE的发病过程中相互促进,级联放大。本研究检测SLE患者血清IFNα、HMGB1及IL-1β等细胞因子水平,以探讨IFNɑ、HMGB1等细胞因子在SLE疾病发生、发展中的作用,并评估IFNα、HMGB1与SLE疾病活动的相关性及这些指标检测的临床应用价值。
1 资料与方法
1.1一般资料 选取2018年1月至2019年12月在本院诊治的70例SLE患者(SLE组)作为研究对象,均符合2017年美国风湿病学会和欧洲风湿病协会修订的SLE分类标准[5],女性63例,男性7例,平均年龄(37.1±8.6)岁;根据SLE病情活动指数(SLEDAI)又将SLE患者分为活动组(SLEDAI≥5)与非活动组(SLEDAI<5),其中活动组44例,非活动组26 例,活动组、非活动组一般资料比较见表1。同期在本院诊治的15例类风湿关节炎(RA)患者作为RA组,女性13例,男性2例,平均年龄(34.2±7.1)岁。健康对照组为同期在本院体检健康者35例,平均年龄(35.2±7.1)岁。健康对照组、RA组与SLE组在年龄、性别上比较差异无统计学意义(P>0.05)。
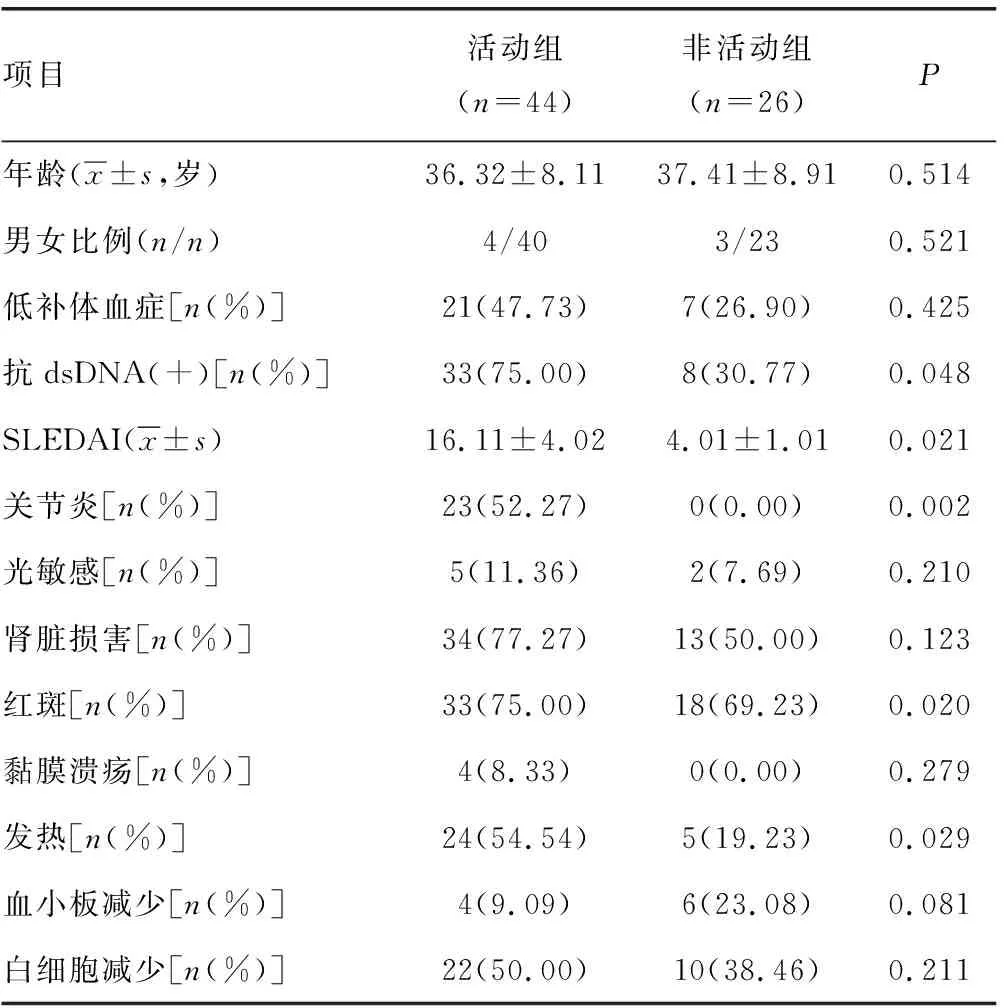
表1 活动组、非活动组一般资料比较
1.2方法 各组研究对象空腹采静脉血5 mL,1 500 r/min离心15 min,血清于-80 ℃放置待测。采用酶联免疫吸附试验(ELISA)检测HMGB1(参考区间:HMGB1≤0.2 ng/mL)、IFNα(参考区间:IFNα≤1.8 pg/mL),HMGB1、IFNα水平在参考区间以外范围即为异常。采用免疫磁珠法检测白细胞介素(IL)-1β、IL-2、IL-4、IL-5和IL-6,均依据试剂盒说明书进行检测。
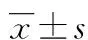
2 结 果
2.1各组IFNα、HMGB1及细胞因子水平比较 SLE组IFNα、HMGB1及细胞因子水平高于健康对照组,差异有统计学意义(P<0.05); SLE组IFNα、HMGB1、IL-2及IL-6与RA组比较,差异有统计学意义(P<0.05)。见表2。活动组IFNα、HMGB1、IL-6水平高于非活动组,差异有统计学意义(P<0.05),见表3。

表2 3组IFNα、HMGB1及细胞因子水平比较

表3 活动组与非活动组IFNα、HMGB1及细胞因子水平比较
2.2各指标间的相关性研究 HMGB1与IFNα呈正相关(r=0.76,P=0.012),HMGB1、IFNα与SLEDAI呈正相关(r=0.65,P=0.013;r=0.41,P=0.031);多元线性回归分析表明,HMGB1与细胞因子IL-1β、IL-4、IL-5相关(β=-0.07,P=0.011;β=0.03,P=0.021;β=-2.11,P=0.003),IFNα与IL-1β、IL-4相关(β=2.66,P=0.001;β=-1.21,P=0.003)。
2.3HMGB1异常、正常患者和IFNα异常、正常患者的SLE临床表现比较 HMGB1异常患者肾脏损害、发热占比与HMGB1正常患者比较,差异有统计学意义(P<0.05);IFNα异常患者关节炎、肾脏损害、发热占比与IFNα正常患者比较,差异有统计学意义(P<0.05)。见表4。
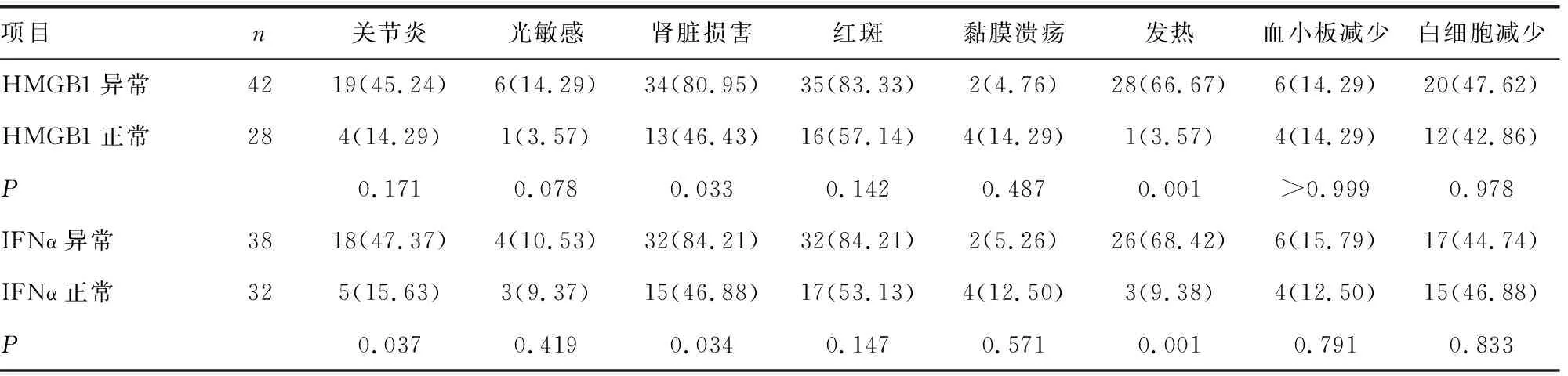
表4 HMGB1异常、正常患者和IFNα异常、正常患者的SLE临床表现比较 [n(%)]
2.4评估活动组与非活动组血清IFNα、HMGB1水平的试验效能 42例HMGB1异常患者中活动组患者为33例、非活动组患者为9例,28例HMGB1正常患者中活动组患者为11例、非活动组患者为17例;38例IFNα异常患者中活动组患者为32例、非活动组患者为6例,32例IFNα正常患者中活动组患者为12例,非活动组患者为20例。试验效能见表5。
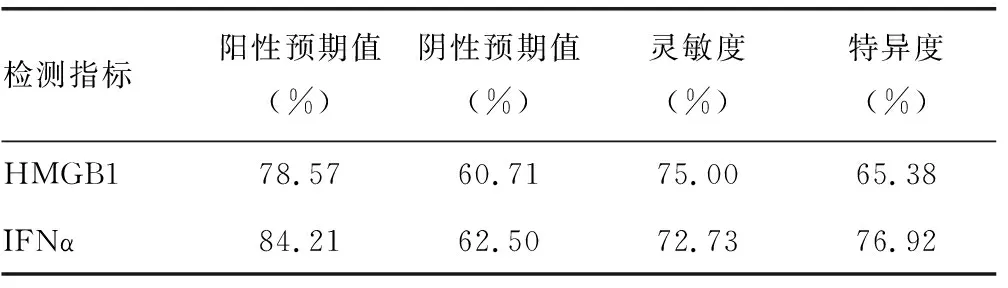
表5 SLE患者IFNα与HMGB1血清水平检测的阳性预期值、阴性预期值、灵敏度与特异度
3 讨 论
SLE 是一种自身免疫介导的累及多器官、多系统的弥漫性结缔组织病,其发病机制复杂,近年研究表明[6],Ⅰ型干扰素在SLE的发病中起重要作用。Ⅰ型干扰素是一种能够有效调控细胞分裂、免疫系统活化、抗病毒感染,并且能够抑制肿瘤生长的重要细胞因子。IFNα为其主要细胞因子,IFNα一般在病毒感染时由浆细胞样树突状细胞(pDC)产生,pDC也称为天然干扰素形成细胞,可产生大量IFNα[7]。在SLE患者中,pDC通过TLR诱导合成IFNα[8]。本研究发现,活动组IFNα、HMGB1、IL-6水平高于非活动组,差异有统计学意义(P<0.05)。QI等[9]研究发现狼疮肾炎小鼠模型的血清IFNɑ水平升高,而有研究者发现SLE相关关节炎小鼠的IFNɑ水平也升高[10],马元平等[11]报道IFNα治疗的不良反应之一就是发热。以上研究结果证实了SLE患者血清中增高的IFNα水平与SLE的疾病严重程度有关,提示血清IFNα水平的高低可能可以作为一种SLE的诊断标准。
HMGB1是存在于真核细胞核内的非组蛋白染色体结合蛋白[12]。据研究报道,HMGB1可通过活化pCD来启动SLE患者的自身免疫过程,其既是炎症的早期启动者(从部分坏死细胞的被动释放),也是炎症晚期的促进者(巨噬细胞主动分泌HMGB1),其不仅本身具有细胞因子样效应,而且可诱导巨噬细胞和中性粒细胞等产生更多炎症介质,进一步放大炎症[13]。本研究结果提示,血清HMGB1可作为评价SLE患者病情活动性的一个指标。本研究结果与文献[14]结果类似,FENG等[15]研究结果提示HMGB1参与了SLE的发病过程,而且与病情活动有关,认为HMGB1可能参与了SLE患者天然免疫激活,释放大量的免疫刺激因子,形成免疫复合物,并沉积在皮肤、肾等组织、器官的小血管床,引起皮肤、肾等靶器官损害。本研究通过对血清IFNα、HMGB1水平区分活动组与非活动组SLE患者的试验效能分析表明,二者能够较好地区分活动组与非活动组SLE患者,具有较好的灵敏度与特异度。
有研究报道,SLE患者血清促炎细胞因子IL-1β、IL-6和TNFa水平升高,且与疾病活动度相关[16],本研究中IL-6水平也有类似发现。本研究结果发现,IL-1β与HMGB1及IFNα相关,说明IL-1β可能由IFNα/HMGB1相关的免疫反应诱导产生;而且,Th2相关细胞因子IL-4、IL-5与 IFNα/HMGB1的相关性表明Th2相关的体液免疫反应与SLE发病密切相关。SLE是一种典型的自身免疫性疾病,SLE中有多克隆B细胞的活化增殖,进而增加了自身抗体的产生,但分泌自身抗体的多克隆B细胞的活化有赖于自身抗原的驱动和T细胞的辅助。T细胞异常在SLE发病中尤为重要。Th2型细胞因子水平增加,可扩大炎性反应,活化B细胞,导致大量的自身抗体产生[17]。
综上所述,IFNα、HMGB1参与了SLE的发生、发展,与疾病活动度及临床表现均相关。本研究从临床应用角度评估了IFNα/HMGB1区分活动组与非活动组SLE患者的试验效能,其应用前景尚需加大样本量做进一步的研究。
