高苯丙氨酸血症检测技术联合应用及家系基因研究*
2022-01-26李雨雨李洪俞王燕
李雨雨,许 佳,刘 娜,李洪俞,王燕,牟 凯
淄博市妇幼保健院医学遗传科,山东淄博 255000
高苯丙氨酸血症(HPA)是一种常染色体隐性单基因遗传病,主要分为两类:一类是由于苯丙氨酸羟化酶(PAH)缺乏导致的苯丙酮尿症(PKU)和轻度HPA,其中PKU最为常见;另一类是由于PAH的辅酶四氢生物蝶呤缺乏导致的四氢生物蝶呤缺乏症[1-3]。上述酶的缺陷会导致血液苯丙氨酸(Phe)代谢障碍和旁路毒性代谢产物积累,进而引发智力障碍、发育迟缓、运动失调、黑色素缺乏、癫痫等不同程度且不可逆损伤[4-5]。HPA患儿早期多无明显的临床症状,不同的疾病类型其诊断和治疗方法也不同。因此,不同HPA检测方法的联合应用有利于对疾病进行鉴别诊断和对症治疗。我国北方尤其是西北地区HPA发病率普遍高于南方,具有人群和地域差异性[5-6]。大多数HPA患儿是由于PAH基因突变所致,种类多样,区域分布不同。本研究通过对本院近3年新生儿足跟血Phe筛查情况进行回顾性分析,了解本地区HPA主要检测技术的联合应用、发病率及患儿家系基因变异等最新情况,为新生儿遗传代谢病筛查质量的提高、产前诊断、扩充基因突变谱及遗传咨询等提供参考依据。现将结果报道如下。
1 资料与方法
1.1一般资料 选取2018年1月至2020年12月在本院进行HPA筛查的128 997例新生儿作为研究对象,新生儿家属均已签署知情同意书。
1.2方法
1.2.1标本采集 按照《新生儿遗传代谢病筛查技术规范》要求,新生儿出生2~7 d并充分哺乳,最迟不超过出生后 20 d,采集足跟血滴于专用滤纸片上。血斑要求至少3个且直径均大于 8 mm,自然渗透无污染。血斑晾干后于 2~8 ℃冷藏,及时递送至淄博市医学遗传科新生儿疾病筛查中心。
1.2.2检测方法 荧光法:采用美国Perkin Elmer(PE)公司的全自动P9打孔仪,打取直径3.2 mm干血片于96孔U型板中,将PE公司的Phe测定试剂和样品微孔板装载入全自动免疫荧光分析仪(GSP)进行检测。串联质谱法:采用美国 Waters-TQ Detector 串联质谱仪、Waters 2777c 自动进样器、Waters 1525高效液相色谱泵,PE公司的非衍生化多种氨基酸、肉碱和琥珀酰丙酮测定试剂盒进行检测。打取3.2 mm干血片于96孔U型板中,每孔加入 100 μL 含氨基酸、肉碱和琥珀酰丙酮内标的萃取液,贴上封口膜。然后,45 ℃恒温振荡孵育45 min,吸取75 μL至96 孔V型板中,铝箔纸覆盖,琥珀酰丙酮衍生2 h后上机检测。基因检测:应用基因捕获配合高通量测序分析技术进行PAH基因检测,Sanger测序进行结果验证。
1.3结果判断 初筛阳性标本立即召回复查,复查结果仍为阳性者通过血串联质谱、尿气相-色谱质谱、尿蝶呤谱、红细胞二氢蝶啶还原酶测定、下一代测序技术(NGS)等相关检测进行诊断,一旦确诊为HPA患儿,由本院专家负责建档案统一管理,并进行治疗与随访。除四氢生物蝶呤缺乏症,按照血Phe浓度可分为经典型PKU(Phe≥1 200 μmol/L)、中度PKU(360~<1 200 μmol/L)、轻度HPA(120~<360 μmol/L)。
1.4质量控制 室内质量控制:每板均做低、高质控品进行质量监测,结果均在允许误差范围内发放报告。室间质评,本科室每年都会参加国家卫生健康委临床检验中心和美国疾病控制与预防中心的室间质量评价,成绩均合格。
2 结 果
2.1荧光法和串联质谱法在HPA检测中的应用 本科室利用GSP荧光法共检测128 997例新生儿足跟血Phe浓度,其中79 732例同时利用串联质谱法检测Phe浓度、Phe/酪氨酸(Tyr)比值和其他10种氨基酸及31种肉碱水平。两种检测方法均能有效检出11例确诊HPA患儿,均可用于新生儿HPA的筛查。2019年下半年,由于PE 公司GSP-Phe试剂盒生产工艺改变导致初筛阳性率明显降低,综合99.00%百分位数1.75和2018年度初筛阳性率1.10%,将GSP-Phe项目切值由2.00 mg/dL重设定为 1.70 mg/dL,2020年初筛阳性率为1.22%。见表1、2。

表1 2018-2020年Phe浓度百分位数(mg/dL)
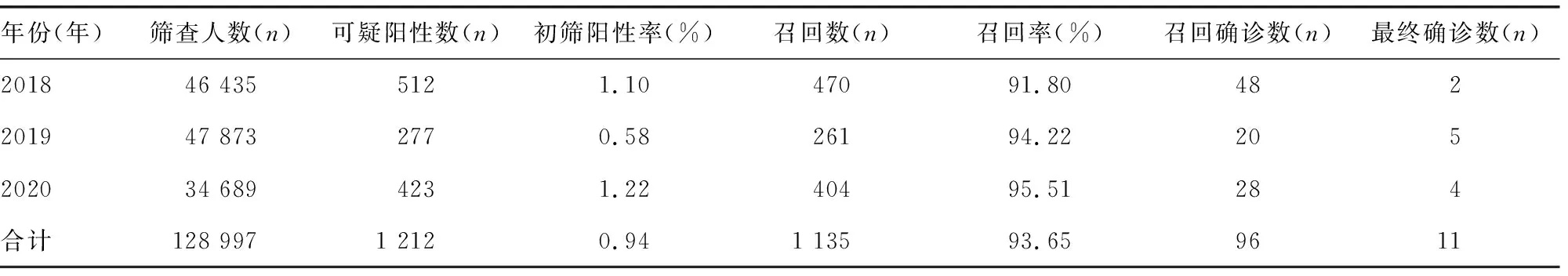
表2 2018-2020年新生儿HPA筛查情况
2.22018-2020年新生儿HPA筛查结果分析 鲁中地区近3年接受HPA筛查的128 997例新生儿,初次筛查可疑阳性数为1 212例,召回1 135例,召回率为93.65%。HPA最终确诊11例,其中PKU 9例,轻度HPA 2例,无四氢生物蝶呤。见表2。
2.3HPA患儿基因家系验证结果分析 11例HPA确诊患儿中有2例进行了高通量测序和Sanger测序变异位点的家系验证。先证者1 PAH基因检测出3个杂合变异,根据家系验证结果表明,明确致病变异c.842+2T>A和意义未明变异c.158G>A均遗传自父亲;意义未明变异c.155T>G遗传自母亲。其父亲、母亲、姐姐表型均正常,表明c.155T>G基因突变可能具有致病性,与c.842+2T>A致病变异组成PAH基因复合杂合突变,影响PAH基因功能,进而导致先证者1表现PKU。见表3。先证者2 PAH基因检测出两个杂合致病变异,致病变异c.728G>A来源于其父亲,致病变异c.740G>T来源于其母亲。其父亲、母亲表型均正常,先证者2来源于父母双方的两个致病变异组成PAH基因复合杂合突变,进而表现出PKU。见表4。
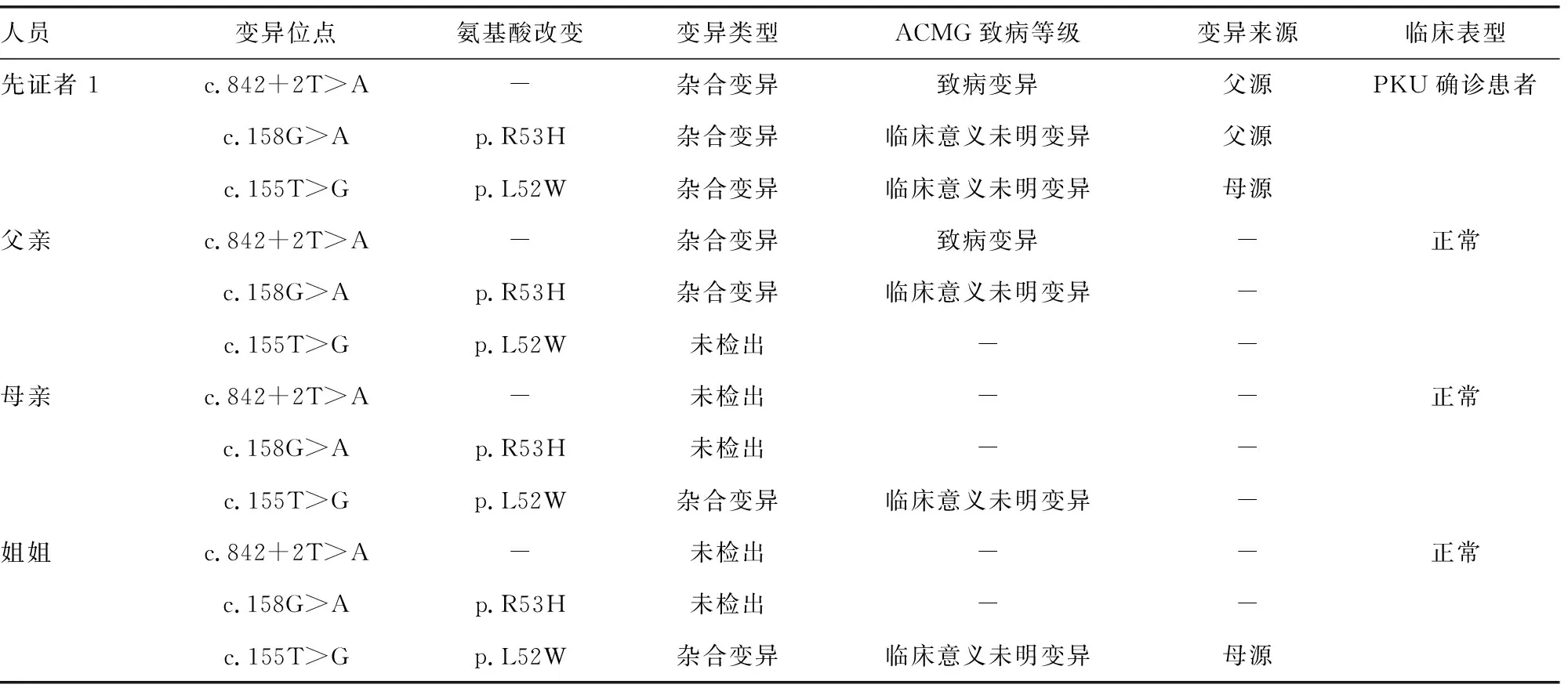
表3 先证者1 PAH基因变异验证结果
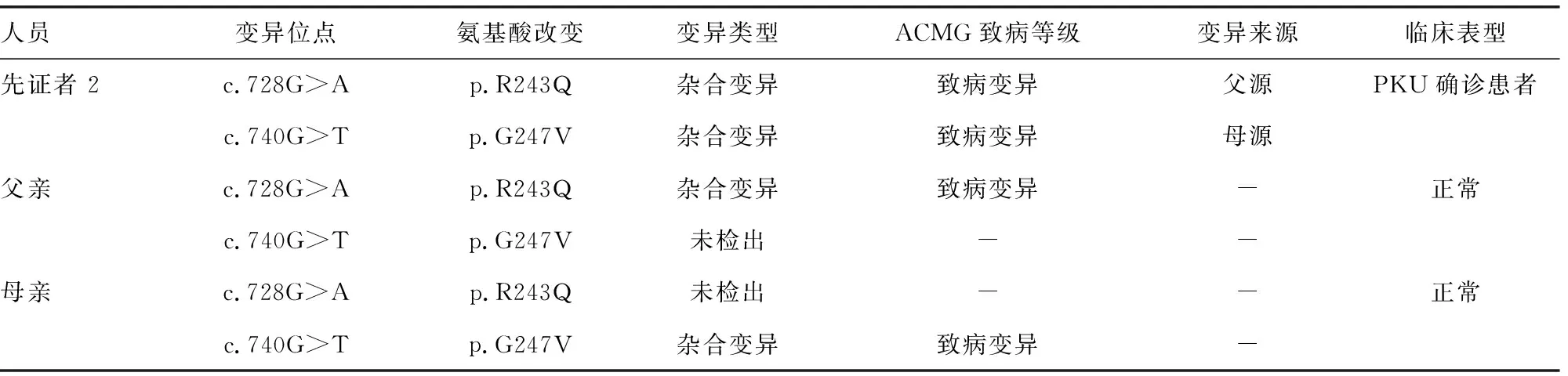
表4 先证者2 PAH基因变异验证结果
3 讨 论
HPA是一种常见的常染色体隐性遗传代谢病,可通过检测新生儿足跟血Phe浓度达到早筛查、早诊断、早治疗,避免神经系统等不可逆损伤。常采用的HPA检测方法有荧光法、串联质谱法、基因测序等,通过不同检测方法的联合应用,使得HPA疾病研究更为透彻深入,更有利于疾病的早期诊断。不同国家和地区HPA发病率不同,具有明显的人群和地域差异性,了解HPA发病率和分子流行病学特征可为本地区HPA诊断、治疗提供参考依据[7-9]。在HPA中PKU发病率较高,轻度HPA较少,PAH基因复合杂合变异或纯合变异是PKU重要的致病因素,其中76%PKU患者具有PAH基因复合杂合变异,纯和变异较少[10]。目前,国内外数据库收录的PAH 基因变异达1 000多种,但其基因型与表型相关性也较为复杂,尚需继续进行该临床数据和功能机制的收集与研究[11-12]。
本研究采用荧光法、串联质谱法检测新生儿足跟血Phe浓度来进行HPA筛查。不同HPA检测方法因仪器、实验原理、试剂工艺和厂家等不同,具有不同的参考范围。因此,不同地区、不同实验室应建立并适时调整符合自身的切值范围,避免HPA患儿的漏筛和假阳性率过高等[13]。2019年下半年,本研究发现因GSP-Phe试剂盒生产工艺改变,初筛阳性率明显降低。综合分析后将切值由2.00 mg/dL重设定为 1.70 mg/dL,同时利用串联质谱法检测近期Phe浓度处于临界范围的标本,未发现患儿漏筛。本地区近3年HPA确诊患儿11例,发病率与文献[3,14]结果基本一致,高于文献[15]的结果。其中2例PKU患儿通过基因检测和家系验证结果发现:PAH基因变异为复合杂合变异;PAH致病变异c.842+2T>A,c.728G>A,c.740G>T和意义未明变异c.158G>A在中国比较常见[16];PAH c.155T>G变异为新发变异,文献鲜少报道。家系验证结果表明PAH c.155T>G很可能具有致病性,这对于生化表型不明显患者、疾病鉴别诊断、再生育的遗传咨询等具有重要意义,有利于丰富PKU基因型和表型相关性数据库。本研究不足之处在于家系分析标本较少,应加大HPA确诊患儿家系验证标本量,明确致病基因变异,提高遗传咨询、出生缺陷防控能力。
随着分子检测技术的发展,NGS在新生儿遗传代谢病中的应用越来越广泛,对于生化检测和串联质谱不能明确分型、不能筛查的疾病更具优势[17]。但是,NGS中的靶基因测序和全外显子测序可检出大量基因突变位点,报告解读需结合生化和串联质谱等检测结果,综合分析基因型和表型相关性。尤其对于致病突变不明确的,通过基因检测其家系基因变异情况,更有利于疾病的追根溯源,实现早诊断、早治疗。
本项目创新之处在于探讨了HPA检测技术的联合应用及其存在的相关问题,以及家系基因的发现和新发变异PAH c.155T>G为致病变异。目前,有研究报道中国人群中有100多种PAH基因变异,但未发现此类型变异[18-19]。通过不断累积PAH新发变异,可进一步扩充PAH基因变异及致病性的数据量,有助于分子诊断报告的解读。
综上所述,本研究系统分析了近3年HPA筛查应用情况,荧光法、串联质谱法、分子检测相结合将是本地区新生儿HPA筛查的有效策略。综合分析HPA发病率、家系基因验证等最近相关数据,可进一步为新生儿遗传代谢病筛查、诊治和遗传咨询等提供相关参考依据。
