低钠条件下pH值对肌原纤维蛋白乳化性能的影响
2022-01-26李子晗费子璇张瑞丽王思珍倪娜
李子晗,费子璇,张瑞丽,王思珍,,倪娜
农产品贮藏与加工
低钠条件下pH值对肌原纤维蛋白乳化性能的影响
李子晗a,费子璇b,张瑞丽b,王思珍a,b,倪娜b
(内蒙古民族大学 a.动物科技学院 b.生命科学与食品学院,内蒙古 通辽 028000)
研究不同钠离子强度下pH值对羊肉肌原纤维蛋白乳化性能的影响,为低盐肉制品的研发提供理论参考。将羊肉肌原纤维蛋白与植物油混合匀浆得到乳状液,研究高钠(0.6 mol/L NaCl)与低钠(0.3 mol/L NaCl)条件下pH值对羊肉肌原纤维蛋白的乳化活性、乳化稳定性、分层指数、粘度、微观结构、粒径、Zeta电位等指标的影响。在高钠和低钠条件下,随着pH值的升高,肌原纤维蛋白乳状液的乳化活性指数、粘度均呈先减小后增大的趋势(<0.05);乳化稳定性指数、分层指数、Zeta电位等指标分析结果显示,随着pH值的升高,乳状液体系的稳定性均显著增加(<0.05);表观指标、微观结构和粒径分布分析结果显示,在低钠条件下(pH值为8.0)肌原纤维蛋白乳状液的乳化状态与高钠条件下pH值为7.0~8.0时最为接近。可在低钠条件下选择较高的pH值,以提高羊肉肌原纤维蛋白的乳化性能。
羊肉;肌原纤维蛋白;高钠;低钠;乳化性
近年来乳化型肉制品的消费量增长迅速,深受城乡居民喜爱。肉制品加工中通常需要添加较高含量的食盐(NaCl)以赋予产品咸味特征,抑制微生物引起的肉品腐败,并促进原料肉中肌原纤维蛋白的解离和溶出,发挥其乳化、凝胶特性,使肉制品获得独特的质地、口感和贮藏性[1—2]。食物中较高的盐含量很容易导致钠摄入量过高,若长期摄入会提高患高血压、心脏病,以及其他心脑血管疾病的风险[3—5]。对于肉制品而言,较高含量的NaCl还可促进冷藏过程中的肌原纤维蛋白氧化,改变蛋白质结构及功能特性,影响肉制品贮藏后的食用品质[2]。随着人们生活质量的提高和健康意识的加强,低盐肉制品已成为新的研究热点。Horita等[6]研究发现,添加KCl最多可替代法兰克福香肠中约1/3的NaCl。Gelabert等[7]研究发现,复合盐可替代发酵香肠中40%的NaCl;复合磷酸盐也可将牛肉饼中的含盐量降至1.5%[8]。
要降低肉制品中食盐的含量,需要找到可以全部或部分替代食盐功效的物质,完成食盐在加工中的作用[9]。乳化性作为蛋白质的一种重要加工性质,间接决定了食品的质地和外部感官特性,稳定的乳化体系无疑是乳化型肉制品的基本要求之一。蛋白质乳化性指在一定条件下蛋白质所能乳化的脂肪量,乳化活性(EAI)和乳化稳定性(ESI)是研究乳化性的重要指标[10]。乳化活性是蛋白质与蛋白质之间,或者蛋白质与脂肪之间的相互作用[11],乳化稳定性指乳化剂能使乳状液在各种条件下保持乳化状态稳定的能力[12—13]。乳化性受蛋白质自身理化性质的影响,包括蛋白质的分子构象、溶解性、表面疏水性等[14—16],此外,还受外界环境因素的影响,如蛋白质浓度、温度、pH值、离子强度、油相体积分数等[17—22]。
在降低食盐含量后的低离子强度条件下,能否通过调整pH值,以获得高离子强度下的蛋白质乳化性能,国内外鲜有报道。文中以羊肉肌原纤维蛋白为研究对象,通过测定其乳状液的乳化活性、乳化稳定性、粘度、分层指数等,研究高钠与低钠条件下pH值对肌原纤维蛋白乳化性能的影响,以期为低盐乳化型肉制品的加工与贮藏提供理论参考。
1 实验
1.1 材料与仪器
主要材料:新鲜羊肉,购自通辽市润泰商贸有限公司,选用羊背最长肌,剔除可见脂肪和结缔组织,切成小块,用料理机搅碎,置于−18 ℃冰箱备用。其他试剂均为分析纯。
主要仪器:FE20K,酸度计,梅特勒-托利多;XSP-2C型,显微镜,上海精仪;T6,新世纪型紫外可见分光光度计,北京普析通用;NDJ-8S型,数字式粘度计,上海精天仪器;3K-15型,高速冷冻离心机,德国西格玛;Zetasizer Nano ZS90型,纳米粒度电位仪,英国马尔文;T25型,高速分散机,德国IKA。
1.2 方法
1.2.1 乳状液样品的制备
参考NI等[23]的方法提取羊肉肌原纤维蛋白,将得到的肌原纤维蛋白在温度为4 ℃条件下保存,3 d内用完。采用双缩脲法测定肌原纤维蛋白浓度,用50 mmol/L PBS缓冲液将蛋白浓度稀释至10 mg/mL,用1 mol/L HCl和1 mol/L NaOH调整pH值为5.0,6.0,7.0,8.0,调整离子强度分别至0.3 mol/L NaCl(简称低钠)和0.6 mol/L NaCl(简称高钠)。参照叶凤凌等[24]的方法并稍做修改,将蛋白质溶液与植物油按体积比为4∶1混合,并于14 500 r/min下匀浆90 s,得到的乳状液用于相关指标测定。
1.2.2 乳化活性和乳化稳定性指数的测定
参照叶凤凌[24]和李丹丹[25]等的方法,并稍做改动,将制备好的乳状液样品从底部取50 μL,用5 mL 质量分数为0.1% 的SDS稀释,测定500 nm下的吸光度,乳化活性值的计算见式(1)。将乳状液静置10 min,测定500 nm下的吸光度,乳化稳定性值的计算见式(2)。
(1)
式中:0为静置前吸光度;为肌原纤维蛋白浓度(g/mL);为乳状液中油所占的体积分数。
(2)
式中:Δ为静置前与静置10 min后吸光度值的差。
1.2.3 乳状液分层指数的测定
将制备好的乳状液置于量筒,待乳状液分层后分别测量样品下侧清液层的高度,乳状液分层指数的计算见式(3)[26]。
(3)
1.2.4 乳状液粘度的测定
在温度为25 ℃下使用粘度计测定,吸取7 mL刚制备好的乳状液置于25 mL小烧杯中,粘度计转速为30 r/min(最大量程为200 r/min)时测定。
1.2.5 乳状液的微观形态结构
从乳状液底部迅速吸取适量乳状液在载玻片上均匀涂抹,在温度为4 ℃下冷却1 d后,用质量分数为0.5%的苏丹红溶液染色,静置1 min,用蒸馏水冲掉载玻片表面多余的染液,再用质量分数为1%的溴酚蓝溶液染色1 min,冲洗后在光学显微镜下观察微观结构并拍照。
1.2.6 Zeta电位和粒径的测定
采用马尔文激光粒度仪测定Zeta电位和粒径,将pH值、离子强度处理下的磷酸缓冲液作为空白分散剂。
1.3 数据分析
采用SPSS 22.0软件进行统计分析,用ANOVA进行方差分析,LSD进行显著性检验(< 0.05),使用Origin 2019绘图。
2 结果与分析
2.1 不同钠离子浓度下pH值对羊肉肌原纤维蛋白乳化活性的影响
在高钠条件下,肌原纤维蛋白乳状液的乳化活性指数随着pH值的上升先减小后增大,见图1。pH值为5.0时,乳化活性指数为最大值;当pH值继续增加,乳化活性指数呈下降趋势;pH值为7.0时,乳化活性指数最小;pH值为6.0~7.0时,差异不显著(> 0.05);pH值继续升高至8.0时,乳化活性指数有所回升;pH值为7.0~8.0时,差异显著(< 0.05)。在低钠条件下,肌原纤维蛋白乳状液的乳化活性指数随着pH值的上升也呈现先减小后增大的趋势,pH值为6.0时,乳化活性指数最小,且pH值为5.0,7.0,8.0时,差异不显著(> 0.05)。比较2种钠离子浓度下乳状液乳化活性的变化趋势,可以发现2种钠离子浓度在pH值为7.0和8.0时,乳化活性指数最为接近,且2种钠离子浓度间无显著差异(> 0.05)。
高钠与低钠条件下,乳化活性随pH值的变化趋势总体相似。pH值为5.0时,肌原纤维蛋白正处于其等电点附近,蛋白质表面不带电荷或仅带少量电荷,其主要作用力表现为疏水相互作用,蛋白质疏水基团暴露在外,增加了蛋白质分子的脂肪吸附能力,改善了体系的乳化性能[23, 27]。与陆健康等[28]的研究结果相似,高钠条件下羊肉肌原纤维蛋白的乳化活性指数最高值均出现在pH值为5.0。当pH值升高后,乳化活性指数均不同程度地下降,这可能与偏离等电点时蛋白质所带的负电荷有关,当静电斥力占主导,而疏水相互作用逐渐减弱,降低了蛋白质的油脂结合能力。当pH值继续升高时,溶液pH值距离等电点越远,蛋白质所带的静电荷越高,静电排斥作用进一步增加,蛋白质分子分散性变好,乳化性能有所提 升[27]。在高pH值条件下,与pH值对肌原纤维蛋白乳化体系的作用相比,离子强度的差异对体系影响不大,高钠和低钠条件下的乳化活性指数非常接近。虽然离子强度升高也能够引起蛋白质所带负电荷增加、溶解度增大等作用[28],但其可能对疏水相互作用影响不大,或对蛋白质与脂肪间的相互作用无明显改善,因此未能导致其乳化活性发生显著变化。

注:图1—5,8中不同大写字母表示高钠条件下各处理组之间差异显著(P<0.05);不同小写字母表示低钠条件下各处理组之间差异显著(P<0.05)
2.2 不同钠离子浓度下pH值对羊肉肌原纤维蛋白乳化稳定性的影响
在高钠条件下,肌原纤维蛋白乳状液的乳化稳定性随pH值的升高而增加,当pH值为5.0时,乳化稳定指数最低;pH值为8.0时,乳化稳定性指数最大;且pH值为5.0,6.0,7.0时,差异显著(0.05);pH值为7.0~ 8.0时,差异不显著(0.05),见图2。在低钠条件下,pH值由5.0升至8.0的过程中,乳状液的乳化稳定性总体也呈上升趋势;pH值为5.0~6.0时,差异不显著(0.05);而后pH值上升,乳化稳定性显著增加(0.05),至pH值为8.0时乳化稳定性最高;pH值为7.0~8.0时,差异不显著(0.05)。2种不同钠离子浓度条件下,pH值为5.0时,两者的乳化稳定性指数最为接近,与低钠条件下pH值为6.0的处理相比,三者间差异也不显著(> 0.05);pH值为7.0时,2种钠离子浓度下的乳化稳定性也无显著差异(> 0.05);而pH值为8.0时,低钠样品的乳化稳定性显著高于高钠样品 (0.05)。
高钠与低钠条件下,乳化稳定性随pH值的变化趋势与乳化活性相似,当pH值远离等电点时,乳化稳定性也呈现上升趋势。蛋白质作为乳化剂,变性后可被吸附在油滴界面形成单分子薄膜,其亲水性残基指向水相,而疏水性氨基酸残基亲油相,从而形成稳定的O/W型乳状液。pH值可通过引起蛋白质表面净电荷的变化,改变溶解度的大小,从而引起乳化性能的变化[29]。pH值为5.0和6.0时,肌原纤维蛋白正处于等电点附近。此时,蛋白质分子周围的净电荷很少甚至为0,蛋白质溶解度极低,O/W界面处吸附的蛋白质变少,稳定界面的薄膜易受破坏,油滴之间容易互相聚集,甚至发生合并,且此时蛋白质分子间的静电相互作用降低,因而不能通过静电排斥作用阻止油滴发生聚集,使得乳状液的稳定性难以维持[28—29];当pH值升高至远离等电点时,蛋白质分子表面所带的负电荷密度增加,静电排斥作用增强,同时更多的蛋白质被吸附到O/W界面处,并层层堆积在油滴外,结构紧密,致使油滴聚集难度增加,防止了合并作用的发生,乳状液更加稳定[29]。此时低钠条件下的乳化稳定性更好,这是由于当离子强度增加(高钠条件)时,高pH值乳状液中液滴上的净电荷减少,蛋白质因盐析作用趋于聚集(溶解度降低),絮凝使乳状液失稳[30]。

图2 高钠与低钠条件下pH值对肌原纤维蛋白乳化稳定性指数的影响
2.3 不同钠离子浓度下pH值对肌原纤维蛋白乳状液分层指数的影响
由于O/W型乳状液中水相与油相间存在密度差,在其储存过程中会发生油滴上浮,即乳状液出现分层现象。分层指数是反映乳状液中液滴聚集程度的非直接指标,表示液滴在一段时间内对抗重力分离的稳定性,其值越小,乳状液越稳定[31]。储存72 h后的乳状液分层情况见图3。在高钠条件下,pH值为5.0时,储存后的肌原纤维蛋白乳状液分层较为明显,且在储存过程中可观察到下层清液中有絮状物;当pH值由6.0升至8.0时,乳状液不再分层,即差异不显著(0.05)。在低钠条件下,pH值为5.0时,储存后的乳状液分层相对严重,分层指数比高钠条件下(pH值为5.0)乳状液的分层指数略低;pH值为6.0时,分层指数较pH值为5.0时进一步降低(<0.05);pH值为7.0时,乳状液分层指数为0,即不再分层;pH值为7.0~8.0时,差异不显著(0.05)。
分层指数所反映的肌原纤维蛋白乳状液的体系稳定性与2.2节中乳化稳定性指数的变化趋势基本一致,由于分层指数测定时静置时间更长,因而可观察到等电点下蛋白质的聚沉现象。乳状液的分层现象不仅与液滴絮凝状态有关,还取决于分离或絮凝的液滴间的相互吸引作用[32],pH值远离等电点时,乳状液中蛋白质表面所带的负电荷密度增加,静电排斥作用增强,油滴不易发生聚集。乳状液的分层现象还与界面膜厚度有关[31],当pH值远离等电点时,更多的蛋白质被吸附到液滴界面处,使界面膜结构更加稳定,界面活性增加,扩散能力增强,可有效地防止油滴聚集,从而减弱分层作用[33]。
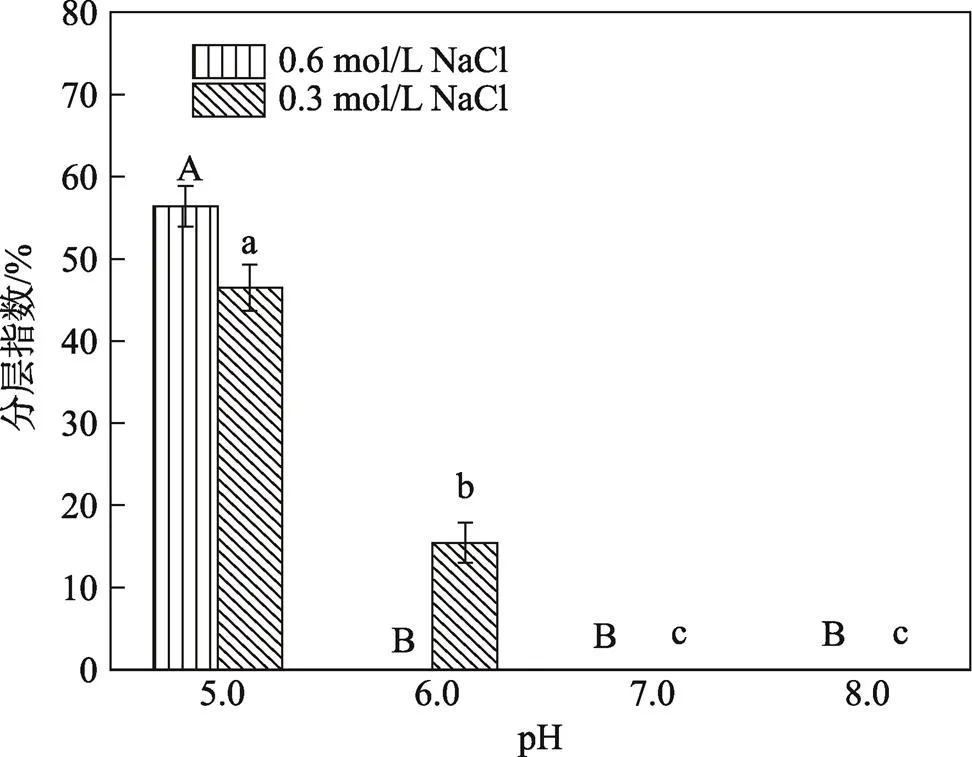
图3 高钠与低钠条件下pH值对肌原纤维蛋白分层指数的影响
2.4 不同钠离子浓度下pH值对肌原纤维蛋白乳状液粘度的影响
连续相的粘度是影响乳状液稳定性的重要因素。在高钠条件下,肌原纤维蛋白乳状液的粘度呈先上升后下降的趋势,在pH值为6.0时,乳状液粘度达到最大值;pH值为6.0~ 7.0时,差异不显著(>0.05);pH值为8.0时,乳状液粘度显著下降(0.05),见图4。在低钠条件下,pH值为5.0~8.0的过程中,乳状液粘度也呈先上升后下降的趋势;pH值为7.0时,粘度达到最大值,且各pH值间差异显著(0.05)。粘度随pH值的变化趋势与罗永康等[34]对鲢鱼肌原纤维蛋白粘度的研究结果相似,当pH低于7.18时,pH值与粘度之间呈正相关,而pH值高于7.18时,则呈负相关。前期粘度随pH值升高而增加,pH值5.0位于肌原纤维蛋白等电点附近,溶解度最低,当值pH逐渐偏离等电点时,蛋白质所带同种电荷越多,越不易聚集[34];后期pH值增加而粘度降低,推测是高pH值下蛋白质被大量吸附于液滴界面处,从而导致连续相中蛋白质浓度降低,粘度下降。
从2种钠离子浓度下不同pH值所对应的乳状液粘度来看,总体上高钠条件下的乳状液粘度要高于低钠条件。这与罗永康等[34]的研究结果相似,离子强度较低时肌原纤维蛋白溶液粘度也较低。这是由于肌原纤维蛋白是盐溶性蛋白,在低离子强度下溶解度较低[35],且离子强度不同时,肌原纤维蛋白分子的排列方式也有差异,低离子强度下肌球蛋白常以细丝状形态存在,而离子强度增加到一定浓度时,肌球蛋白分子常以单体形式存在,从而造成粘度下降。
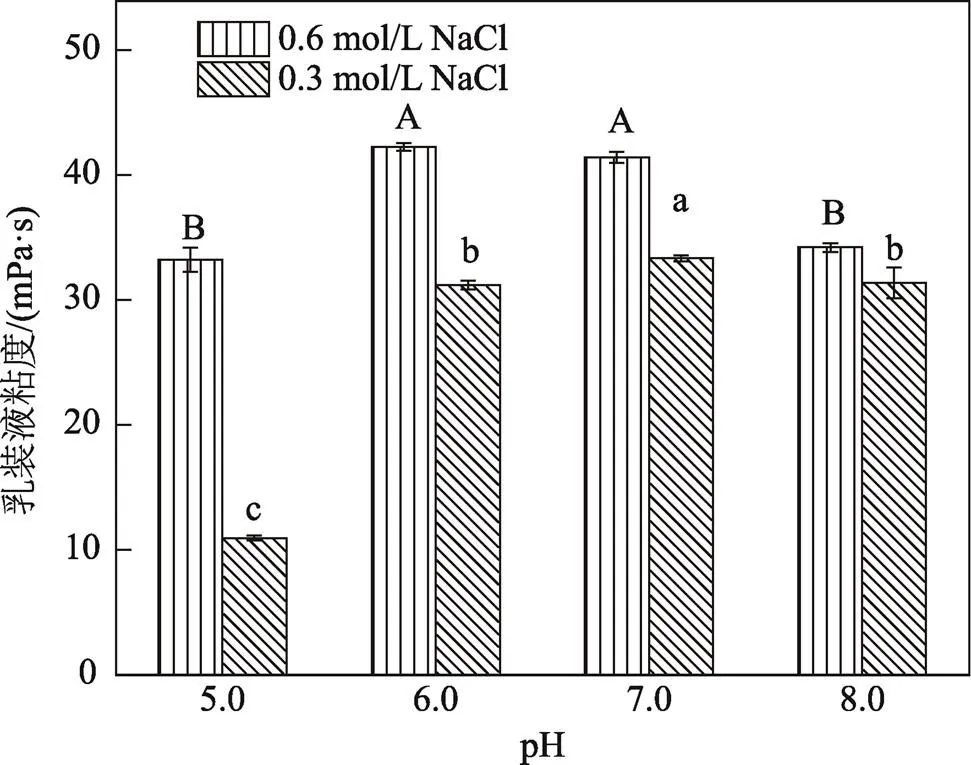
图4 高钠与低钠条件下pH值对肌原纤维蛋白乳状液粘度的影响
2.5 不同钠离子浓度下pH值对肌原纤维蛋白乳状液Zeta电位的影响
Zeta电位是表征胶体分散体系稳定性的重要指标之一,也是颗粒间斥力或引力强度的度量指标之一。不同钠离子浓度下pH值对肌原纤维乳状液Zeta电位的影响见图5。蛋白质包裹的液滴表面电荷受其分子中氨基与羧基的电离度控制,在所有乳状液样品中,Zeta电位均为负值,这表明其蛋白质表面带负电的基团多于带正电的基团[36]。在高钠与低钠条件下,Zeta电位值随pH值增加均呈上升趋势(<0.05)。pH值的变化改变了蛋白质表面基团的暴露状况,影响了蛋白质表面正电荷和负电荷之间的平衡,从而改变了表面电荷电位[37—38]。Zeta电位越高,表明乳状液体系的物理稳定性越稳定,此时体系中静电排斥力起主要作用,不易发生聚沉[39],这与2.2节中乳化稳定性随pH值升高而增加的结果相吻合。
与高钠条件相比,低钠条件下肌原纤维蛋白乳状液Zeta电位的绝对值总体略高,这与周扬等[40]的研究结果相似,可能是由于静电屏蔽或离子结合作用[41]。盐离子的添加可能对蛋白分子表面扩散双电层产生压缩作用,在高盐溶液中肌原纤维蛋白分子与油相液滴产生静电屏蔽或离子结合作用,降低了油滴间的排斥力[42]。

图5 高钠与低钠条件下pH值对肌原纤维蛋白乳状液Zeta电位的影响
2.6 不同钠离子浓度下pH值对肌原纤维蛋白乳状液微观结构的影响
在高钠条件下,pH值为5.0时,视野中油滴很少,且零散地分布在体系中;pH值为6.0时,油滴数量增多、颗粒较大,且不规则,但已经表现出较为紧凑的排布;pH值为7.0时,乳状液体系中可见油滴均匀的排布,且规则、紧凑;当pH值为8.0时,油滴已相当紧密地排列在乳状液体系中,且形状非常规则、均匀,说明形成了稳定的水包油结构,见图6。在低钠条件下,pH值为5.0和6.0时,可观察到肌原纤维蛋白乳状液中油滴的大小不均、形状不规则,数量也较为稀少,零散、凌乱地分布在体系中,可见其未能形成相对稳定的乳化体系;pH值为7.0时,油滴呈现一定的紧密排列结构,但略不规则;当pH值为8.0时,乳状液中油滴呈现出清晰紧密的排列,形成了明显的水包油结构,乳状液的稳定性相对较好。综上所述,pH值相同时,低钠条件下油滴的分散比高钠条件下更为不规则;当pH值较高时,2种不同钠离子浓度下观察到的体系微观结构最为接近。这与图2所显示的乳状液稳定性随pH值的变化趋势基本一致。
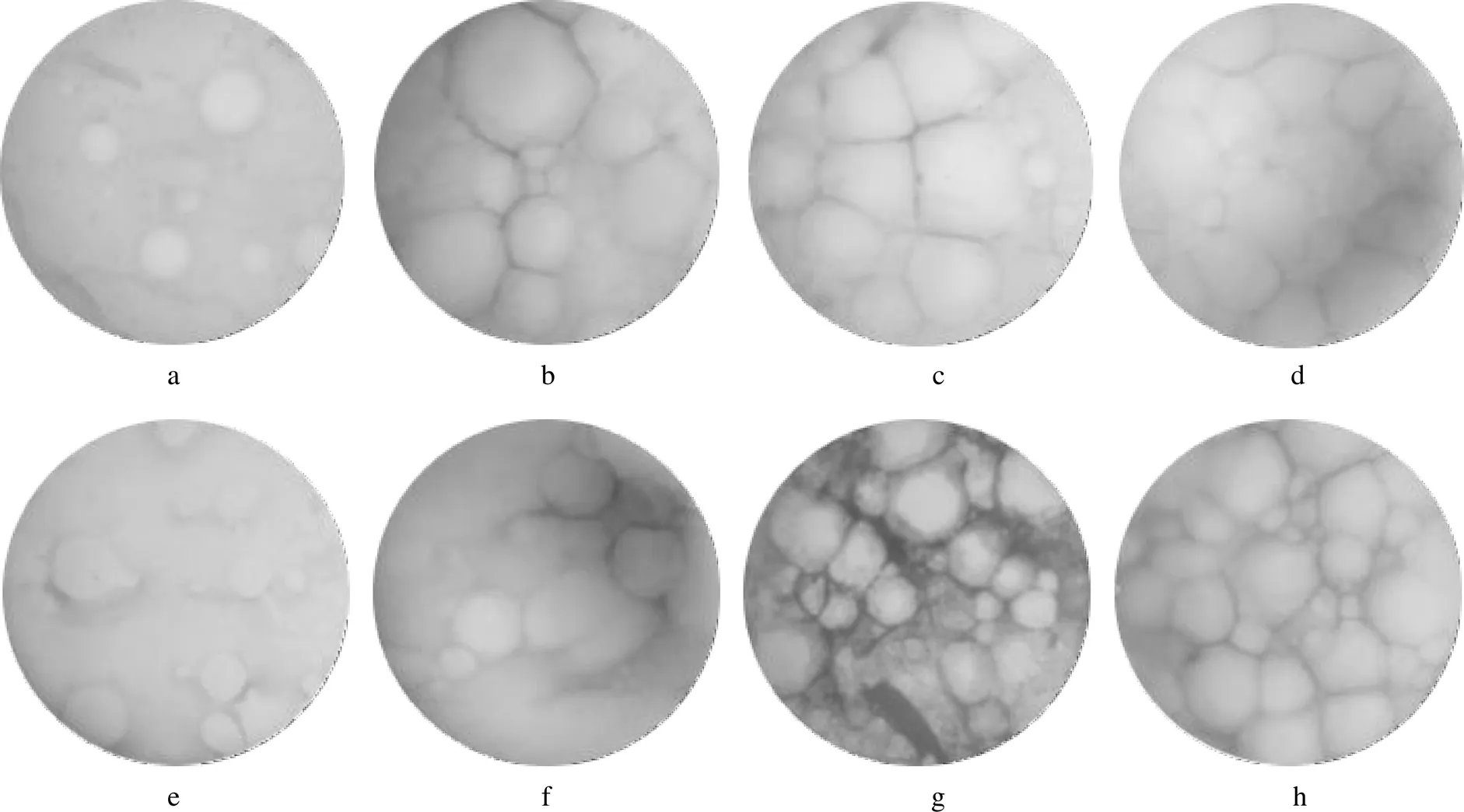
注:a—d表示高钠条件下pH值分别为5.0,6.0,7.0和8.0的肌原纤维蛋白乳状液; e—h表示低钠条件下pH值分别为5.0,6.0,7.0和8.0的肌原纤维蛋白乳状液
比较2种不同离子强度下乳状液的微观结构,可以发现近等电点的乳化体系中油滴较为分散,甚至有些许蛋白质聚集体出现,而远离等电点时油滴在体系中的排列较为规则、紧密,油滴周围包裹的蛋白质层也较为均匀。在等电点附近时,因蛋白质所带净电荷几乎为0,溶解度较低且有聚集倾向,不能形成较为稳定的界面膜,所以乳状液的稳定性不佳,使得乳化体系中的油相在短时间内分离[26],在显微镜视野内观察到的油滴数量不多。
2.7 不同钠离子浓度下pH值对肌原纤维蛋白乳状液粒径的影响
粒径分析是对肌原纤维蛋白乳化体系中液滴大小及分布情况进行测定。乳化体系形成后,乳化剂吸附在油水界面,稳定液滴使其不发生聚集,根据粒径大小可评价其乳化能力[43]。在高钠或低钠条件下,不同pH值的肌原纤维蛋白乳状液中液滴粒径分布情况和平均粒径分别见图7—8。在高钠条件下(见图7a),pH值为5.0~7.0时乳状液中的微粒呈双峰分布,包括1个主峰和1个从属的肩峰。随着pH值升高,各样品粒径分布曲线有向右偏移的趋势,且乳状液中微粒粒径范围逐渐变窄,分布更加集中,至pH值8.0时仅剩1个窄而高的单峰,表明乳状液颗粒大小更加均匀,这与图6中所示的微粒变化情况相吻合。在低钠条件下(见图7b),所有pH值乳状液中的微粒均呈现双峰分布,包括1个主峰和1个从属的肩峰;与高低条件相比,各肩峰的峰高、峰宽更大,粒度分布范围也较广,因此低钠条件下所有处理的平均粒径更小,这与图8中所示的平均粒径结果一致。随着pH值升高,各样品粒径分布曲线也呈现向右偏移趋势,pH值为8.0时可观察到肩峰的明显缩小,以及主峰高度增加、宽度下降,乳状液颗粒的粒径分布更加均匀。
在高钠条件下,对于肌原纤维蛋白乳化体系中的微粒平均粒径,不同pH值间差异均显著(< 0.05),并随pH值升高整体呈先降低后升高的趋势,pH值为8.0时平均粒径值最大,pH值为6.0时最小,见图8。在低钠条件下,随着pH值升高,各处理的平均粒径整体呈升高趋势,其中pH 值为8.0时比pH值为7.0时略有下降,但两者间差异不显著(> 0.05)。相较于低钠条件下的肌原纤维蛋白乳液微粒而言,高钠条件下的平均粒径值均较高,这与Ettoumi的结果相似[30]。与高钠条件相比,低钠条件下(pH值为8.0时)肌原纤维蛋白乳化微粒的粒径更为细小,这与图6所示的微观结构观察结果一致,低离子强度下液滴间的静电排斥作用较强,液滴粒径较小可防止其聚集[44],因而增加了乳化体系的稳定性,这与2.2节中的结果相吻合;当pH值高时,高离子浓度反而使液滴上的净电荷减少,乳化颗粒捕获合并,导致液滴粒径较大,使乳状液稳定性有所降低[30]。

图7 高钠与低钠条件下pH值对肌原纤维蛋白乳状液粒径分布的影响

图8 高钠与低钠条件下pH值对肌原纤维蛋白乳状液粒径的影响
3 结语
在高钠与低钠条件下,随着pH值升高,肌原纤维蛋白乳状液的乳化活性指数、粘度均呈先减小后增大的趋势;乳化稳定性指数、分层指数、Zeta电位等指标分析显示,随着pH值升高,乳状液体系的稳定性均逐渐增加。表观指标、微观结构与粒径分布分析结果显示,低钠条件下pH值为8.0时,肌原纤维蛋白乳状液的乳化状态与高钠条件下pH值为7.0~8.0时最为接近。可使用在低钠条件下适当调高乳状液pH值的方法,来调控乳状液中肌原纤维蛋白分子表面的荷电状况,通过静电排斥作用改变乳状液中油滴的聚集与稳定情况,以获得较好的蛋白质乳化性能。文中研究为低盐乳化型肉制品的生产实践提供了理论参考,适当调高低盐肉制品的pH值,不仅可以降低肉制品中的钠摄入量,还具有解决低盐乳化型肉制品加工与贮藏过程中出油、出水等问题的潜力,但是提高pH值是否对肉制品的贮藏性产生影响,还值得开展进一步的探讨。
[1] GROSSI A, SØLTOFT-JENSEN J, KNUDSEN C J, et al. Reduction of Salt in Pork Sausages by the Addition of Carrot Fibre or Potato Starch and High Pressure Treatment[J]. Meat Science, 2012, 92(4): 481-489.
[2] 赵亚南, 张牧焓, 王道营, 等. 氯化钠对鸡肉冷藏过程中肌原纤维蛋白氧化的影响[J]. 肉类研究, 2020, 34(8): 1-7.
ZHAO Ya-nan, ZHANG Mu-han, WANG Dao-ying, et al. Effects of Sodium Chloride on Myofibrillar Protein Oxidation during Cold Storage of Chicken Meat[J]. Meat Research, 2020, 92(4): 481-489.
[3] 文依娜. 食盐对心脏健康的影响[J]. 心血管病防治知识(科普版), 2012(4): 35-36.
WEN Yi-na. The Effect of Salt on Heart Health[J]. Prevention and Treatment of Cardiovascular Disease, 2012(4): 35-36.
[4] 马冠生, 周琴, 胡小琪, 等. 我国居民食盐消费量与血压水平关系研究[J]. 中国慢性病预防与控制, 2008, 16(5): 441-444.
MA Guan-sheng, ZHOU Qin, HU Xiao-qi, et al. Relationship between Salt Consumption and Hypertension in Chinese People[J]. Chinese Journal of Prevention and Control of Chronic Diseases, 2008, 16(5): 441-444.
[5] 郭秀云, 张雅玮, 彭增起. 食盐减控研究进展[J]. 食品科学, 2012, 33(21): 374-378.
GUO Xiu-yun, ZHANG Ya-wei, PENG Zeng-qi. Research Progresses in Reduction and Control of Salt Intake[J]. Food Science, 2012, 33(21): 374-378.
[6] HORITA C N, MORGANO M A, CELEGHINI R M S, et al. Physico-Chemical and Sensory Properties of Reduced-Fat Mortadella Prepared with Blends of Calcium, Magnesium and Potassium Chloride as Partial Substitutes for Sodium Chloride[J]. Meat Science, 2011, 89(4): 426-433.
[7] GELABERT J, GOU P, GUERRERO L, et al. Effect of Sodium Chloride Replacement on Some Characteristics of Fermented Sausages[J]. Meat Science, 2003, 65(2): 833-839.
[8] SHAWKAT R M. Phosphate Toxicity: New Insights into an Old Problem[J]. Clinical science, 2010, 120(3): 91-97.
[9] 缪进, 邹玉峰, 王鹏, 等. 水洗结合pH值调整对鸡肉糜低盐热凝胶特性的影响[J]. 农业工程学报, 2012, 28(24): 287-292.
MIAO Jin, ZOU Yu-feng, WANG Peng, et al. Effects of Washing Treatment and pH Adjustment on Heat-Induced Gelling Properties of Minced Chicken with Low-Salt[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(24): 287-292.
[10] 严红波, 沈春蕾, 张宾, 等. 南美白对虾肉糜冻藏过程中蛋白质功能特性变化[J]. 食品与发酵工业, 2020, 46(24): 37-42.
YAN Hong-bo, SHEN Chun-lei, ZHANG Bin, et al. Changes in Protein Function of Minced Shrimp () during Frozen Storage[J]. Food and Fermentation Industries, 2020, 46(24): 37-42.
[11] PATHANIA R, KHAN H, KAUSHIK R, et al. Essential Oil Nano-Emulsions and Their Antimicrobial and Food Applications[J]. Current Research in Nutrition and Food Science Journal, 2018, 6(3): 626-634.
[12] 王雪, 郭兴凤. 蛋白质乳化性研究进展[J]. 粮食加工, 2017, 42(1): 39-43.
WANG Xue, GUO Xing-feng. Research Progress of Protein Emulsification[J]. Grain Processing, 2017, 42(1): 39-43.
[13] 刘丽娅, 赵强忠, 孔静, 等. 黄原胶对酪蛋白酸钠乳状液稳定性的影响[J]. 食品工业科技, 2012, 33(5): 83-86.
LIU Li-ya, ZHAO Qiang-zhong, KONG Jing, et al. Effect of Xanthan Gum on the Stability of Sodium Caseinate Emulsion[J]. Science and Technology of Food Industry, 2012, 33(5): 83-86.
[14] KAUSHAL P, KUMAR V, SHARMA H K. Comparative Study of Physicochemical, Functional, Antinutritional and Pasting Properties of Taro (), () Flour, Pigeonpea () Flour and their Blends[J]. LWT- Food Science and Technology, 2012, 48(1): 59-68.
[15] LESTARI D, MULDER W J, SANDERS J P M. Jatropha Seed Protein Functional Properties for Technical Applications[J]. Biochemical Engineering Journal, 2011, 53(3): 297-304.
[16] LIANG H N, TANG C H. Pea Protein Exhibits a Novel Pickering Stabilization for Oil-in-Water Emulsions at pH 3.0[J]. Academic Press, 2014, 58(2): 463-469.
[17] GONG K J, SHI A M, LIU H Z, et al. Emulsifying Properties and Structure Changes of Spray and Freeze-Dried Peanut Protein Isolate[J]. Journal of Food Engineering, 2016(170): 33-40.
[18] CHEUNG L, WANASUNDARA J, NICKERSON M T. Effect of pH and NaCl on the Emulsifying Properties of a Napin Protein Isolate[J]. Food Biophysics, 2015, 10(1): 30-38.
[19] TAN S H, MAILER R J, BLANCHARD C L, et al. Emulsifying Properties of Proteins Extracted from Australian Canola Meal[J]. LWT-Food Science and Technology, 2014, 57(1): 376-382.
[20] GUO Q, MU T H. Emulsifying Properties of Sweet Potato Protein: Effect of Protein Concentration and Oil Volume Fraction[J]. Food Hydrocolloids, 2010, 25(1): 98-106.
[21] 崔珊珊, 木泰华, 孙红男, 等. NaCl浓度和pH对s甘薯蛋白肽乳化特性的影响[J]. 中国农业科学, 2016, 49(9): 1778-1786.
CUI Shan-shan, MU Tai-hua, SUN Hong-nan, et al. Effects of NaCl Concentration and pH Value on the Emulsifying Properties of Sweet Potato Peptides[J]. Scientia Agricultura Sinica, 2016, 49(9): 1778-1786.
[22] PENG W W, KONG X Z, CHEN Y M, et al. Effects of Heat Treatment on the Emulsifying Properties of Pea Proteins[J]. Food Hydrocolloids, 2016(52): 301-310.
[23] NI N, WANG Z, HE F, et al. Gel Properties and Molecular Forces of Lamb Myofibrillar Protein during Heat Induction at different pH Values[J]. Process Biochemistry, 2014, 49(4): 631-636.
[24] 叶凤凌, 池玉闽, 周敏之, 等. 氧化对兔肉肌原纤维蛋白结构、乳化性和凝胶性的影响研究[J]. 食品工业科技, 2020, 41(24): 22-30.
YE Feng-ling, CHI Yu-min, ZHOU Min-zhi, et al. Effect of Oxidation on the Structure, Emulsification and Gelability of Rabbit Meat Myofibrillar Protein[J]. Science and Technology of Food Industry, 2020, 41(24): 22-30.
[25] 李丹丹, 谢盛莉, 马良, 等. 水溶性蚕蛹蛋白功能特性探究[J]. 食品与发酵工业, 2021, 47(4): 7-14.
LI Dan-dan, XIE Sheng-li, MA Liang, et al. The Functional Characteristics of Water-Soluble Silkworm Pupa Protein[J]. Food and Fermentation Industries, 2021, 47(4): 7-14.
[26] 顾振宇, 江美都, 付道才, 等. 大豆分离蛋白乳化性的研究[J]. 中国粮油学报, 2000, 15(3): 32-35.
GU Zhen-yu, JIANG Mei-du, FU Dao-cai, et al. Study on Emulsification of Soy Protein Isolate[J]. Journal of the Chinese Cereals and Oils Association, 2000, 15(3): 32-34.
[27] 高金龙, 莎丽娜, 格日勒图. 羊皮胶原蛋白乳化性与乳化稳定性的研究[J]. 食品工业科技, 2011, 32(1): 65-67.
GAO Jin-long, SHA Li-na, BORJIGIN Gerelt. Study on Emulsifying Activity and Emulsion Stability Collagen from Goat Skin[J]. Science and Technology of Food Industry, 2011, 32(1): 66-67.
[28] 陆健康, 许倩, 孟亚娟, 等. 多浪羊肉肌原纤维蛋白乳化性的研究[J]. 食品工业科技, 2014, 35(21): 91-93.
LU Jian-kang, XU Qian, MENG Ya-juan, et al. Study on Emulsifying Properties of Myofibrillar Proteins from Duolang Lamb[J]. Science and Technology of Food Industry, 2014, 35(21): 91-93.
[29] 李超, 蒲彪, 罗松明, 等. pH和NaCl浓度对花椒籽仁分离蛋白乳化性的影响[J]. 食品与发酵工业, 2017, 43(6): 92-97.
LI Chao, PU Biao, LUO Song-ming, et al. Emulsifying Properties ofMaxim Seed Kernel Protein Isolate: Effect of pH and NaCl Concentration[J]. Food and Fermentation Industries, 2017, 43(6): 92-97.
[30] ETTOUMI Y, CHIBANE M, ROMERO A. Emulsifying Properties of Legume Proteins at Acidic Conditions: Effect of Protein Concentration and Ionic Strength[J]. LWT-Food Science and Technology, 2016, 66(3): 260-266.
[31] 王超, 蔡浚泽, 刘骞, 等. 预热处理对乳清分离蛋白水包油乳状液特性和物理稳定性的影响[J]. 食品工业科技, 2017, 38(19): 21-26.
WANG Chao, CAI Jun-ze, LIU Qian, et al. Influence of Heat Pretreatment on the Characteristics and Physical Stability of Whey Protein Isolate-Stabilized Rapeseed Oil-in-water Emulsions[J]. Science and Technology of Food Industry, 2017, 38(19): 21-26.
[32] SHAO Y, TANG C. Characteristics and Oxidative Stability of Soy Protein-Stabilized Oil in Water Emulsions: Influence of Ionic Strength and Heat Pretreatment[J]. Food Hydrocolloids, 2014, 37(6): 149-158.
[33] 张雪蓉. 鹰嘴豆蛋白肽对水包油型乳状液稳定性的影响[J]. 粮食与油脂, 2021, 34(3): 70-73.
ZHANG Xue-rong. Effect of Chickpea Protein Peptide on the Stability of Oil in Water Emulsion[J]. Cereals and Oils, 2021, 34(3): 70-73.
[34] 罗永康, 潘道东, 沈慧星, 等. 蛋白质浓度、pH、离子强度对鲢鱼肌原纤维蛋白粘度的影响[J]. 食品与发酵工业, 2004(7): 52-54.
LUO Yong-kang, PAN Dao-dong, SHEN Hui-xing, et al. Effects of Protein Concentration, pH and Ionic Strength on the Viscosity of Silver Carp Myofibrillar Protein[J]. Food and Fermentation Industries, 2004(7): 52-54.
[35] 周茹, 倪渠峰, 林伟伟, 等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报, 2015, 15(3): 32-39.
ZHOU Ru, NI Qu-feng, LIN Wei-wei, et al. The Dependence of Myofibrillar Protein Solubility on Salt Ion Concentration[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(3): 32-39.
[36] 张小影, 齐宝坤, 孙禹凡, 等. 盐离子对大豆-乳清混合蛋白乳液的稳定性及界面特性的影响[J]. 食品工业科技, 2021, 42(6): 22-28.
ZHANG Xiao-ying, QI Bao-kun, SUN Yu-fan, et al. Effect of Salt Ion on the Stability and Interfacial Adsorption Characteristics of Soybean-Whey Mixed Protein Emulsion[J]. Science and Technology of Food Industry, 2021, 42(6): 22-28.
[37] 张唯唯, 何振东, 马天怡, 等. 极端酸碱pH偏移改善白果蛋白溶解性和乳化性[J]. 精细化工, 2021, 38(6): 1204-1211.
ZHANG Wei-wei, HE Zhen-dong, MA Tian-yi, et al. Extreme Acid and Alkaline pH-Shifting Processes Improving the Solubility and Emulsifying Properties of Ginkgo Seed Protein Isolate[J]. Fine Chemicals, 2021, 38(6): 1204-1211.
[38] CHEN Y, SHENG L, GOUDA M, et al. Impact of Ultrasound Treatment on the Foaming and Physicochemical Properties of Egg White during Cold Storage[J]. LWT-Food Science and Technology, 2019(113): 108303.
[39] 牛德宝. 蔗汁中亚硫酸钙的吸附特性及吸附过程Zeta电位变化的研究[D]. 南宁: 广西大学, 2013: 6-8.
NIU De-bao. The Study on the Adsorption Characteristics of Calcium Sulfite in Sugarcane Juice and the Change of the Zate Potential in Adsorption Process[D]. Nanning: Guangxi University, 2013: 6-8.
[40] 周扬, 陈雪珂, 戴宏杰, 等. 溶液体系中迷迭香酸与肌球蛋白的相互作用及其对蛋白理化特性的影响[J]. 食品科学, 2020, 41(12): 14-21.
ZHOU Yang, CHEN Xue-ke, DAI Hong-jie, et al. Interaction of Rosmarinic Acid with Myosin in Aqueous Buffer Solution and its Effect on Protein Physicochemical Properties[J]. Food Science, 2020, 41(12): 14-21.
[41] CAI X R, DU X F, ZHU G L, et al. Induction Effect of NaCl on the Formation and Stability of Emulsions Stabilized by Carboxymethyl Starch/Xanthan Gum Combinations[J]. Food Hydrocolloids, 2020, 105(776): 1-8.
[42] CHEN X, XU X L, ZHOU G H. Potential of High Pressure Homogenization to Solubilize Chicken Breast Myofibrillar Proteins in Water[J]. Innovative Food Science & Emerging Technologies, 2016(33): 170- 179.
[43] 王中江, 王妍, 张雅娜, 等. 热处理对大豆球蛋白乳化性的影响[J]. 食品工业科技, 2013, 34(16): 154-156.
WANG Zhong-jiang, WANG Yan, ZHANG Ya-na, et al. Influence of Heat Treatment on Soy Protein Emulsibility[J]. Science and Technology of Food Industry, 2013, 34(16): 154-156.
[44] TAHA A, AHMED E, HU T, et al. Effects of Different Ionic Strengths on the Physicochemical Properties of Plant and Animal Proteinsstabilized Emulsions Fabricated Using Ultrasound Emulsification[J]. Ultrasonics Sonochemistry, 2019(58): 104627.
Effects of pH on the Emulsifying Properties of Lamb Myofibrillar Protein under Low Sodium Concentration
LI Zi-hana, FEI Zi-xuanb, ZHANG Rui-lib, WANG Si-zhena,b, NI Nab
(a.College of Animal Sciences and Technology b.College of Life Sciences and Food Engineering, Inner Mongolia University for the Nationalities, Tongliao 028000, China)
The work aims to study the effects of pH on emulsifying properties of lamb myofibrillar protein under different sodium concentration to provide theoretical reference for the research and development of low-salt meat products. The lamb myofibrillar protein was mixed with vegetable oil evenly to obtain the emulsion. The effects of pH on emulsifying activity index, emulsifying stability index, creaming index, viscosity, microstructure, particle size and Zeta potential of lamb myofibrillar protein were studied under high sodium concentration (0.6 mol/L NaCl) and low sodium concentration (0.3 mol/L NaCl) conditions. The emulsifying activity index and viscosity of myofibrillar protein emulsion firstly decreased and then increased with the increase of pH (<0.05) under both high and low sodium concentration conditions. From the analysis on emulsifying stability index, creaming index and Zeta potential, the stability of emulsion system increased significantly with the increase of pH (<0.05). From the analysis results of apparent index, microstructure and particle size distribution, the emulsification state of myofibrillar protein emulsion under low sodium concentration condition (pH=8.0) was similar to that under high sodium concentration condition (pH=7.0~8.0). A higher pH can be selected under the low sodium concentration condition to improve the emulsifying properties of lamb myofibrillar protein.
lamb; myofibrillar proteins; high sodium concentration; low sodium concentration; emulsifying properties
TS251.1
A
1001-3563(2022)01-0089-09
10.19554/j.cnki.1001-3563.2022.01.012
2020-02-22
国家自然科学基金(31660467);内蒙古民族大学博士科研启动基金项目(BS360);内蒙古自然科学基金(2014MS0316)
李子晗(1996—),男,内蒙古民族大学硕士生,主攻动物生产学。
倪娜(1983—),女,博士,内蒙古民族大学副教授,主要研究方向为畜产品加工与质量控制。
