超声引导下残端神经瘤毁损治疗截肢后疼痛回顾性分析
2022-01-26浦少锋吴军珍吕莹莹杜冬萍
截肢后疼痛是截肢术后病人常见的慢性神经病理性疼痛,高达70%~80%的截肢病人会经历慢性复杂的截肢后疼痛
。病人在接受截肢手术后常常会经历以下异常状况:幻肢觉、残肢痛和幻肢痛,合称为截肢后疼痛。幻肢觉是指病人在截肢后主观感觉被截除的肢体仍然存在,这种感觉不伴有疼痛,随着时间推移会逐渐消失,无需特别处理。残肢痛即是截肢后的残端疼痛,常在截肢后立即发生,伤口愈合后疼痛会有所缓解,但部分病人的症状会一直存在,并且治疗起来十分困难。幻肢痛是指病人截肢后有幻肢觉并且幻肢有疼痛,幻肢痛的病人常合并有残肢痛。在中度至重度截肢后疼痛病人中,剧烈的疼痛是影响他们进行日常生活活动能力的最重要因素,阻碍他们完成简单任务,并且该因素与重返工作或参与正常社会生活的时间呈强负相关。
经过近20年的发展,亚通公司目前拥有福建、北京、内蒙古、黑龙江、河南、重庆、湖北、甘肃、新疆等10多个生产基地和覆盖全国27个省(自治区、直辖市)的上百家业务办理机构、上千家经销商和数万家分销网络,构建起了亚通缜密的营销网络系统,还提供专业培训咨询、工程项目实施和全方位解决方案等一站式服务。
截肢后疼痛的发病机制并未完全清楚,目前认为在外周、脊髓和脊髓以上水平等多个方面参与发病
,因此对截肢后疼痛的治疗十分棘手。目前应用于截肢后疼痛的治疗方式非常多,包括口服药物(非甾体消炎镇痛药、抗惊厥药、抗抑郁药、局部麻醉药、阿片类药物等)、物理治疗、心理行为治疗、局部注射治疗、介入治疗(脊髓电刺激、深部脑刺激、经颅磁刺激)以及多种外周和中枢手术治疗,但没有一种治疗方法能够对绝大部分截肢后疼痛病人产生良好持久的治疗效果,部分治疗还可能引起进一步的损伤。在外周机制中,残端神经瘤形成是引起截肢后疼痛的重要原因
。一些病人进行残端神经瘤切除,但是疗效不确切,可能和手术中寻找导致疼痛的神经瘤不准确和再次神经横断损伤后仍可能导致神经瘤复发引起截肢后疼痛有关。对残端痛性神经瘤进行局部注射和射频消融成功治疗截肢后疼痛已有病例报道
,局部注射的药物包括局部麻醉药
、糖皮质激素
、无水乙醇
等,射频消融则有标准和脉冲射频两种模式
。在这些病例报道中,超声引导下对巨大神经瘤进行毁损治疗的长期效果非常好。然而,关于残端神经瘤毁损有效方法的可用信息非常有限,而且这种治疗所涉及的程序技术远未标准化。本研究选取自2016 年6月至2019 年10 月间上海市第六人民医院疼痛科收治的截肢后疼痛病人,回顾性分析超声引导下射频消融和无水乙醇注射对治疗截肢后疼痛的短期和长期疗效,获得超声引导下残端神经瘤毁损的初步数据,如截肢后疼痛病人的主诉,以及相关并发症,评价治疗的安全性。
方 法
1.一般资料
本研究通过了上海市第六人民医院伦理委员会的伦理审核(No. 2017-125),选取2016 年6 月至2019 年10 月于疼痛科就诊,诊断为残肢痛和/或幻肢痛的病人53 例,治疗前均签署知情同意书。
纳入标准:①年龄> 18 岁,主诉截肢后疼痛;②超声检查发现残端神经瘤、穿刺刺激神经瘤可以诱导出与病人疼痛发作时疼痛部位和性质相同的疼痛、进行过射频消融或局部注射无水乙醇治疗。
所有病人在治疗和随访期间仍可口服镇痛药物并进行记录随访。
排除标准:感染、凝血功能障碍、心脏起搏器植入后和可能影响受试者合作的行为障碍、3 个月内接受残端修复手术或有其他可以解释神经病理性疼痛的诊断的受试者。
2.临床检查
所有病人均按Kesikburun 等
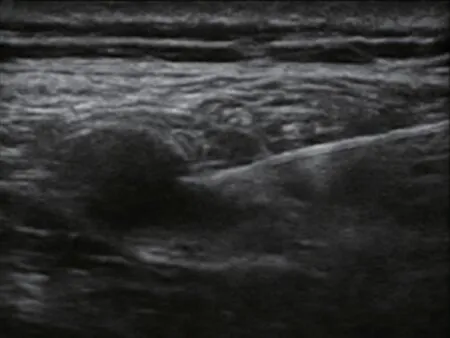
的方法进行残端体检和超声检查。体检可找到明显压痛点,Tinel's征阳性,并排除残端溃疡和感染。超声检查残端,寻找残端是否存在边界清晰、卵圆形、低回声、包膜完整的囊性结构,部分病人的残端神经瘤在超声下形状并不规则,或是瘤体内显示有部分高回声区或分隔。找到神经瘤体后沿着神经走行方向由远端向近端探查寻找与之相连的神经(本文将之称为蒂部),观察该结构是否为神经的延续,如果是则即为神经瘤(见图1)。通过按压超声探头、超声下使用8 cm 7 号针穿刺神经瘤及试验性推注微量生理盐水等方式,观察上述操作能否诱发出与平时或发作时性质及部位相同的疼痛,以此来判断该神经瘤是否为痛性神经瘤。
马少华等[13]首先制备出了双十八烷氧基二硫代磷酸吡啶盐(PyDDP-18)作为表面活性剂,并以其作为硫源,以钼酸铵作为钼源,通过共沉淀法制备出了表面修饰有PyDDP的MoS2纳米微粒,该种微粒具有较好的油溶性及优异的耐磨润滑性能。

3.治疗方法
(2)射频消融:超声探头水平放置在受试者的截肢残端上以获得短轴视图。神经瘤在超声检查中显示低回声影。应用彩色多普勒超声对动脉/静脉和神经进行鉴别。当探查到残端神经瘤时,将探头旋转75 ~90 以探查其长轴,并将探头移到近端以探索神经瘤和正常神经的连接处。通过检查长轴平面的横截面积来评估神经瘤的大小。将一根长10 cm、带有5 mm 活动针尖的射频针伸入神经,紧贴于神经瘤外缘,并连接到射频发生器。然后在电流0.4 mA 水平进行感觉测试,观察是否引起病人的疼痛。靶点确定后,经穿刺针于神经瘤近端正常神经处注射1%利多卡因10~15 ml。当局部麻醉剂起作用时,射频针穿刺进入神经瘤中,在80℃下进行120 s 的射频消融。在第1 次射频消融毁损后,将射频针从最初的靶点移动到神经瘤的0 位置,并且在80℃下再次进行射频消融120 s。然后,将针头顺时针旋转30 、60 和90 ,直到整个360 的神经瘤区域被覆盖,然后进行相同的射频消融程序。接着将射频针指向神经瘤中间,在80℃下进行120 s 的射频消融(见图2)。在拔针前,在神经瘤周围注射0.15%罗哌卡因和复方倍他米松(包括5 mg 丙酸倍他米松和2 mg 磷酸倍他米松)的混合物5 ml。当出现多个疼痛性神经瘤时,继续进行上述操作,直到所有痛性神经瘤得到治疗。
截肢后疼痛是截肢手术后常见的并发症
,是一种顽固的神经病理性疼痛,有时其治疗十分困难。在截肢手术后,肢体的截除常会导致3 种病理状态:幻肢觉、幻肢痛和残肢痛,截肢术后的病人常至少经历过其中一种状态。流行病学调查显示截肢术后幻肢痛发病率约52%~69%,残肢痛的发病率48%~62%
,而残肢痛与幻肢痛之间又有较大的联系,早期的一项调查发现约有61%的残肢痛病人合并有幻肢痛
。
找到残端痛性神经瘤后,所有病人均进行1 次超声引导下局部注射局部麻醉药和糖皮质激素的诊断性治疗,治疗后30 分钟内若疼痛明显缓解、Tinel's 征消失,随访2 周后疼痛如果有反复,则考虑进一步行痛性神经瘤毁损治疗(包括射频消融毁损和无水乙醇注射),并根据病人的自身意愿和经济条件选择治疗方式。


4.资料收集与观察指标
在接受射频消融和无水乙醇注射治疗前记录病人的年龄、性别、截肢位置、病程、神经瘤的神经来源、残肢痛的疼痛数字评分法 (numerical rating scale, NRS) 评分、近1 个月爆发痛发作的次数、是否伴有幻肢痛,由于病人常常难以将残肢痛和幻肢痛完全区分,所以幻肢痛仅记录为“有”或“无”而不进行NRS 评分。在末次治疗后均随访至12 个月,记录接受射频和无水乙醇注射的总次数、末次治疗后2 周、6 月和12 月时残肢痛的NRS 评分、近1 个月残肢爆发痛发作次数、幻肢痛的变化(加重、相同、减轻、消失)、治疗效果评估、是否有并发症。幻肢痛变化的评估标准:疼痛缓解程度大于80%为消失;疼痛缓解程度25%~79%为减轻;疼痛缓解程度小于25%及无缓解为相同;疼痛程度加剧为加重。治疗效果的评估:NRS 评分减少大于50%为有效;NRS 评分减少25%~50%为弱效;NRS 评分减少小于25%为无效。
星点设计-响应面法优化盐酸罗沙替丁醋酸酯缓释片的处方…………………………………………………… 段颐珊等(7):927
5. 统计学分析
(3)无水乙醇注射:残端皮肤消毒后覆盖无菌治疗巾,再次检查残端压痛点和应用超声寻找神经瘤,确定位置后1%利多卡因0.5 ml 对穿刺点进行局部麻醉,超声引导下使用平面内技术将穿刺针经穿刺点刺入神经瘤内最痛处,在穿刺过程中尽量减少穿刺的次数,避免损伤神经瘤壁造成无水乙醇向周围组织渗漏。1%利多卡因1 ml 注入神经瘤内进行局部麻醉,然后推注无水乙醇1~1.5 ml,注射完毕后将穿刺针拔出神经瘤前用少量生理盐水冲洗,夹闭延长管上的开关,之后再拔出穿刺针。结束后,在神经瘤周围注射0.15%罗哌卡因和复方倍他米松(包括5 mg 丙酸倍他米松和2 mg 磷酸倍他米松)的混合物5 ml(见图3)。
1.教师要让学生多角度了解几何学的内容和用途,如在黑板上画赵州桥的草图,让学生猜桥的名称,并说明有关的知识,然后教师进行必要补充,说明赵州桥是几何学和力学的完美结合,美观、轻巧、坚固、实用等等,从而引入几何更多内容,也让学生自己举一些相关例子。
结 果
1.一般资料
53 例病人均进行超声检查,其中51 例病人发现残端痛性神经瘤,并且均接受了一次局部麻醉药加糖皮质激素的诊断性治疗;其中3 例病人诊断性治疗后疼痛无明显缓解,48 例病人在诊断性治疗后24 小时内疼痛均明显好转,其中6 例病人随访3~6 月后疼痛仍明显缓解,并未进行进一步治疗,仅在疼痛发作时口服镇痛药物即可控制疼痛;而另42 例病人疼痛仍有反复,其中6 例病人拒绝神经瘤毁损治疗,36 例病人接受了神经瘤毁损治疗(包括射频消融与无水乙醇注射)并随访1 年,因此共计36 例病人纳入分析(见表1),其中男性21 例,女性15 例,平均年龄58.3±12.3 岁(34~84)岁,病程17.5±10.0 年(1~44)年。截肢位置:1 例拇指末节,4 例肘关节以下,4 例肘关节以上,3 例肩关节,7 例膝关节以下,16 例膝关节以上,1 例髋关节。有7 例病人病程小于1 年,10 例病人病程1~5年,19 例病人病程超过5 年,最长者为44 年。36例病人残端总计找到41 个痛性神经瘤,其中31 例病人残端有1 个痛性神经瘤,5 例病人的残端找到2 个痛性神经瘤。来源于坐骨神经的神经瘤最多(19个),其他来源包括胫神经、腓神经、正中神经、桡神经、尺神经、臂丛、指神经。35 例病人(97.2%)有残肢痛,25 例病人(69.4%)有幻肢痛,24 例病人(66.7%)同时存在残肢痛和幻肢痛。治疗前残肢痛的NRS 评分为(9.1±0.8)。每月爆发痛的发作次数(9.7±3.7)次。

2.不同治疗方式的NRS 评分
详细记录每例病人接受神经瘤毁损治疗的方式和次数。有31 例接受了射频消融治疗,其中10 例治疗1 次,11 例治疗2 次,10 例治疗3 次;有17例接受了无水乙醇注射,其中3 例治疗1 次,5 例治疗2 次,8 例治疗3 次,1 例治疗5 次;12 例进行了两种毁损治疗。
在正式建设的过程中,必须制定管理责任制,统一权利和责任。这将使问责制能够移交给各部门的人员,以提高管理人员在实际管理过程中的积极性,并进一步提高管理效率。此外,管理进程要求个别执行管理项目。不能统一的,不得指派专人或者部门负责。这些措施需要重新分配和有效执行。
在末次治疗后2 周、6 月和12 月时进行评估(见表2)。术后2 周NRS 评分降至(1.5±1.3),在术后6 月为(2.2±1.2)、术后12 月为(2.9±2.1),与术前相比明显降低,差异有统计学意义(
< 0.001)。爆发痛的发作次数从术前每月(9.7±3.7)次,在术后2周、6 月、12 月时分别降至(1.5±1.8)次、(2.5±2.6)次、(3.2±3.3)次(
< 0.01)。25 例幻肢痛病人的幻肢痛变化,在术后2 周有9 例消失(36%)、13例减轻(52%)、3 例相同(12%);术后6 月时有11 例为消失(44%)、11 例为减轻(44%)、3 例为相同(12%);术后12 月时有3 例为消失(12%)、17例为减轻(68%)、5 例为相同(20%),所有病人未出现幻肢痛加重。治疗效果的评估,在术后2 周时有31 例为有效(86.1%)、4 例为弱效(11.1%)、1 例为无效(2.8%);术后6 月时有28 例为有效(77.8%)、7 例为弱效(19.4%)、1 例为无效(2.8%);术后12月时有28 例为有效(77.8%)、5 例为弱效(13.9%)、3 例为无效(8.3%)。所有病人在治疗过程中无并发症发生。

讨 论
(1)仪器:索诺声超声仪(S-nerve; Sonosite, Bothell, Washington);射频治疗仪(Pain Management Gener ator; Kimberly-Clark, Roswell, USA);COSMAN 21G 射频穿刺针(cannulaCC
, 10 cm, 21G; COSMAN MEDICAL, USA)。
截肢后疼痛的发病机制十分复杂,包括外周机制、脊髓机制和脊髓以上水平中枢机制等多方面参与发病
,因此对其的治疗也很复杂。脊髓以上机制包括躯体感觉皮层及其他区域的过度兴奋和重组、恐惧和其他心理因素等。脊髓机制包括了NMDA 受体的激活、抑制性神经元缺失和神经胶质细胞的活化等。外周机制则有神经瘤的形成、离子通道表达的改变、受体蛋白的改变、被切断后的神经末梢异位放电和交感神经的激活等等。在这三个层面的发病机制中,外周机制起到了重要的作用,脊髓及脊髓以上中枢的机制很有可能也是受到来自外周的传入冲动而被激活。有病例报道原本无幻肢痛的截肢术后病人,在接受股神经阻滞后立即出现幻肢痛
。在外周机制中,神经瘤形成是引起截肢后疼痛的非常重要的原因
。残端神经瘤常在截肢后1 个月至12 个月内形成
,然而并非所有神经瘤都会导致疼痛
,有研究认为约10%~25%的神经瘤是痛性神经瘤
。另一项超声研究中发现,有症状的神经瘤常连接在瘢痕、骨膜、骨的断端或骨刺上,而无症状的神经瘤周围则是一些疏松结缔组织
。本研究在寻找和治疗痛性神经瘤的过程中,发现在痛性神经瘤内推注药物或进针时有很大的阻力,而在一些无症状神经瘤内推药时阻力较小,也间接印证了低回声的痛性神经瘤里面含有致密的组织结构。
神经瘤在超声下常表现为一个边界清晰、卵圆形、低回声的囊性结构
,并且神经瘤是正常神经的延续
,沿着神经走行方向由残端向近端探查,可以寻找到与神经瘤相连的正常神经,这两者交界的部位称为神经瘤的蒂部
。找到神经瘤后最重要的是要判断其是否为痛性神经瘤,常通过按压超声探头、在超声引导下细针刺入瘤体及推注生理盐水等方式,观察以上刺激能否诱发出与平时相同的疼痛
等方式判断。如果上述刺激方法诱发出了与平时相同的疼痛,会接着在神经瘤内及周围瘢痕内注射局部麻醉药和糖皮质激素进行诊断性治疗
,若该治疗后疼痛可以明显缓解,持续时间也与局部麻醉药作用时间相近的话,则明确了痛性神经瘤的诊断
,进而根据疼痛缓解时间考虑下一步的治疗。
对截肢后疼痛的治疗是综合治疗,包括药物治疗、物理治疗、介入治疗和手术治疗
。药物治疗和物理治疗效果不佳的病人常会寻求进一步行介入或手术治疗。手术治疗如神经瘤切除术早已有报道
,但现有的研究中神经瘤切除术有效率差异非常大,手术效果并不稳定,无效率最高有67%
,原因主要有:残端神经瘤不是截肢后疼痛的唯一病因
;手术时并不能分辨出神经瘤是否为痛性神经瘤,切除的神经瘤可能不是引起疼痛的原因
;手术切除神经瘤是对神经的再次损伤,即使术后早期疼痛有所缓解,但随着时间推移神经瘤会再次形成并引起疼痛
。在Mitchell 的研究中
,神经瘤切除术后有42%的病例神经瘤和疼痛复发,神经瘤复发的中位时间为8 个月。多次进行手术切除神经瘤后,神经瘤复发的位置会越来越向正常神经的近端靠近,在诊断和治疗时寻找神经瘤就变得困难得多。射频消融和无水乙醇注射对残端神经瘤进行神经毁损成功治疗截肢后疼痛已有病例报道
,这些微创介入治疗的有效性及安全性均较好,治疗后疼痛有反复时可以重复应用,少有严重并发症。
目前常用射频技术有标准射频和脉冲射频2 种工作模式。标准射频使用一个恒定输出的高频电流产生45℃以上的温度(这一温度可以使神经永久性毁损),使神经热凝毁损,影响痛觉信号的传导从而减轻疼痛
。脉冲射频在治疗上并非是起神经毁损的作用。它是利用短暂的高电压“脉冲”,形成射频范围300 kHz 的电流,在治疗区域产生与连续射频相同的电压波动,但产生的温度不会引起组织凝固,因此并不是起到毁损的作用,而是起调控作用
。在本研究治疗过程中,首选的是使用标准射频模式,参数设置为温度80℃,时间120 s,神经瘤内每一个靶点进行两次射频毁损。若病人难以耐受80℃,则调整温度至病人可耐受后,逐渐加温至80 ℃或病人可承受的最高温度。目前的文献中较多的使用的是脉冲射频模式
,较多学者认为标准射频产生的高温对周围正常组织损伤大,而在临床治疗过程中,病人主要接受的是标准射频毁损治疗,治疗期间并未发生严重并发症,疼痛也都有缓解,在以后的工作中可以进一步比较两种模式的治疗效果。
据悉,年内上海市将选取部分具备条件的区开展非户籍居民家庭共有产权保障住房供应先行试点,待评估完善后,适时在全市范围内推开该项工作。此次扩围将不影响上海市户籍居民家庭申请的正常供应。
其中:Q1、Q2分别为轴承两端的润滑油端泄流量(无量纲)。则总润滑油端泄油量Q(m3/s)计算公式为:
超声引导下的局部注射是诊断和治疗痛性神经瘤的重要方法
。局部注射的药物包括局部麻醉药
、糖皮质激素、肉毒素
、无水乙醇
和苯酚等。在本研究中,局部麻醉药和糖皮质激素在诊断和治疗时都会应用。在诊断性治疗有效但疼痛缓解持续时间短于2 周的病人会考虑进一步行神经毁损以使疼痛长期缓解。射频是用物理方法进行毁损,而无水乙醇则是化学性毁损治疗。已有研究使用无水乙醇在神经瘤内注射能有效缓解疼痛
。本研究中,有17 个病例使用过无水乙醇注射,其中有5 例是单纯使用无水乙醇注射,其近期、远期疗效均较好。同时在每次治疗后均会注射局部麻醉药和糖皮质激素混合药液,目的是减少自发异位神经放电,稳定神经膜,减少局部神经炎性介质产生
,减轻治疗的不良反应。需要注意的是目前没有一种方法能够完全达到真正的永久性神经阻滞,许多神经破坏性阻滞的效果只能持续数周至数月,过后疼痛可能会复发,需要进行重复治疗。射频消融毁损效果确切,但每次毁损范围较小,需要对多个靶点反复进行毁损,治疗时需要有极大的耐心进行多靶点的调整与治疗;无水乙醇注射通过在神经瘤内扩散,似乎在治疗操作难度与毁损范围都要优于射频消融,但在实际临床工作中,由于痛性神经瘤内的结构过于致密,无水乙醇的扩散并不十分理想。
本研究回顾分析了超声引导神经瘤毁损治疗截肢后神经病理性疼痛的效果及安全性,得出以下结论:对截肢后疼痛的病人,可以用超声技术寻找是否有残端痛性神经瘤,并且在超声引导下对残端痛性神经瘤毁损可缓解幻肢痛与残肢痛,也提示外周机制在截肢后疼痛的发病中起到重要的作用。本研究为回顾性分析,在病人与治疗方式选择并非随机对照,后续仍需进行大样本随机对照前瞻性试验。
利益冲突声明:作者声明本文无利益冲突。
[1] Hsu E, Cohen SP. Postamputation pain: epidemiology,mechanisms, and treatment[J]. J Pain Res, 2013, 6:121-136.
[2] Nikolajsen L. Postamputation pain: studies on mechanisms[J]. Dan Med J, 2012, 59(10):543-546.
[3] O'Reilly MA, O'Reilly PM, Sheahan JN,
. Neuromas as the cause of pain in the residual limbs of amputees. An ultrasound study[J]. Clin Radiol, 2016, 71(10):1068.e1-1068.e6.
[4] Provost N, Bonaldi VM, Sarazin L,
. Amputation stump neuroma: ultrasound features[J]. J Clin Ultrasound, 1997, 25(25):85-89.
[5] Kesikburun S, Yaşar E, Dede I,
. Ultrasound-guided steroid injection in the treatment of stump neuroma: pilot study[J]. J Back Musculoskelet, 2014, 27(3):275-279.
[6] 郑碧鑫, 宋莉, 彭英,等. 超声引导下臂丛神经脉冲射频治疗残肢痛1 例[J]. 中国疼痛医学杂志, 2017,23(2):159-160.
[7] Wu H, Sultana R, Taylor KB,
. A prospective randomized double-blinded pilot study to examine the effect of botulinum toxin type a injection versus lidocaine/depomedrol injection on residual and phantom limb pain: initial report[J]. Clin J Pain, 2012, 28(2):108-112.
[8] Po-Jen Chen, Huey-Wen Liang, Ke-Vin Chang,
.Ultrasound-guided injection of steroid in multiple postamputation neuromas[J]. J Clin Ultrasound, 2013,41(2):122.
[9] Lim KB, Kim YS, Kim JA. Sonographically guided alcohol injection in painful stump Neuroma[J]. Ann Rehabil Med, 2012, 36(3):404-408.
[10] Rana MV. Radiofrequency: conventional and Pulsed[M].Treatment of Chronic Pain by Interventional Approaches.Springer New York, 2015:75-86.
[11] Mbchb KPAB. Survey of phantom limb pain, phantom sensation and stump pain in cambodian and new zealand amputees[J]. Pain Med, 2011, 12(5):794-798.
[12] Kelle B, Kozano lu E, Biçer ÖS,
. Association between phantom limb complex and the level of amputation in lower limb amputee[J]. Acta Orthop Traumatol Turc, 2017, 51(2):142-145.
[13] Siddiqui S, Sifonios AN, Le V,
. Development of phantom limb pain after femoral nerve block[J]. Case Rep Med, 2016, 2014(3):238453.
[14] Grinsell D, Keating CP. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies[J]. Biomed Res Int, 2014, (4):698256.
[15] 刘志华, 孙涛. 脉冲射频治疗慢性疼痛的研究新进展[J]. 中国疼痛医学杂志, 2014, 20(12):899-903.
[16] Kitcat M, Hunter JE, Malata CM. Sciatic neuroma presenting forty years after above-knee amputation[J].Open Orthop J, 2009, 3:125-127.
[17] Henrot P, Stines J, Walter F,
. Imaging of the painful lower limb stump[J]. Radiographics, 2000, 20:S219-S235.
[18] Ernberg LA, Adler RS, Lane J. Ultrasound in the detection and treatment of a painful stump neuroma[J].Skeletal Radiol, 2003, 32(5):306-309.
[19] Buntragulpoontawee M, Pattamapaspong N, Tongprasert S. Multiple neuromas cause painful "Jumping Stump" in a transfemoral amputee: a case report[J]. Int J Low Extrem Wounds, 2016, 15(3):271.
[20] Borghi B, Bugamelli S, Stagni G,
. Perineural infusion of 0.5% ropivacaine for successful treatment of phantom limb syndrome: a case report[J]. Minerva Anestesiol, 2009, 75(11):661-664.
[21] Whipple RR, Unsell RS. Treatment of painful neuromas[J]. Orthop Clin North Am, 1988, 19(1):175-185.
[22] Stokvis A, Coert JH, van Neck JW. Insufficient pain relief after surgical neuroma treatment: prognostic factors and central sensitisation[J]. J Plast Reconstr Aes, 2009,63(9):1538-1543.
[23] Liu K, Tang T, Wang A,
. Surgical revision for stump problems after traumatic above-ankle amputations of the lower extremity[J]. BMC Musculoskelet Disord, 2015, 16(1):1-7.
[24] Sehirlioglu A, Ozturk C, Yazicioglu K,
. Painful neuroma requiring surgical excision after lower limb amputation caused by landmine explosions[J]. Int Orthop, 2009, 33(2):533-536.
[25] Stokvis A, van der Avoort DJC, van Neck JW,
.Surgical management of neuroma pain: a prospective follow-up study[J]. Pain, 2010, 151(3):862-869.
[26] Pet MA, Ko JH, Friedly JL,
. Traction neurectomy for treatment of painful residual limb neuroma in lower extremity amputees[J]. J Orthop Trauma, 2015, 29(9):e321.
[27] Restrepo-Garces CE, Marinov A, McHardy P,
.Pulsed radiofrequency under ultrasound guidance for persistent stump-neuroma pain[J]. Pain Pract, 2011,11(1):98-102.
[28] Hughes RJ, Ali K, Jones H,
. Treatment of Morton's neuroma with alcohol injection under sonographic guidance: follow-up of 101 cases[J]. Am J Roentgenol,2007, 188(6):1535-1539.
[29] Tamimi MA, Mcceney MH, Krutsch J. A case series of pulsed radiofrequency treatment of myofascial trigger points and scar neuromas[J]. Pain Med, 2009,10(6):1140-1143.
