基于光遗传学与化学遗传学技术的疼痛脑环路研究进展 *
2022-01-26陈丹丹翟晓静樊炳乾高易红邹士雅政张红星曹君利
疼痛是日常生活中最为常见的身心体验。正常的痛觉感知可以保护机体免受进一步损伤,而长期慢性疼痛,作为一种病症,常常合并焦虑、抑郁、失眠等症状,是最为常见的失能原因,影响全球约20%的人口
。尽管目前已经有多种治疗慢性疼痛的方法,但疗效并不满意
。此外,阿片类镇痛药还会产生依赖、成瘾等不良反应
,因此,慢性疼痛已成为一个全球性公共卫生难题。疼痛的中枢敏化机制(中枢对伤害性刺激的反应性增加)被认为是导致慢性疼痛难以治疗的重要原因
。随着研究的不断深入,我们对疼痛有了较为深入的理解,并认识到疼痛这一复杂的情感体验是神经元及其构成的神经环路与脑神经网络介导的。但由于传统研究技术无法特异性地调控神经元及其环路的活动,因此既往疼痛的机制研究主要集中于外周和脊髓,而对疼痛的脑环路机制认识不足。探究疼痛信号在大脑中的传导通路,将有助于开发对慢性疼痛特异且有效的药物和治疗方法。
21 世纪后,光遗传学和化学遗传学这两大高度特异性的神经元干预技术的出现,使在体精准操控神经元活动成为可能,为确定特定神经元活动与行为之间的因果关系,研究生命活动的脑机制提供了强大的工具。近年来,越来越多的研究证实了脑内多个结构及其环路在疼痛调节中发挥重要作用。本文将从神经环路水平,总结并分析在不同疼痛动物模型中,基于光遗传学和化学遗传学技术发现的疼痛脑环路,以期为未来疼痛神经环路机制的研究提供新的方向,为临床疼痛治疗提供新的思路。
改革需要调整传统的利益格局。建立完善科学合理的人员分类管理机制,推行法官、检察官的员额制改革,提高法官、检察官的职业尊荣感,让能办案的人投入一线真正办案,极大提高了法官、检察官队伍的正规化、专业化、职业化水平。
一、疼痛模型
依据疼痛发生发展的特点,可将疼痛动物模型分为伤害性疼痛 (nociceptive pain)、炎症性疼痛(inflammatory pain)、神经病理性疼痛 (neuropathic pain) 和功能紊乱性疼痛 (dysfunctional pain)四种主要类型
。目前炎性痛模型常用的致炎剂包括福尔马林 (formalin)、完全弗氏佐剂 (complete freund's adjuvant, CFA)、辣椒素 (capsaicin);眶下神经慢性缩窄性损伤 (chronic constriction injury-infraorbital nerve,CCI-ION)、坐骨神经结扎(sciatic nerve ligation, SNL)、选择性神经损伤 (spared nerve injury, SNI)及腓总神经结扎 (common peroneal nerve ligation, CPNL) 常用于建立神经病理性疼痛模型;膀胱尿道扩张、结肠扩张常用来模拟内脏痛的发生;纤维肉瘤细胞骨髓腔内移植可建立骨癌痛模型。目前疼痛行为学测试主要针对疼痛感觉异常及其相关负性情绪改变。疼痛感觉异常的观察指标包括机械缩足反射阈值(mechanical withdrawal threshold, MWT)、热缩足反射潜伏期(thermal withdrawal latency, TWL)、自发痛(自发性抓挠、抬足、舔爪);疼痛引起的负性情绪常用条件位置偏好/厌恶 (conditioned place preference/aversion, CPP/CPA) 来评估。旷场、高架十字迷宫、糖水偏好、强迫游泳等测试也常用于评估疼痛引起的焦虑抑郁症状。
山东目前已建成及核准在建秸秆直燃发电项目共计43个。截至2016底,投入运行的秸秆直燃发电项目32个,总装机容量约为760MW,占全国总装机容量的14%左右。
二、光遗传学
1. 光遗传学发展简史及工作原理
(2)STN →SNr/Gpi/VP 谷氨酸能投射:疼痛是帕金森病 (parkinson's disease, PD) 常见的非运动性症状。为探究其机制,Luan 等
采用黑质多巴胺能神经元毁损的方法建立了单侧帕金森病模型。在该模型中,小鼠同侧疼痛敏感性增加且丘脑底核(subthalamic nucleus, STN) 的神经元过度活跃。光遗传学激活STN 引起对照组小鼠的痛觉过敏,抑制该核团则有效逆转了PD 的痛觉过敏表型。值得注意的是,STN 通过不同的下游投射, STN →黑质网状部 (substantia nigra pars reticulata, SNr)、STN →苍白球内段 (internal segment of the globus pallidus,GPi)/腹侧苍白球 (ventral pallidum, VP) 分别调控热痛和机械痛。因此,该研究证实生理及帕金森疾病条件下,STN 及其投射在疼痛调节中的重要作用。
推荐理由:本套书共五册,每一册讲述一位名画家,是孩子不可不知的五位家喻户晓的名画家。全书以名画诠释大师,以艺术赞美人生,用全面系统的方法将跌宕起伏的故事和名家传奇娓娓道来。故事性的叙述打开孩子的心灵,描述性的语言开启孩子的感官,让孩子去感受画面和事物,教孩子认识名画家,给孩子不一样的古代文化通识课,开启艺术思维,奠定孩子一生的品位。

2.光遗传学工作原理
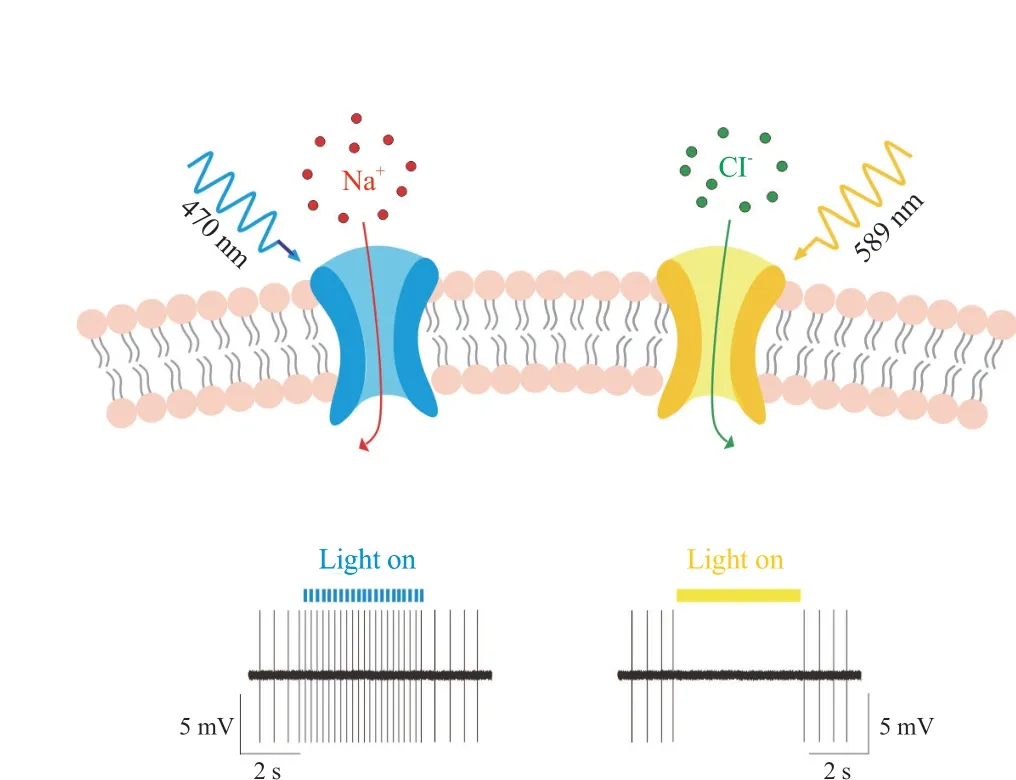
光遗传学是一种整合了光学和遗传学方法控制神经元活动的生物学技术。通过基因修饰和病毒转染的方法,将光敏感蛋白ChR2 或法老氏单胞菌盐视紫红质 (natronomonas pharaonis halorhodopsin,NpHR)表达于特定神经元细胞膜上,光敏感蛋白可以被特定波长的光激活,进而兴奋或抑制神经元。以经典的ChR2 和NpHR 为例,当473 nm 蓝光照射光敏感蛋白ChR2,通道开放,钠离子内流,细胞膜去极化,神经元兴奋。而当589 nm 黄光照射光敏感蛋白NpHR,通道打开,氯离子内流,细胞膜超极化,神经元抑制(见图2)。随着光遗传学技术的不断成熟,出现了越来越多的光敏感蛋白,Bagot 对这些光敏感蛋白进行了系统的综述。
三、 化学遗传学
1. 化学遗传学发展简史
1991 年,Strader(Strader 等. 1991) 构建了等位基因特异激活的基因编码受体 (allele-specific activation of genetically encoded receptors),这是利用化学遗传学方法调节细胞信号传导的最初尝试。1998 年Coward(Coward 等. 1998)开发了只能被合成配体激活的受体 (receptors activated solely by synthetic ligands, RASSLs),由于该受体及其配体在单独存在时,仍具有活性,阻碍了RASSLs 的应用。2007 年,Bryan Roth(Armbruster 等. 2007)发现了只由特定药物激活的受体 (designer receptors exclusively activated by designer drugs, DREADDs)。Peirs 等最早将DREADDs 用于疼痛研究,发现化学遗传学激活脊髓背角表达囊泡谷氨酸转运体VGLUT3 (+)的神经元,可诱发小鼠机械性痛觉过敏(Peirs 等. 2015),见图3。
①发言人发音不清晰:参观浪潮集团时,一位斯洛文尼亚官员在体验VR设备后说道:“VRtechnology has just gone public shortly.Ireally appreciate that Inspur can follow the trend to develop the VRuser experience.”由于这位官员发音不清晰且语速较快,笔者并未完全听辨出源语信息,但根据VR,public,follow和user experience等词采取了猜测的方式,将此句译为:“公众刚开始接触VR技术,我很欣赏浪潮公司能够紧跟潮流,发展用户体验。”

2.化学遗传学工作原理
(1)PAG 及其相关投射:PAG 是参与痛觉调制的重要脑区,包含DA 能、谷氨酸能及GABA 能等多种类型神经元。研究表明化学遗传学激活PAG DA能神经元、谷氨酸能神经元,或抑制GABA 能神经元产生镇痛效应,而抑制DA 能神经元、谷氨酸能神经元或激活GABA 能神经元则增强了伤害性感受
。以上结果为PAG 双向调节疼痛提供了直接证据。Waung 等
的研究发现,vlPAG →VTA 投射在炎性痛小鼠中被激活,光遗传学抑制该投射能够产生疼痛缓解相关的位置偏好。CeA 是PAG 的重要上游核团,Avegno 等
的研究证实CeA →PAG GABA 能投射及CeA 黑皮质素信号系统在酒精戒断所致痛觉过敏中发挥重要作用,激活该投射能够产生镇痛效应。此外,激活CeA →vlPAG GABA 能投射还能够降低抑郁状态下的痛觉反应
。

与光遗传学相比,化学遗传学操作相对简单,在特定脑区注射病毒后,不需植入光纤,只需注射或喂食CNO,组织损伤小,且可以对神经元进行较长时间处理。但在时间精确度上,远不及光遗传学毫秒级的时间分辨率。光遗传学通过离子通道调节神经元活动,而化学遗传学主要通过受体影响细胞信号传导,间接改变神经元活性。我们对这两种技术进行了如下比较(见表1)。

四、疼痛脑环路总结与分析
在生理或病理条件下,利用光遗传学或化学遗传学工具,调控特定疼痛神经环路,观察出现的疼痛行为学效应,以确定特定神经元活动与疼痛行为之间的因果关系,这是目前研究疼痛神经环路功能的一般思路。基于这一思路,我们对已发表的疼痛环路研究进行了汇总和梳理,并绘制了疼痛环路图(见图5)及疼痛环路汇总表(见表2、3),以便快速了解目前疼痛研究的现状,并为未来疼痛研究方向提供参考。
(4) ACC →NAc 谷氨酸能投射:疼痛是一种复杂的情感体验,包括痛觉、情感、认知、社会四个维度。现有疼痛研究大多侧重于痛觉、情感方面,近来,疼痛的认知、社会方面也逐渐得到关注。慢性疼痛常常会伴有记忆缺损,我们课题组研究发现,化学遗传学激活VTA 至海马齿状回 (dentate gyrus, DG)的多巴胺(dopamine, DA) 能投射,能够改善CCI 小鼠的空间记忆缺损
。Smith 等
通过建立“旁观者”模型来探索社会转移性痛觉过敏的神经机制,让正常小鼠旁观酒精戒断小鼠痛觉过敏的发生,发现ACC 在酒精戒断及旁观小鼠的痛觉敏感性增加过程中起着重要作用。接着,又进一步探究了疼痛共情的神经环路机制,发现ACC →NAc 谷氨酸能投射介导了这一社会转移性疼痛和镇痛过程
。

1.皮质及其投射
ACC 及其投射:ACC 是一个与伤害性信号感知及疼痛相关情绪反应密切相关的皮质脑区。Kang等
的研究提示疼痛状态下ACC 兴奋性神经元活性增加。选择性调控ACC 兴奋性或抑制性神经元的活动,对疼痛具有双向调节作用:光遗传学特异性激活正常小鼠ACC 的兴奋性锥体神经元,可显著降低机械痛缩足阈值;相反,抑制ACC 兴奋性锥体神经元或激活表达小清蛋白 (parvalbumin,PV) 的抑制性中间神经元,则可提高CFA 小鼠的缩足阈值。Koga 等
的研究发现光遗传学激活LC →ACC 去甲肾上腺素能通路显著增强了小鼠疼痛反应。Chen 等
的研究证实光遗传学激活ACC-脊髓背角 (spinal dorsal horn, SDH) 谷氨酸能投射可引起痛觉敏化,抑制该投射产生镇痛作用。在Kang等
的另一项研究中,光遗传学抑制CFA 小鼠ACC兴奋性神经元,可以引起与疼痛缓解相关的条件位置偏好。以上证据提示,抑制ACC 兴奋性神经元可缓解慢性疼痛小鼠的痛觉过敏及疼痛相关厌恶情绪。
产科护理中面临的风险有很多,产科护理质量直接关系到母婴的安慰,如果存在护理失误或者差错情况,都可能导致非常严重的后果。所以对于产科护理而言,做好护理风险管理,有效规避护理中可能出现的风险具有重要意义。在具体实施中,一方面需要提升护理人员的法律意识,自觉树立风险防范意识,并且要做好护理各个环节的监控,保证履行好岗位职责,确保工作标准的严格执行,护理人员要规范书写护理文书,及时、客观、准确填写好护理记录单。除此之外,必须建立风险管理机制并在实施中不断完善,对产科高危对象以及高危范围进行确定,建立高危患者交接班制度,提升护理人员的责任感以及防范意识。
(2) MD/BLA →ACC 谷氨酸能投射:Meda 等
利用坐骨神经分支选择性损伤 (spared nerve injury, SNI)和化疗诱导的小鼠神经病理性疼痛模型,研究了背内侧丘脑 (medial dorsal thalamic, MD) 至ACC 投射在疼痛调节中的作用。多数研究认为皮质脑区的兴奋性增强与疼痛密切相关,而抑制其活动可缓解疼痛
。然而,在SNI 和化疗痛模型中,光遗传学激活MD →ACC 投射增强了疼痛相关厌恶反应;而激活BLA →ACC 投射缓解了疼痛相关厌恶反应。为了探究造成这一差异的原因,他们对 ACC 神经元进行了电生理记录,发现与对照组相比,SNI 小鼠MD →ACC 投射的兴奋性降低。与此机制一致的行为学结果是:直接抑制ACC 神经元可产生与激活MD 输入相似的疼痛相关厌恶反应。相反,在光遗传学激活BLA 输入时,ACC 神经元的兴奋性显著增加,并诱导出条件位置偏好
。这表明慢性疼痛相关负性情绪是由特定的神经环路改变,而不是由普遍的ACC 兴奋性增强所引起。
(3) MS →rACC 胆碱能投射:内侧隔区 (medial septal, MS) 胆碱能系统支配广泛的皮质和皮质下区域,参与疼痛调节。MS 与ACC 间也存在投射关系。Jiang 等发现在CFA 小鼠中,利用化学遗传学方法,无论激活或者抑制MS 胆碱能神经元,均可产生镇痛效应。进一步研究证实,化学遗传学抑制CFA 小鼠MS →嘴侧ACC (rostral ACC, rACC) 胆碱能投射,或激活MS 至腹侧海马CA1 区 (ventral hippocampus CA1, vCA1) 胆碱能投射,能够缓解疼痛及负性情绪
。这一研究提示,同一脑区构成的不同神经环路可能对同一动物行为发挥相反的调控作用,这些神经环路可能协同调控同一动物行为。
时间来到1970年,整个世界的发展已经进入了一个全新的阶段,物质和财富的极大丰富让这个世界产生了前所未有的消费需求。在拥有出色通过性的基础上拥有更为豪华的驾乘体验,针对这样的需求,路虎给出的答案是一辆名为揽胜的汽车。揽胜的出现开启了一个全新篇章,其出色的道路适应性和远超时代的驾乘舒适性改变了众人的传统印象。也正是从此时开始,路虎揽胜成为英国汽车工业最高水平的代表,直到现在也未曾改变过。

外周伤害性刺激首先通过外周伤害性感受器传递至脊髓背角,在脊髓背角整合处理后继而将伤害性信息传递至脑干、丘脑等皮质下核团,最终到达大脑皮质被机体感知,使机体产生一系列适应性改变。目前基于光遗传学及化学遗传学发现的疼痛相关结构包括了脑和脊髓的多个水平。本文主要汇总了脊髓以上水平的神经环路在疼痛调节中的作用。从图5 的疼痛环路投射图可以看出,参与疼痛调节的重要的核团包括前扣带皮质 (anterior cingulate cortex, ACC)、前额叶皮质 (prefrontal cortex, PFC),皮质下的中央杏仁核 (central nucleus of the amygdala,CeA)、基底外侧杏仁核 (basolateral amygdala, BLA)、腹侧被盖区(ventral tegmental area, VTA)、伏隔核(nucleus accumbens, NAc) 以及脑干的中脑导水管周围灰质(periaqueductal gray, PAG)、蓝斑 (locus coeruleus, LC) 和延髓头端腹内侧区 (rostral ventromedial medulla, RVM)、臂旁核 (parabrachial nucleus, PBN)。
(5) MCC →PI/NAc 谷氨酸能投射:基于细胞学、影像学和纤维连接的差异,既往研究认为前扣带回皮质由rACC 和中扣带回皮质 (midcingulate division of the cingulate cortex, MCC) 组成。越来越多的研究表明,MCC 在结构和功能上不同于rACC和后扣带回皮质(posterior cingulate cortex, PCC)。Tan 等
的研究证实,MCC 神经元的持续兴奋对于诱导和维持痛觉过敏相关的中枢敏化来说是必需的,且不依赖外周伤害性刺激。即在MCC 神经元活性正常小鼠中,对该脑区进行光遗传学抑制,并不改变小鼠的缩足阈值,而对活性增高的MCC 神经元进行光遗传学抑制后,能够明显提高辣椒素疼痛模型小鼠的缩足阈值。同样,光遗传学激活正常小鼠MCC 神经元,小鼠缩足阈值明显降低。该研究证实光遗传学抑制或激活MCC →岛叶后部 (posterior insula, PI),而非MCC →NAc,与双向调控MCC 神经元时观察到的疼痛行为学结果一致。这些结果对于理解急性疼痛向慢性疼痛转化的神经机制具有重要意义。
第二,新型农村合作医疗制度的运行机制重点突出“大病统筹”为主。抵抗大病风险是广大农民最迫切的需求,这也是农民参加合作医疗的初衷。传统的农村合作医疗是以小病为主,把重点放在了门诊治疗上,保障层次低。新型农村合作医疗制度突出“大病统筹”为主,保障层次高,重点解决农民所关心的问题。
PFC 及其投射:PFC 能够双向调节疼痛感知及疼痛情绪反应。有研究认为,与其相邻脑区ACC激活促痛的作用不同,光遗传学激活PFC 兴奋性神经元,产生镇痛效应,并诱导疼痛缓解相关的条件位置偏好。相反,抑制PFC 兴奋性神经元则诱发痛觉过敏,引起疼痛相关的条件位置厌恶
。而Liang 等
的研究表明,化学遗传学激活丘脑室旁核后部 (posterior subregion of paraventricular thalamic nucleus, pPVT) →腹内侧前额叶皮质 (ventromedial PFC, vmPFC) 谷氨酸能投射致痛,抑制该投射镇痛。产生上述差异的原因,可能与PFC 中激活的神经元类型不同有关。
NAc 也是具有明显异质性的核团,除了解剖学上可以分为壳和核之外,其占比95%的中型多棘神经元(medium spiny neurons, MSNs) 可以分为投射和功能存在巨大差异的D1 (dopamine receptors 1) 和D2(dopamine receptors 2) 两种亚型
。D1 阳性神经元直接投射至中脑多巴胺能神经元构成直接通路,因此也称为直接通路棘状投射神经元 (direct spiny projection neurons, dSPNs);D2 阳性神经元先投射至腹侧苍白球,再间接作用于DA 能神经元,因此也称为间接通路棘状投射神经元 (indirect spiny projection neurons, iSPNs)。目前研究认为,直接通路与奖赏和正性情绪相关,而间接通路与厌恶和负性情绪相关
。Ren 等
研究了这两条通路在疼痛调节中的作用,发现疼痛可以引起iSPNs 的适应性改变,化学遗传学激活iSPNs 加重了触诱发痛,抑制iSPNs 则缓解了触诱发痛,证实了iSPNs 与触诱发痛之间存在因果关系。
NAc 是PFC 的主要输出核团之一。纽约大学医学院Jing wang 实验室的研究发现
,光遗传学激活PFC →NAc 兴奋性投射,能够缓解足底切开或坐骨神经结扎小鼠的痛觉过敏和疼痛相关的厌恶情绪。相反,光遗传学抑制该投射,加剧了坐骨神经结扎小鼠的热痛觉过敏,并诱导疼痛相关厌恶行为。因此,PFC →NAc 兴奋性投射在神经病理性疼痛和急性疼痛调节中发挥着重要作用。
(2)dmPFC →vlPAG:Yin 等
的研究发现,光遗传学激活背内侧前额叶皮质 (dorsal medial PFC,dmPFC) →腹外侧中脑导水管周围灰质 (ventrolateral PAG, vlPAG) 谷氨酸能投射,产生镇痛和抗焦虑作用,而化学遗传学激活dmPFC →vlPAG GABA能投射,导致疼痛和焦虑状态。Huang 等
对mPFC →vlPAG 投射的研究结果与此一致,在对PFC 的上下游探索后发现,神经病理性疼痛增强了BLA 对PFC 的抑制性输入,从而引起PFC →PAG投射及其下游靶点前馈抑制。因此,前馈抑制在PFC 参与疼痛调节过程中发挥了重要作用。
(1)S1 →ACC 谷氨酸能投射:初级体感皮质(primary somatosensory cortex, S1) 是编码疼痛信号的重要皮质脑区,化学遗传学抑制CCI-ION 小鼠S1 谷氨酸能神经元,可以提高缩足阈值,降低面部梳洗频率,减轻小鼠的机械痛和自发痛;而化学遗传学或光遗传学激活正常小鼠S1 谷氨酸能神经元,则降低缩足阈值,增加面部梳洗频率,诱发小鼠机械痛和自发痛
。Singh 等
发现S1 与ACC 之间存在直接投射联系,光遗传学激活S1 →ACC 谷氨酸能投射,可诱导疼痛相关厌恶行为。该研究结果明确了皮质环路在整合疼痛感觉及其相关情感信号方面的重要作用。
2. 中脑边缘系统
中脑边缘系统与奖赏相关的行为和情绪反应密切相关。该系统主要包括腹侧被盖区 (ventral tegmental area, VTA)、伏隔核 (nucleus accumbens,NAc)、前额叶皮质 (prefrontal cortex, PFC)、黑质(substantia nigra, SN)、下丘脑 (hypothalamus) 等。越来越多的研究表明,中脑边缘奖赏系统在疼痛调节中发挥了重要作用。
(1) VTA →NAc 多巴胺能投射:VTA 中60% ~65%的神经元为DA 能神经元,是中脑边缘奖赏系统中DA 的主要来源。VTA DA 能神经元及其相关神经环路在疼痛调制中也扮演着重要的角色
。我们课题组在小鼠慢性坐骨神经紧缩神经病理性疼痛模型中,发现疼痛状态下VTA DA 能神经元放电增加且爆发式放电增加,光遗传学或化学遗传学抑制VTA →NAc,而非VTA →mPFC DA 能投射可产生镇痛效应
。而Watanabe 等
在神经损伤及骨癌痛模型中证实,激活VTA →NAc 投射的DA能神经元,能够逆转病理性的触诱发痛。同样地,Wakaizumi 等
基于运动镇痛背景,结合化学遗传学方法,通过抑制VTA →NAc DA 能投射,阻断了运动引起的疼痛缓解。间接证实了运动可以激活VTA DA 系统,产生镇痛作用。此外,Taylor 等
利用化学遗传学方法激活VTA DA 能神经元,显著降低CFA 小鼠的热痛觉过敏。
传统的观念以及大多数研究认为,疼痛缓解是一种“奖赏”效应,激活 VTA 多巴胺能神经元能够产生镇痛效应
。近年来也有观点认为疼痛激活VTA DA 能神经元,抑制VTA DA 能神经元产生镇痛效应。我们认为出现上述差异可能有如下原因:VTA 是解剖学和细胞学上存在巨大异质性的核团,VTA 不同亚区细胞类型及其投射存在差异,不同的解剖定位、细胞类型及投射决定了VTA 功能的复杂性
。同时,VTA 除了多巴胺能神经元,还包含了GABA 能、谷氨酸能以及混合性神经元(释放多种神经递质),且与多个核团之间存在复杂的投射联系
。因此,VTA 与其他脑区形成的神经环路可能存在神经递质共存的并行投射现象,这也是造成中脑多巴胺奖赏环路功能异质性的一个原因。
(1)PFC →NAc 谷氨酸能投射:NAc 又称腹侧纹状体,是大脑奖赏回路中的一个关键节点。不仅参与调控动机、厌恶、奖赏、强化学习,在疼痛调节中的作用也日益受到关注。NAc 分为壳 (shell)和核 (core), 二者在细胞类型、纤维联系和功能上都存在差异。Kc 等
的研究表明,光遗传学激活NAc core 可缓解背根节压迫所导致的神经病理性疼痛。Massaly 等
发现NAc shell kappa 阿片系统的募集介导了疼痛相关厌恶情绪。
(2)BLA →CeA 谷氨酸能投射:杏仁核是中脑边缘系统的重要部分,尤其是BLA 及CeA,在恐惧学习、焦虑、奖赏以及疼痛等情绪和行为调控中十分重要。Cai 等
研究了CeA 处理情绪和疼痛的脑环路机制,发现光遗传学激活PBN →CeA谷氨酸能投射不影响痛觉,但能引起小鼠焦虑、抑郁、厌恶等负性情绪,而激活BLA →CeA 谷氨酸能投射的效应相反,能够缓解疼痛及诱导条件位置偏好。值得注意的是,在正常小鼠中同时激活两条环路,产生镇痛(仅热痛)效应,且没有出现焦虑抑郁样行为。这一结果表明,BLA →CeA 投射的激活可能抑制了PBN →CeA 投射的情绪效应,而BLA →CeA 投射的镇痛效应不受PBN →CeA 投射活动的影响。
(3) CeA →BNST GABA 能投射:Johnson 等
证实了中央杏仁核-终纹床核 (bed nucleus of stria terminalis, BNST) 投射促进内脏痛的发生。在直肠扩张模型中,光遗传学激活CeA →BNST 的γ-氨基丁酸 (γ-aminobutyric acid, GABA) 能投射,可加剧内脏痛。但是抑制该投射并没有改变结肠的敏感性。需要注意的是,CeA 中主要为GABA 能神经元,该研究中光遗传学病毒策略采用CaMKIIa 启动子,一般认为该启动子优先感染谷氨酸能神经元,而免疫组织化学染色结果确认腺相关病毒感染的是CeA 中的GABA 能神经元,这也再次提醒我们,CaMKIIa启动子标记的是投射神经元,而非特异性标记谷氨酸能神经元,在解释相关结果时需谨慎。
另外,左右两侧CeA 在内脏痛调节中也发挥着不同的作用。Sadler 等
在膀胱尿道扩张模型中,光遗传学激活右侧CeA,或抑制左侧CeA,增加了内脏运动反应,表明左右两侧CeA 差异性地调节内脏痛。对于这一现象产生的原因及其意义,尚不清楚。因此,在未来的研究中应加以区分。
3.丘脑及其相关投射
丘脑由多个接受下行和上行通路伤害性信息的核团组成,不仅被认为是疼痛的中继站,而且通过与大脑和脊髓的许多区域相互连接参与疼痛调节。Chang 等
采用光遗传学和化学遗传学方法证实,丘脑室旁前核 (anterior nucleus of paraventricular thalamus, PVA) 在慢性疼痛模型中,对机械性痛觉过敏的发生起着重要作用,并发现光遗传学激活右侧CeA (right CeA, rCeA) →PVA 投射可以诱发持续机械性痛觉过敏。Wang 等
研究证实腹侧未定带(ventral zona incerta, ZIv) →丘脑后复合体 (posterior complex of the thalamus, Po) 小清蛋白能投射在疼痛状态下兴奋性升高,光遗传学抑制这一投射产生镇痛效应。
(1) TRN →VB GABA 能投射:Liu 等
利用化学遗传学方法激活正常小鼠丘脑网状核嘴背区(rostro-dorsal sector of thalamic reticular nucleus, TRNrd)小清蛋白阳性神经元,小鼠机械缩足阈值明显降低,热缩足潜伏期显著缩短。结合免疫组化和电生理学方法,证实TRNrd 的PV 神经元主要投射到丘脑前背核(anterodorsal thalamic nucleus, AD) 和丘脑旁核 (paratenial thalamic nucleus, PT) ,并观察到AD 和PT 可被TRNrd 的PV 神经元局部轴突末梢释放的GABA 特异性抑制,但TRNrd →AD 和TRNrd →PT投射的功能,该研究还未阐明。Zhang 等
通过光遗传学方法激活丘脑TRN →丘脑腹侧基底核 (ventrobasal thalamus, VB) GABA 能投射,延长了CFA大鼠的热缩足潜伏期。利用微透析结合高效液相色谱法 (high performance liquid chromatography, HPLC)分析后发现,CFA 大鼠VB 脑区GABA 水平降低。在VB 脑区微量注射GABA 受体激动剂能够缓解CFA 大鼠的热痛觉过敏,而选择性敲除GABA 受体γ2 亚基加重CFA 大鼠的热痛觉过敏。因此,该研究表明VB 中GABA 释放减少促进慢性炎症性疼痛热痛觉过敏的发生。
早在20 世纪70 年代,科学家们就已发现微生物可以产生和利用视紫红质样蛋白。随后,相继发现了细菌视紫红质bacteriorhodopsin(Oesterhelt 等.1971)和盐视紫红质halorhodopsin(Matsuno-Yagi 等.1977)。1996 年,华裔科学家钱卓开发了Cre-loxp系统,为光遗传学工具在特定神经元中的表达奠定了基础(Tsien 等. 1996)。2003 年,Hegemann等发现了光遗传学工具的关键元件—光敏感通道 (channelrhodopsin-2, ChR2)
。2005 年,斯坦福大学Kral Deisseroth 等首次成功利用ChR2 实时操控神经元活动
。此后,光遗传学被广泛应用于神经科学研究。早在2004 年,华裔科学家潘卓华用ChR2 激活视网膜神经元,但文章至2006 年才得以发表 (Bi 等. 2006)。2009 年,Wang 等利用光遗传学,证实光激活背根神经节Mas 相关G 蛋白偶联受体D 阳性 Mrgprd (+)的伤害性神经元,能够直接兴奋脊髓背角胶质区神经元(Wang 等. 2009)。2010 年,光遗传学被Nature Methods 选为“年度方法”, 同年被Science 评为近十年来的突破之一(见图1)。
4. 脑干核团及其相关投射
化学遗传学主要是通过对生物大分子进行改造,使其不再与先前的配体相结合,而只接受外源性的配体信号,从而改变神经元的活动。DREADDs主要是对G 蛋白偶联受体 (G protein-coupled receptors,GPCR)进行改造,改造后的受体只能被特定化合物叠氮平-N-氧化物 (clozapine-N-oxide, CNO)激活或抑制。以与Gq 亚基偶联的人M3 毒蕈碱型DREADD受体 (human M3 muscarinic DREADD receptor coupled to Gq, hM3Dq) 和与Gi 亚基偶联的人M4 毒蕈碱型DREADD 受体 (human M4 muscarinic DREADD receptor coupled to Gi, hM4Di) 为例,hM3Dq 与CNO结合后,可激活磷脂酶C (phospholipase C, PLC)-三磷酸肌醇(inositol triphosphate, IP3)-钙离子 (calcium ion, Ca
)和二酰甘油 (diacylglycerol, DG)-蛋白激酶C (protein kinase C, PKC) 信号通路,最终引起神经元兴奋。而hM4Di 与CNO 结合后,可抑制腺苷酸环化酶(adenylate cyclase, AC)-环磷酸腺苷 (cyclic adenosine monophosphate, cAMP)-蛋白激酶A (protein kinase A, PKA) 信号通路,从而产生神经元抑制效应(见图4)。
(2)LC 及其相关投射:蓝斑核几乎100%为去甲肾上腺素能神经元,是脑内去甲肾上腺素(noradrenaline, NE) 的最重要的来源。去甲肾上腺素作为一种重要的神经递质,参与调节多种生命活动,包括觉醒、认知、记忆,并被认为是下行内源性镇痛的一部分。Hirschberg 等
的研究发现化学遗传学激活LC 可引起厌恶行为,但激活LC →PFC 投射增加了疼痛敏感性,并产生厌恶、焦虑情绪;而激活LC →脊髓皮质 (spinal cortex, SC) 则产生镇痛效应。此外,Hickey 等
的研究表明,光遗传学激活蓝斑不同区域,对大鼠热痛有双向调节作用:光遗传学激活LC 去甲肾上腺素能神经元,增加大鼠的热痛觉过敏,通过光纤位置, 分析该类神经元的大致解剖分布,发现这类发挥促痛效应的神经元偏LC 背侧;光遗传学激活LC 偏腹侧神经元,则降低大鼠热痛觉过敏,诱导镇痛效应。Schwarz 等
利用病毒示踪的方法对蓝斑去甲肾上腺素能 (LCNE) 神经元的输入和输出进行定量分析,发现接受相似纤维输入LC-NE 神经元发出投射至不同的脑区 ,提示解剖位置分布及投射特异性的差异可能是LC-NE 神经元产生不同效应的结构基础。
国际条约中提供权的发展及其在著作权法中的实践............................................................................................相 靖 08.73
1056 高分辨率磁共振成像分析基底节区孤立性缺血性脑卒中病因 王 诺,张首龙,秦鲁平,朱 宣,张敏敏,邓本强,吴 涛
(3)RVM →SDH GABA 能投射:脊髓的感觉传递受下行通路双相调节,下行易化通路被认为是慢性疼痛的原因之一。脑干-RVM 是最经典的下行调节通路。RVM 含有GABA 能、谷氨酸能、血清素能等多种类型神经元。RVM 血清素能 (5-HT) 神经元在下行疼痛调节中的作用仍存在争议,早期的研究表明RVM 5-HT 系统既镇痛又促痛。Cai 等
证实选择性激活5-HT能神经元促进了疼痛的发生。Francois 等利用光遗传学和化学遗传学方法研究了RVM 在脊髓水平调控疼痛的机制。光遗传学激活RVM →SDH GABA 能投射,降低小鼠机械缩足阈值;光遗传学或化学遗传学抑制该环路,提高小鼠机械缩足阈值。值得注意的是,无论激活或抑制该投射,都不影响小鼠的热缩足潜伏期。进一步研究发现,RVM-GABA 能神经元通过抑制背角脑啡肽能 (preproenkephalin, Penk+)/GABA 能中间神经元而促进机械痛。这些中间神经元通过脑啡肽和GABA,对感觉神经元形成突触前抑制来控制感觉及疼痛信号输入。因此,该研究发现了一个促进机械痛的下行双突触前抑制通路。
约78%的学生表示遇到过此类困难。随机抽样访谈中,部分受访学生反映曾因文化差异在涉外场合导致过沟通障碍,也有为此闹过笑话的经历。
(4)PBN 及其相关投射:PBN 主要与疼痛情绪相关。Sun 等
的研究表明,CPNL 小鼠的PBN谷氨酸能神经元被显著激活,光遗传学抑制PBN谷氨酸能神经元,或激活GABA 能神经元能够缓解CPNL 小鼠的痛觉过敏。Deng 等
的研究发现,光遗传学抑制炎性痛小鼠的SDH →PBN 投射,产生镇痛效应。
人们通常认为,头面部疼痛比躯体疼痛更严重,更容易产生负性情绪。头面部的伤害性刺激主要通过三叉神经节 (trigeminal ganglion, TG) 传递至中枢,而头面部以外的伤害性感觉由背根神经节传入中枢。Rodriguez 等
的研究证实TG 神经元与臂旁外侧核(lateral PBN, PB
) 之间存在单突触投射, 光遗传学激活TG →PB
辣椒素受体阳性 (transient receptor potential cation channel vanilloid type 1, TrpV1)神经元,引起小鼠强烈躲避行为,而抑制该投射则明显缓解辣椒素注射小鼠的面部痛觉过敏,并诱导镇痛相关的实时条件位置偏好。因此,PBN 在面部疼痛与躯体疼痛的差异处理中发挥了重要作用。
中国于2016年9月加入《巴黎气候变化协定》,成为第23个完成批准协定的缔约方。由此应积极采取行动减少温室气体排放,增强对气候变化的应对能力。改革开放以来,我国经济高速发展。但在经济发展方面,除去技术创新,低能耗和环保产业等创造的产值,以能源消耗、温室气体排放为代价的产值占比不可忽视。因此,在经济发展进入新常态阶段,我们需要谋求新的增长可能性,保证可持续发展。本文基于湖北省1997年至2015年的时间序列数据,主要研究其经济增长在多大程度依赖于能源消耗,即GDP增速对碳排放量的影响,同时对人口规模、出口贸易、产业结构、技术水平等与碳排放之间的关系进行分析。
此外,在复杂的生存条件下,机体往往趋利避害,作出最利于生存的选择。Alhadeff 等
探究了饥饿和疼痛发生生存竞争时的优先级问题,并发现下丘脑刺鼠相关蛋白神经元 (agouti-related protein,AgRP) →PBN 投射介导饥饿对疼痛的抑制作用 。
5.三级环路
Huang 等
利用光遗传学方法结合体内药理学揭示,BLA →PFC →PAG 环路通过减少去甲肾上腺素和血清素来调节脊髓疼痛信号,改变疼痛行为。因此,该研究发现了一条对周围神经损伤后痛觉过敏发展至关重要的三级神经环路机制。此外,Zhu 等
研究证实CeA →PF →S2 环路参与调控疼痛抑郁共病。
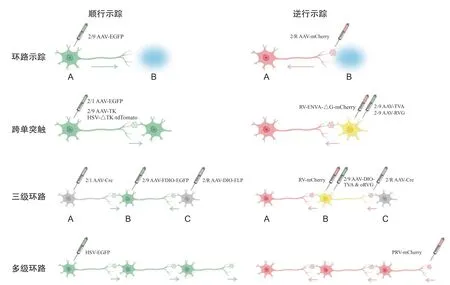
目前在光遗传学和化学遗传学技术中,使用最多的病毒载体是腺相关病毒 (adeno-associated viruses,AAV),AAV 携带光遗学或化学遗传学工具选择性地表达于特定神经元,最远扩散至轴突末梢,因此,最多可实现两个脑区之间,即两级神经元A-B 之间的调控,而无法实现对A-B 下游投射的解析。随着病毒示踪技术的发展,多级神经环路的研究逐渐成为可能,已有部分研究专注于探究三级环路(存在顺序投射关系的三个脑区)在不同行为范式中的信息传递与功能作用,这对破译大脑神经网络的构成和工作原理具有重要意义(见图6)。
五、结语与展望
痛觉感知及负性情绪是疼痛最基本的属性,也是疼痛机制研究中不可或缺的方面。近年来,疼痛的社会转移以及疼痛所引起的认知功能缺损,也日益受到关注,深化了我们对疼痛概念的理解。临床病例中,疼痛常常作为其他疾病的症状之一。疼痛合并其他病理背景的神经环路机制也可以成为研究的切入点,并为临床疼痛治疗提供新思路。
随着研究不断深入,同一个核团或环路,往往会出现不同甚至相反的行为学结果。脑内核团并非孤立存在,而是相互之间形成复杂且精细的神经网络,因此,对特定神经环路的功能解析,除了关注核团自身异质性(如神经元类型、解剖位置差异),还应该考虑核团内局部微环路、上下游的投射特异性等因素。此外,疼痛引起突触可塑性、离子通道以及分子信号通路的变化也可能是造成矛盾行为学结果的重要原因。疼痛研究中探究一些差异性现象的机制,很有可能成为疼痛药物开发的特异性靶点。
虽然光遗传学和化学遗传学具有高度时间空间特异性,但在使用过程中,也显示出一些局限性。例如,光遗传学末梢刺激回传问题、递质共释放现象、超出生理范围的刺激策略,以及末梢抑制间歇期兴奋性反跳等问题。而在化学遗传学技术中,DREADDs 的非预期效应、CNO 的特异性、不良反应等问题 。这些技术固有的不足增加了结果的不确定性。光电生理、多通道电生理记录、双光子钙成像等新技术的出现,以及多种神经科学技术的联合应用,将有助于提高疼痛神经环路机制研究的精确度。
利益冲突声明:作者声明本文无利益冲突。
[1] Andrew R, Derry S, Taylor RS,
. The costs and consequences of adequately managed chronic noncancer pain and chronic neuropathic pain[J]. Pain Pract,2014, 14(1):79-94.
[2] Finnerup NB, Attal N, Haroutounian S,
.Pharmacotherapy for neuropathic pain in adults: a systematic review and Meta-analysis[J]. Lancet Neurol,2015, 14(2):162-173.
[3] Nelson LS, Juurlink DN, Perrone J. Addressing the opioid epidemic[J]. JAMA, 2015, 314(14):1453-1454.
[4] Woolf CJ. Central sensitization: Implications for the diagnosis and treatment of pain[J]. Pain, 2011, 152(3 Suppl):S2-S15.
[5] Woolf CJ. Capturing novel non-opioid pain targets[J].Biol Psychiatry, 2020, 87(1):74-81.
[6] Nagel G, Szellas T, Huhn W,
. Channelrhodopsin-2,a directly light-gated cation-selective membrane channel[J].Proc Natl Acad Sci U S A, 2003, 100(24): 13940-13945.
[7] Boyden ES, Zhang F, Bamberg E,
. Millisecondtimescale, genetically targeted optical control of neural activity[J]. Nat Neurosci, 2005, 8(9):1263-1268.
[8] Kang SJ, Kwak C, Lee J,
. Bidirectional modulation of hyperalgesia via the specific control of excitatory and inhibitory neuronal activity in the acc[J]. Mol Brain,2015, 8(1):81.
[9] Koga K, Yamada A, Song Q,
. Ascending noradrenergic excitation from the locus coeruleus to the anterior cingulate cortex[J]. Mol Brain, 2020, 13(1):49.
[10] Chen T, Taniguchi W, Chen QY,
. Top-down descending facilitation of spinal sensory excitatory transmission from the anterior cingulat e cortex[J]. Nat Commun, 2018, 9(1):1886.
[11] Kang SJ, Kim S, Lee J,
. Inhibition of anterior cingulate cortex excitatory neuronal activity induces conditioned place preference in a mouse model of chronic inflammatory pain[J]. Korean J Physiol Pharmacol, 2017,21(5):487-493.
[12] Wang Y, Cao P, Mei L,
. Microglia in the primary somatosensory barrel cortex mediate trigeminal neuropathic pain[J]. Neuroscience, 2019, 414:299-310.
[13] Jin Y, Meng Q, Mei L,
. A somatosensory cortex input to the caudal dorsolateral striatum controls comorbid anxiety in persist ent pain[J]. Pain, 2020, 161(2):416-428.
[14] Singh A, Patel D, Li A,
. Mapping cortical integration of sensory and affective pain pathways[J]. Curr Biol, 2020.
[15] Meda KS, Patel T, Braz JM,
. Microcircuit mechanisms through which mediodorsal thalamic input to anterior cingulate cortex exacerbates pain-related aversion[J]. Neuron, 2019, 102(5):944-959.e3.
[16] Zhuo M. Cortical excitation and chronic pain[J]. Trends Neurosci, 2008, 31(4):199-207.
[17] Jiang YY, Shao S, Zhang Y,
. Neural pathways in medial septal cholinergic modulation of chronic pain:distinct contribution of the anterior cingulate cortex and ventral hippocampus[J]. Pain, 2018, 159(8):1550-1561.
[18] Xia SH, Hu SW, Ge DG,
. Chronic pain impairs memory formation via disruption of neurogenesis mediated by mesohippocampal brain-derived neurotrophic factor signaling[J]. Biol Psychiatry, 2020, 88(8):597-610.
[19] Smith ML, Walcott AT, Heinricher MM,
. Anterior cingulate cortex contributes to alcohol withdrawalinduced and socially transferred hyperal gesia[J]. eNeuro, 2017, 4(4):ENEURO.0087-17.
[20] Smith ML, Asada N, Malenka RC. Anterior cingulate inputs to nucleus accumbens control the social transfer of pain and analgesia[J]. Science, 2021, 371(6525):153-159.
[21] Tan LL, Pelzer P, Heinl C,
. A pathway from midcingulate cortex to posterior insula gates nociceptive hypersensitivity[J]. Nat Neurosci, 2017, 20(11): 1591-1601.
[22] Lee M, Manders TR, Eberle SE,
. Activation of corticostriatal circuitry relieves chronic neuropathic pain[J]. J Neurosci, 2015, 35(13):5247-5259.
[23] Wang GQ, Cen C, Li C,
. Deactivation of excitatory neurons in the prelimbic cortex via cdk5 promotes pain sensation and anxiety[J]. Nat Commun, 2015, 6:7660.
[24] Martinez E, Lin HH, Zhou H,
. Corticostriatal regulation of acute pain[J]. Front Cell Neurosci, 2017, 11:146.
[25] Dale J, Zhou H, Zhang Q,
. Scaling up cortical control inhibits pain[J]. Cell Rep, 2018, 23(5):1301-1313.
[26] Liang HY, Chen ZJ, Xiao H,
. Nnos-expressing neurons in the vmpfc transform ppvt-derived chronic pain signals into anxiety behaviors[J]. Nat Commun,2020, 11(1):2501.
[27] Kc E, Moon HC, Kim S,
. Optical modulation on the nucleus accumbens core in the alleviation of neuropathic pain in chronic dorsal root ganglion compression rat model[J]. Neuromodulation, 2020, 23(2):167-176.
[28] Massaly N, Copits BA, Wilson-Poe AR,
. Pain induced negative affect is mediated via recruitment of the nucleus accumbens kappa opioid system[J]. Neuron, 2019, 102(3):564-573.e6.
[29] Zhou H, Martinez E, Lin HH,
. Inhibition of the prefrontal projection to the nucleus accumbens enhances pain sensitivity and affect[J]. Front Cell Neurosci,2018, 12:240.
[30] Yin JB, Liang SH, Li F,
. Dmpfc-vlpag projection neurons contribute to pain threshold maintenance and antianxiety behaviors[J]. J Clin Invest, 2020,130(12):6555-6570.
[31] Huang J, Gadotti VM, Chen L,
. A neuronal circuit for activating descending modulation of neuropathic pain[J]. Nat Neurosci, 2019, 22(10):1659-1668.
[32] 赵炜楠, 胡苏皖, 翟晓静, 等. 中脑多巴胺奖赏系统与疼痛调控[J]. 中国疼痛医学杂志, 2021, 27(1):20-30.
[33] Zhang H, Qian YL, Li C,
. Brain-derived neurotrophic factor in the mesolimbic reward circuitry mediates nociception in chronic neuropathic pain[J]. Biol Psychiatry, 2017, 82(8):608-618.
[34] Wang HR, Hu SW, Zhang S,
. Kcnq channels in the mesolimbic reward circuit regulate nociception in chronic pain in mice[J]. Neurosci Bull, 2021, 37(5):597-610.
[35] Watanabe M, Narita M, Hamada Y,
. Activation of ventral tegmental area dopaminergic neurons reverses pathological allodynia resulting from nerve injury or bone cancer[J]. Mol Pain, 2018, 14:1744806918756406.
[36] Wakaizumi K, Kondo T, Hamada Y,
. Involvement of mesolimbic dopaminergic network in neuropathic pain relief by treadmill exercise: a study for specific neural control with gi-dreadd in mice[J]. Mol Pain, 2016,12:1744806916681567.
[37] Taylor NE, Long H, Pei J,
. The rostromedial tegmental nucleus: a key modulator of pain and opioid analgesia[J]. Pain, 2019, 160(11):2524-2534.
[38] 樊炳乾, 杨丽, 马雨, 等. 腹侧被盖区多巴胺能神经元在疼痛感觉调制中的异质性[J]. 中国疼痛医学杂志, 2020, 26(4):251-255.
[39] Morales M, Margolis EB. Ventral tegmental area: Cellular heterogeneity, connectivity and behaviour[J]. Nat Rev Neurosci, 2017, 18(2):73-85.
[40] Tejeda HA, Wu J, Kornspun AR,
. Pathway-and cell-specific kappa-opioid receptor modulation of excitation-inhibition balance differen tially? Gates D1 and D2 accumbens neuron activity[J]. Neuron, 2017,93(1):147-163.
[41] Hikida T, Kimura K, Wada N,
. Distinct roles of synaptic transmission in direct and indirect striatal pathways to reward and aversi ve behavior[J]. Neuron,2010, 66(6):896-907.
[42] Ren W, Centeno MV, Berger S,
. The indirect pathway of the nucleus accumbens shell amplifies neuropathic pain[J]. Nat Neurosci, 2016, 19(2):220-222.
[43] Cai YQ, Wang W, Paulucci-Holthauzen A,
. Brain circuits mediating opposing effects on emotion and pain[J]. J Neurosci, 2018, 38(28):6340-6349.
[44] Johnson AC, Latorre R, Ligon CO,
. Visceral hypersensitivity induced by optogenetic activation of the amygdala in conscious rats[J]. Am J Physiol Gastrointest Liver Physiol, 2018, 314(3):g448-g457.
[45] Sadler KE, McQuaid NA, Cox AC,
. Divergent functions of the left and right central amygdala in visceral nociception[J]. Pain, 2017, 158(4):747-759.
[46] Chang YT, Chen WH, Shih HC,
. Anterior nucleus of paraventricular thalamus mediates chronic mechanical hyperalgesia[J]. Pain, 2019, 160(5):1208-1223.
[47] Wang H, Dong P, He C,
. Incerta-thalamic circuit controls nocifensive behavior via cannabinoid type 1 receptors[J]. Neuron, 2020, 107(3):538-551.e7.
[48] Liu J, Zhang MQ, Wu X,
. Activation of parvalbumin neurons in the rostro-dorsal sector of the thalamic reticular nucleus promotes sensitivity to pain in mice[J].Neuroscience, 2017, 366:113-123.
[49] Zhang C, Chen RX, Zhang Y,
. Reduced gabaergic transmission in the ventrobasal thalamus contributes to thermal hyperalgesia in chronic inflammatory pain[J].Sci Rep, 2017, 7:41439.
[50] Luan Y, Tang D, Wu H,
. Reversal of hyperactive subthalamic circuits differentially mitigates pain hypersensitivity phenotype s in parkinsonian mice[J]. Proc Natl Acad Sci U S A, 2020, 117(18):10045-10054.
[51] Li C, Sugam JA, Lowery-Gionta EG,
. Mu opioid receptor modulation of dopamine neurons in the periaqueductal gray/dorsal raphe: a role in regulation of pain[J].Neuropsychopharmacology, 2016, 41(8):2122-2132.
[52] Samineni VK, Grajales-Reyes JG, Copits BA,
.Divergent modulation of nociception by glutamatergic and gabaergic neuronal subpopulations in the periaqueductal gray[J]. eNeuro, 2017, 4(2):28374016.
[53] Taylor NE, Pei J, Zhang J,
. The role of glutamatergic and dopaminergic neurons in the periaqueductal gray/dorsal raphe: separating analgesia and anxiety[J].eNeuro, 2019, 6(1):31058210.
[54] Waung MW, Margolis EB, Charbit AR,
. A midbrain circuit that mediates headache aversiveness in rats[J]. Cell Rep, 2019, 28(11):2739-2747.e4.
[55] Avegno EM, Lobell TD, Itoga CA,
. Central amygdala circuits mediate hyperalgesia in alcohol-dependent rats[J]. J Neurosci, 2018, 38(36):7761-7773.
[56] Yin W, Mei L, Sun T,
. A central amygdala-ventrolateral periaqueductal gray matter pathway for pain in a mouse model of depression-like behavior[J]. Anesthesiology, 2020, 132(5):1175-1196.
[57] Hirschberg S, Li Y, Randall A,
. Functional dichotomy in spinal- vs prefrontal-projecting locus coeruleus modules splits descending noradrenergic analgesia from ascending aversion and anxiety in rats[J]. Elife, 2017,6:e29808.
[58] Hickey L, Li Y, Fyson SJ,
. Optoactivation of locus ceruleus neurons evokes bidirectional changes in thermal nociception in rats[J]. J Neurosci, 2014, 34(12):4148-4160.
[59] Schwarz LA, Miyamichi K, Gao XJ,
. Viral-genetic tracing of the input-output organization of a central noradrenaline circuit[J]. Nature, 2015, 524(7563):88-92.
[60] Cai YQ, Wang W, Hou YY,
. Optogenetic activation of brainstem serotonergic neurons induces persistent pain sensitization[J]. Mol Pain, 2014, 10:70.
[61] Sun L, Liu R, Guo F,
. Parabrachial nucleus circuit governs neuropathic pain-like behavior[J]. Nat Commun, 2020, 11(1):5974.
[62] Deng J, Zhou H, Lin JK,
. The parabrachial nucleus directly channels spinal nociceptive signals to the intralaminar thalamic nu clei, but not the amygdala[J].Neuron, 2020, 107(5):909-923.e906.
[63] Rodriguez E, Sakurai K, Xu J,
. A craniofacial-specific monosynaptic circuit enables heightened affective pain[J]. Nat Neurosci, 2017, 20(12):1734-1743.
[64] Alhadeff AL, Su Z, Hernandez E,
. A neural circuit for the suppression of pain by a competing need state[J]. Cell, 2018, 173(1):140-152.e15.
[65] Francois A, Low SA, Sypek EI,
. A brainstem-spinal cord inhibitory circuit for mechanical pain modulation by gaba and enkephalins[J]. Neuron, 2017,93(4):822-839.e6.
[66] Gao SH, Shen LL, Wen HZ,
. The projections from the anterior cingulate cortex to the nucleus accumbens and ventral tegmental are a contribute to neuropathic pain-evoked aversion in rats[J]. Neurobiology Dis,2020, 140:104862.
[67] Zhu X, Zhou W, Jin Y,
. A central amygdala input to the parafascicular nucleus controls comorbid pain in depression[J]. Cell Rep, 2019, 29(12):3847-3858.e5.
