苯肼类硫化氢荧光探针的构建及性质研究
2022-01-25高习龙刘丽霞郑淳一屈梦娇袁建梅尚学芳
高习龙,刘丽霞,郑淳一,屈梦娇,袁建梅,尚学芳
(新乡医学院 基础医学院,河南 新乡 453003)
硫化氢(H2S)长期以来被认为是一种带有臭鸡蛋味道的有毒气体,近年来研究表明,H2S是继一氧化碳和一氧化氮之后的第3种气体信号分子,在生物系统中具有重要的生理功能[1-3].它在调节细胞内氧化还原状态和其他涉及人类健康和疾病的基本信号过程中发挥着重要作用,包括血管平滑肌的放松[4-5]、神经递质调节[6-7]、抑制胰岛素信号转导和调节炎症[8-10]等.内源性的H2S可以通过3种不同的酶促途径生成,包括胱硫醚-β-合成酶(CBS)、胱硫醚-γ-裂解酶(CSE)和3-巯基丙酮酸硫转移酶(3-MST)与半胱氨酸氨基转移酶(CAT)的偶联[11-12].此外,H2S水平的改变也可导致许多疾病的发生,如高血压、肝硬化、糖尿病、唐氏综合征和阿尔茨海默病[13-15].因此,为了更全面了解H2S在生物系统中的生理作用,寻找具有高灵敏度和选择性的检测技术来监测生物体内的H2S水平至关重要.
传统的H2S检测方法有化学发光法[16]、电化学分析[17]、气相色谱法[18]等,但这些方法有较多局限性,比如需要对组织或细胞进行处理或破坏,且不能对H2S进行实时跟踪定位,限制了其在生物环境中实时监测的应用.相比传统方法,近几年基于荧光探针的方法已经成为热门方法,它能够实时测量活体生物系统中的H2S,具有快速、高效、专一性识别等优点.目前,研究者根据H2S特有的反应机制,如亲核加成[19-22]、金属硫化物沉淀[23-25]、还原反应等[26-30],成功设计合成了不同类型的荧光探针,以此来检测H2S的水平.
基于此,笔者设计合成了一系列含有苯肼类的荧光分子探针,通过红外、核磁、高分辨质谱等方法对其结构进行表征,利用紫外可见光谱、荧光光谱等方法研究系列探针与H2S之间的相互作用,探讨新型荧光探针结合HS-的靶向性.
1 实验部分
1.1 仪器与试剂
主要仪器:梅特勒进口电子天平,瑞士梅特勒托利多仪器有限公司;DF-101S型集热式恒温加热磁力搅拌器,河南省予华仪器有限公司;Unity Plus-400-MHz核磁共振仪,瑞士布鲁克公司;UV2600紫外-可见分光光度计,日本岛津公司;Eclipse荧光光谱仪,美国安捷伦公司;MicrOTOF-Q III高分辨质谱仪,德国布鲁克公司.
主要试剂:2,4-二羟基苯甲醛、7-羟基香豆素、六亚甲基四胺、四丁基氯化铵、四丁基溴化铵、四丁基氟化铵、四丁基碘化铵、四丁基乙酸铵、硫氢化钠、半胱氨酸、谷胱甘肽等均购置于上海阿拉丁试剂有限公司;2,4-二硝基苯肼购置于上海试剂三厂有限公司;二甲基亚砜(DMSO)购置于天津市德恩试剂有限公司.
实验中用到的其他试剂均为分析纯,所用蒸馏水为高纯水,所用无水溶剂均按照有机溶剂纯化手册进行处理.
1.2 化合物的设计及合成
化合物1~5的合成路线如图1所示.

图1 化合物1~5的合成路线
化合物1:将2,4-二硝基苯肼(1 980 mg,10 mmol)的无水乙醇溶液(20 mL)加到250 mL的三颈烧瓶中,在磁力搅拌下将2,4-二羟基苯甲醛(1 380 mg,10 mmol)的乙醇溶液(20 mL)逐滴加入上述烧瓶中,滴加完毕后,反应溶液变红色,将反应体系于80 ℃回流6 h.反应停止后冷却至室温,析出沉淀,过滤,经无水乙醇洗涤和重结晶,得最终产物化合物1(1 908 mg, 60.2%),熔点>300 ℃.1H-NMR(400 MHz,DMSO-d6)δ 11.59(s,1 H),10.13(s,1 H), 9.97(s,1 H),8.82(m,2 H),8.32(dd,J=9.7 Hz,1 H),7.94(d,J=9.7 Hz,1 H),7.64(d,J=9.2 Hz,1 H),6.35(m,2 H).MS-HRMS(m/z):计算值:317.052 8;实测值:317.052 7.
化合物2和3:将2,4-羟基苯甲醛(910.8 mg, 6.6 mmol)和乙酰乙酸乙酯(1.3 mL)溶于10 mL无水乙醇,向反应液中分别加入0.1 mL哌啶和2滴冰醋酸,将反应体系加热回流6 h,反应结束后冷凝析出,得棕色中间体M.将中间体M(40.8 mg)的甲醇溶液(5 mL)滴加至含有1滴HCl的4-硝基苯肼(39.6 mg,0.20 mmol)的甲醇溶液中,反应体系在60 ℃恒温搅拌2 h,过滤,得到黄色沉淀,无水CaCl2真空干燥,重结晶后得到化合物2(49.64 mg, 73%),熔点:>300 ℃.1H-NMR(400 MHz,DMSO-d6)δ 10.71(s,2 H),10.28(s,1 H),8.06(d,J=9.6 Hz,1 H),7.69(d,J=8.6 Hz,1 H),6.83(dd,J=8.5 Hz,2 H),6.76(d,J=2.1 Hz,3 H),3.34(s,3 H).13C-NMR(101 MHz, DMSO-d6)δ162.14, 155.82, 151.58, 141.80, 139.24, 130.99, 126.31, 122.52, 114.07, 112.70, 111.98, 102.24, 16.21.MS-HRMS(m/z):计算值:340.093 1;实测值:340.092 9.
另将含有中间体M(40.8 mg)的甲醇溶液(5 mL)逐滴加入含有1滴HCl的2,4-二硝基苯肼(39.6 mg,0.20 mmol)的甲醇溶液中,体系有沉淀产生,将反应液于60 ℃恒温搅拌2 h,过滤,无水CaCl2真空干燥,无水乙醇重结晶得化合物3(55.35 mg, 68%),熔点:>300 ℃.1H-NMR(400 MHz,DMSO-d6)δ 10.85(s,1 H),8.89(d,J=2.6 Hz,1 H),8.42(dd,J=9.6 Hz,1 H),8.34(s,1 H),8.06(d,J=9.6 Hz,1 H),7.71(d,J=8.6 Hz,1 H),6.85(dd,J=8.5 Hz,1 H),6.76(d,J=1.8 Hz,2 H),1.06(s,3 H).13C-NMR(101 MHz, DMSO-d6)δ162.80, 156.19, 152.24, 144.75, 143.27, 138.05, 131.39, 130.57, 123.40, 121.15, 114.29, 111.76, 102.31, 15.69.MS-HRMS(m/z):计算值:407.059 8;实测值:407.059 7.
化合物4和5:将4-二乙胺基水杨醛(1930 mg,10 mmol)和乙酰乙酸乙酯(1 300 mg,10 mmol)分别加入含有100 mL无水乙醇的烧瓶中,再滴加0.5 mL哌啶.将反应体系加热回流6 h,反应结束后冷却析出沉淀,重结晶得中间体N.将4-硝基苯肼(306.3 mg, 2 mmol)溶于少量无水乙醇中,在上述溶液中逐滴加入含有1滴HCl的中间体N(518 mg,2 mmol)的乙醇溶液中.将反应体系在搅拌条件下加热2 h,反应1 h后溶液出现橙红色沉淀,反应结束后,过滤,乙醇和水(1∶1)混合溶液洗涤,干燥,乙醇和水(1∶1)混合溶液重结晶,得到化合物4(550.63 mg, 69.7%),熔点:232~235 ℃.1H-NMR(400 MHz,DMSO-d6)δ10.22(s,1 H),8.13(d,J=8.9 Hz,1 H),7.59(d,J=8.9 Hz,2 H),7.34(d,J=9.2 Hz,3 H),6.56(d,J=2.2 Hz,2 H),3.31~3.27(m,4 H),2.28(s,6 H),1.14(t,J=7.0 Hz,3 H).13C-NMR(101 MHz, DMSO-d6)δ156.76,151.68, 141.96, 139.00, 130.68, 126.32, 112.58, 109.84, 108.37, 44.60, 16.27, 12.82.MS-HRMS(m/z):计算值:395.171 1;实测值:395.171 2.
将2,4-二硝基苯肼(396 mg,2 mmol)溶于少量无水乙醇中,在上述溶液中逐滴加入含有1滴HCl的中间体N(518 mg, 2 mmol)的乙醇溶液.将反应体系搅拌加热2 h,过滤,用乙醇和水(1∶1)混合液洗涤,干燥,乙醇和水(1∶1)混合溶液重结晶,得到化合物5(665.28 mg, 72%),熔点:262~263.5 ℃.1H-NMR(400 MHz,CHCl3)δ11.40(s,2 H),9.1(s,1 H),8.37(d,J=9.5 Hz,1 H),8.20~8.00(m,3 H),7.41(d,J=8.8 Hz,1 H),6.67(d,J=8.7 Hz,1 H),6.54(s,2 H),3.48(dd,J=13.8 Hz,4 H),1.2(t,J=6.9 Hz,6 H).13C-NMR(101 MHz, CHCl3)δ160.82, 157.22, 152.20, 151.58, 144.75, 138.17, 130.08, 129.64, 123.58, 117.23, 109.55, 108.42, 45.06, 15.47, 12.46.MS-HRMS(m/z):计算值:462.138 9;实测值:462.138 8.
1.3 光谱性质测定
分别称取少量化合物1~5溶于适量的DMSO溶剂中,制得浓度为4.0×10-5mol·L-1的待测液备用.称取适量高氯酸铜六水合物和硫氢化钠分别溶于蒸馏水和DMSO中,配制浓度为4.0×10-5mol·L-1的铜离子和硫氢根离子储备液待用.各移取2.5 mL化合物1~5的溶液,并向内加入20 μL的铜离子溶液,最后,加入硫氢根离子储备液,进行光谱测定.其中,荧光发射光谱的激发波长为280 nm,狭缝宽度分别为10 nm和5 nm.
1.4 细胞毒性试验
CCK-8法检测探针1+Cu2+对HepG-2细胞的毒性.在96孔板中加入100 μL的细胞悬液(每孔约1×105个细胞),将培养板放在培养箱预培养24 h(37 ℃,体积分数5% CO2),加入10 μL不同浓度(0,10,20,50,100,150 μg·mL-1)的探针溶液,接着在培养箱孵育24 h后,向每孔加入10 μL CCK-8溶液.将培养板在培养箱内孵育1~4 h,用酶标仪测定其450 nm处的吸光度.
2 结果与讨论
2.1 紫外-可见光谱及选择性实验
在DMSO溶剂中,通过紫外-可见吸收光谱研究了化合物1~5及探针与HS-的作用.如图2(a)所示,化合物1在425 nm处有较强的吸收峰,随着Cu2+的加入,在294 nm处出现一个逐渐增强的新的吸收峰,并伴有轻微蓝移,且在395 nm处呈现等吸收点,说明化合物1与Cu2+形成了稳定络合物(将其命名为探针1+Cu2+).在化合物1和Cu2+络合形成探针后(溶液由黄色变为淡黄色),逐渐滴加NaHS(如图2(b)所示),随着HS-的加入,在294 nm处的吸收峰强度逐渐降低,而且在458 nm处出现一个明显的等吸收点,说明探针1+Cu2+和HS-发生了相互作用.当探针1+Cu2+中加入其他阴离子及生物硫醇后,探针的紫外-可见光谱并未发生明显变化(如图2(c)所示),表明探针与其他阴离子及生物硫醇之间的相互作用很弱,可以忽略.上述结果表明,探针1+Cu2+与HS-存在相互作用,可以作为HS-的检测传感器.

箭头所指为吸光度在该波长下分别随着Cu2+以及HS-的加入导致其相应的变化(化合物1:4.0×10-5 mol·L-1,Cu2+和HS-: 4.0×10-5 mol·L-1).
当化合物1中加入其他阳离子(Li+,K+,Na+,Mg2+,Mn2+,Al3+,Fe3+,Co2+,Cd2+,Ni2+)后,只有Fe3+发生了与Cu2+类似的光谱变化(如图3(a)~(b)),继续向此溶液中逐渐滴加NaHS,吸收峰并没有明显的改变.对化合物2进行同等条件下加入阴离子及生物硫醇的实验(如图3(c)),化合物2与Cu2+形成络合物后,加入NaHS和其他阴离子均未有明显的变化,表明它们之间的相互作用很弱,可以忽略,化合物3~5也未出现明显的光谱变化(如图3(d),以化合物3为例).因此,化合物2~5未能用于H2S的检测.其原因可能与化合物结构中羟基的位置有关,化合物1中,希夫碱的邻位和对位都有羟基,化合物2和3中对位有羟基,但邻位换成了羰基,化合物4和5中没有羟基且邻位是羰基,而只有化合物1与NaHS发生了相互作用.故从实验结果可看出,化合物1中对位的羟基在主客体作用中发挥了重要作用.此外,在此系列化合物中,苯环上硝基的存在对结果影响不大.

化合物1~3: 4.0×10-5 mol·L-1,所有离子及生物硫醇: 4.0×10-5 mol·L-1.
2.2 荧光光谱


箭头所指为荧光强度在该波长下分别随着Cu2+的加入而降低以及随着HS-的加入而升高(化合物1: 4.0×10-5 mol·L-1,Cu2+和HS-: 4.0×10-5 mol·L-1).
向化合物1中加入其他阳离子(Li+,K+,Na+,Mg2+,Mn2+,Al3+,Fe3+,Co2+,Cd2+,Ni2+)后,只有Fe3+表现出与Cu2+类似的光谱变化.同时,向该溶液中继续加入HS-后,其荧光强度未发生明显增强.同样,对化合物2做相同实验处理,发现探针的荧光强度没有发生显著增强,而另外4个探针与HS-结合后,探针的荧光强度均没有明显的增强.因此,探针1+Cu2+可以选择性地识别H2S.荧光光谱实验得出与紫外-可见光谱相同的结果,进一步说明该系列结构中,邻位羟基在主客体的相互作用中发挥了重要作用.
2.3 荧光寿命
在DMSO溶剂中,依次加入化合物1、探针1+Cu2+及探针1+Cu2++HS-3种储备样,所测得的荧光寿命结果如图5所示.经过仪器拟合荧光寿命时间曲线得到的均为一阶寿命,计算化合物1的平均寿命为40.67 ns,加入Cu2+后为30.21 ns,当加入HS-后荧光寿命为40.12 ns.由此可以看出化合物本身具有一定的荧光寿命,当加入Cu2+后荧光寿命降低,可能是由于主客体之间相互作用[33]造成的,随着HS-的加入,荧光寿命再次增加至原来化合物的水平,表明游离的化合物被释放出来.

图5 化合物1、探针1+Cu2+及探针1+Cu2++HS-的荧光寿命衰减曲线
2.4 检测限的测定
在DMSO溶剂中,通过紫外-可见光谱滴定测得探针1+Cu2+对HS-的检测限.如图6所示,探针在423 nm处的吸光度值为0.975,向探针中滴加HS-,当HS-浓度为1.12×10-4mol·L-1时,吸收强度降低了1.3倍.说明探针对HS-的检测限为1.12×10-4mol·L-1.

图6 探针1+Cu2+对HS-的检测限
2.5 干扰性试验


图7 共存离子对HS-的干扰性实验
2.6 圆二色光谱
在DMSO溶剂中,探针与HS-作用的圆二色光谱如图8所示.化合物1在220 nm处呈现出一个正的科顿效应,可能是由于苯环的π→π*引起的[34].当加入Cu2+形成探针后,峰值有所增加,这可能是因为Cu2+以刚性结构键相连,分子共轭成分增加,从而使电子吸收增强.再加入HS-后,发现峰值又降低到与化合物1本身相似,说明化合物1被释放出来成自由态.

图8 化合物1、探针1+Cu2+以及探针1+Cu2++HS-的圆二色光谱图
2.7 反应机制探讨
通过以上实验数据分析,探针1+Cu2+与HS-可能的作用机制如图9所示.化合物1中的杂原子N,O与Cu2+进行配位,通过UV-Vis确定了化合物1与Cu2+的结合比.在Job-plot实验中,保持化合物1与Cu2+两者之间的总浓度不变,改变两者之间的摩尔比例(1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1),通过紫外光谱测定不同比例下的吸收值,计算化合物1与探针1+Cu2+两者吸光度值的差值为最大值时两者的摩尔比即为两者的结合比.如图10所示,化合物1与Cu2+的结合比为2∶1.当向探针1+Cu2+溶液中加入HS-后,推测HS-与探针1+Cu2+发生取代反应,即HS-取代化合物1与Cu2+发生络合反应,最终将化合物1释放出来.
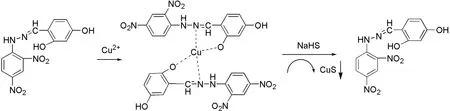
图9 探针1+Cu2+与HS-的反应机制

图10 化合物1与Cu2+的Job-plot曲线
2.8 细胞毒性实验
笔者通过CCK-8法评价了探针1+Cu2+对人肝癌细胞的细胞毒性.如图11所示,探针1+Cu2+在浓度为0~150 μg·mL-1内,细胞的存活率仍超过70.8%,表明探针1+Cu2+对细胞的毒性较小,进一步说明探针1+Cu2+对于体外H2S的检测具有很大的应用潜力.

图11 HepG-2细胞在0~150 μg·mL-1荧光探针下于37 ℃培养24 h后的细胞活力
3 结束语
作者设计合成了一系列含有苯肼类硫化氢荧光分子探针,并筛选出具有高选择性和高灵敏度的荧光探针1+Cu2+,通过紫外-可见光谱和荧光光谱等测定分析,在DMSO溶液中探针1+Cu2+对HS-的检测限为1.12×10-4mol·L-1,具有良好的选择性和灵敏度.以上研究表明,该苯肼类硫化氢荧光分子探针作用能力强、选择性好,为进一步检测生物体内H2S的水平奠定了基础.
