MicroRNA-139-5p靶向Bcl-2调控棕榈酸诱导的胰岛β细胞凋亡
2022-01-25孟祥健程锦瀚吴涵张妍姚新明
孟祥健程锦瀚吴涵张妍姚新明
(1. 皖南医学院第一附属医院,弋矶山医院内分泌科,安徽 芜湖 241001;2. 安徽省教育厅重大疾病非编码RNA转化研究重点实验室,皖南医学院,安徽 芜湖 241002)
随着经济发展和生活方式改变,2型糖尿病(type 2 diabetes mellitus,T2DM)的患病率不断攀升,已构成严重的公共卫生问题[1]。T2DM患者由于存在胰岛素抵抗,对脂肪分解的抑制作用减弱,游离脂肪酸(free fatty acids,FFA)生成增多。因此,T2DM患者往往存在脂代谢紊乱。升高的FFA能够损伤胰岛β细胞分泌功能以及促进β细胞凋亡,是T2DM病程进展的关键因素[2-3],但具体机制尚未完全阐明。微小RNA(microRNAs,miRs)是一类主要的非编码RNA,主要通过与相应mRNAs 3′非编码区结合进而负调控靶基因表达[4]。研究表明miRs在长期暴露于代谢应激(如葡萄糖、棕榈酸等)的胰岛β细胞表达异常,调控胰岛素分泌及细胞凋亡[5-6]。Li J等[7]报道miR-139-5p在糖尿病大鼠胰腺组织以及棕榈酸(palmitate,PA)孵育大鼠胰岛β细胞INS-1中表达上调,但miR-139-5p的具体功能尚需进一步探讨。本研究发现miR-139-5p在PA孵育的小鼠β细胞株Min6中表达升高,并且抑制B细胞淋巴瘤-2(protein B cell lymphoma-2,Bcl-2)表达进而调控Min6细胞凋亡。
1 材料与方法
1.1实验试剂 DMEM培养基和胎牛血清购自美国Gibco公司;Trizol试剂盒购自Thermo Fisher公司;cDNA合成试剂盒购自Takara公司;cleaved caspase 3抗体、GreenNucTM活细胞Caspase-3活性检测试剂盒和TUNEL凋亡检测试剂盒购自碧云天公司;Bcl-2抗体和小鼠胰岛素ELISA试剂盒购自Abcam公司;链脲佐霉素(Streptozocin,STZ)购自Sigma公司;血糖、总胆固醇和甘油三酯试剂盒购自南京建成公司。
1.2细胞培养及处理 Min6细胞(小鼠胰岛β细胞株)培养在DMEM培养基(Gibco)中,包含25 mM葡萄糖、10%胎牛血清、50 μM 2-巯基乙醇、100 U/ml青霉素和100 μg/ml链霉素。Min6细胞生长汇合到70%~80%,进行转染处理。其中pcDNA Bcl-2、pcDNA空载质粒、miR-139-5p mimic(miR-139-5p)、miRNA 阴性对照(miR-NC)、miR-139-5p抑制剂(anti-miR-139-5p)和 miRNA抑制剂阴性对照(anti-NC)购自广州锐博公司。Min6细胞转染48 h后,予以0.5 mM棕榈酸(PA)孵育后进行相关实验。
1.3小鼠实验 5周龄雄性C57BL/6J小鼠购自中国上海斯莱克实验动物有限责任公司[生产许可证:SCXK(沪)2017-0005]。小鼠适应7 d后,随机分配为正常或高脂饮食组(高脂饲料购自美国Research Diets公司,D12492)。喂养4周后,高脂饮食组小鼠腹腔注射STZ(60 mg/kg),1周后测空腹血糖,高于11.1 mmol/L的小鼠造模成功。T2DM模型组(DM)及对照组(Con)小鼠继续高脂或正常饲料喂饲4周,每组6只小鼠。8周后小鼠禁食过夜并采集血浆,比色法测定血糖、甘油三酯和总胆固醇浓度,ELISA试剂盒测定空腹胰岛素水平。
1.4实时荧光定量PCR(RT-PCR)检测 TRNzol提取Min6细胞或小鼠胰腺组织RNA,逆转录后检测miR-139-5p表达。引物序列如下,miR-139-5p为F:5′-GCTGTACCTCGAATGAATCC-3′;R:5′-TGGTGTCGTGGAGTCG-3′;U6为F:5′-CTCGCTTCGGCAGCACA-3′,R:5′-AACGCTTCACGAATTTGCGT-3′。
1.5Western blot检测蛋白表达 RIPA裂解液提取Min6细胞及小鼠胰腺组织总蛋白后,BCA法测蛋白浓度。通过SDS-PAGE凝胶电泳后,转移到NC膜上。用5%BSA封闭2 h后在NC膜中加入cleaved caspase 3(1∶500),Bcl-2(1∶1000)和tubulin(1∶2000)抗体4℃孵育过夜。室温下二抗孵育2 h。ECL显影并拍照。
1.6GreenNucTM检测细胞Caspase-3活性 加入5 μM GreenNucTMCaspase-3底物孵育Min6细胞30 min,可观察到凋亡细胞细胞核处的绿色荧光。DAPI染核后倒置荧光显微镜检测并计算凋亡阳性细胞百分比。
1.7荧光素酶报告实验 Min6细胞种板后,将含有miR-139-5p结合序列的野生型Bcl-2-WT或含有miR-139-5p结合位点中的突变序列Bcl-2-MUT和miR-139-5p mimic及miR-NC共转染48 h后测量荧光素酶活性。
1.8小鼠胰腺组织TUNEL及Bcl-2免疫组化染色 取部分小鼠胰腺组织用4%多聚甲醛固定,石蜡包埋,5 μm切片。按TUNEL试剂盒说明书加50 μl生物素标记液,37 ℃避光孵育60 min后显色。切片用Bcl-2(1∶300)抗体孵育后孵育2抗,DAB显色。

2 结果
2.1上调miR-139-5p诱导Min6细胞凋亡 如图1所示,miR-139-5p mimic转染后可以显著升高Min6细胞miR-139-5p表达(P<0.05),且凋亡标志蛋白cleaved capase3表达增高(P<0.05),凋亡Min6细胞数较miR-NC组显著增多(P<0.05)。
2.2抑制miR-139-5p改善脂毒性导致的Min6细胞凋亡 同文献报道相似[6],0.5 mM PA 孵育Min6细胞24 h和48 h后,miR-139-5p的表达均较Con组增高(P<0.05),cleaved capase3蛋白表达亦逐渐增高(P<0.05)。抑制miR-139-5p表达可显著降低PA孵育48 h的Min6细胞中cleaved capase3蛋白表达并降低凋亡细胞数(P<0.05),见图2。
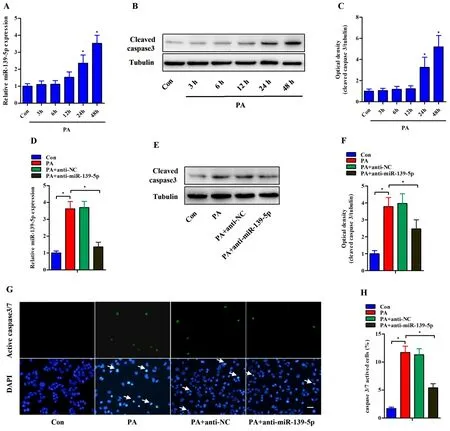
A:RT-PCR检测0.5 mM PA孵育不同时间的Min6细胞中miR-139-5p的表达。B和C:Western blot检测0.5 mM PA孵育不同时间的Min6细胞中cleaved caspase3蛋白表达。D:anti-miR-139-5p处理后,RT-PCR检测miR-139-5p表达。E和F:anti-miR-139-5p处理后,Western blot检测0.5 mM PA孵育48 h的Min6细胞中cleaved caspase3蛋白表达。G和H:anti-miR-139-5p处理后,GreenNucTM检测0.5 mM PA孵育48 h的Min6细胞Caspase-3活性。绿色荧光为细胞凋亡阳性信号,蓝色荧光为DAPI染色细胞核,标尺=50 μm。凋亡细胞百分比以直方图显示。结果以n=3~4个独立实验的表示,*P<0.05。
2.3miR-139-5p靶向Bcl-2 为探讨miR-139-5p调控Min6细胞凋亡的可能机制,本研究利用生物信息学软件miRDB筛选出miR-139-5p可能的靶基因为抗凋亡基因Bcl-2,即miR-139-5p能竞争性调控Bcl-2表达而影响细胞凋亡。共转染miR-139-5p mimic和Bcl-2-WT导致Min6细胞中荧光素酶活性明显降低(P<0.05),而与共转染miR-139-5p mimic和Bcl-2-MUT的细胞中荧光素酶活性差异无统计学意义(图3A和图3B,P>0.05)。敲减miR-139-5p可升高Min6细胞中Bcl-2的mRNA和蛋白表达(图3C~图3E,P<0.05)。PA孵育的Min6细胞中Bcl-2表达降低,而敲减miR-139-5p可部分恢复Bcl-2表达(图3F和图3G,P<0.05)。上述结果提示miR-139-5p竞争性结合Bcl-2并调控其表达。
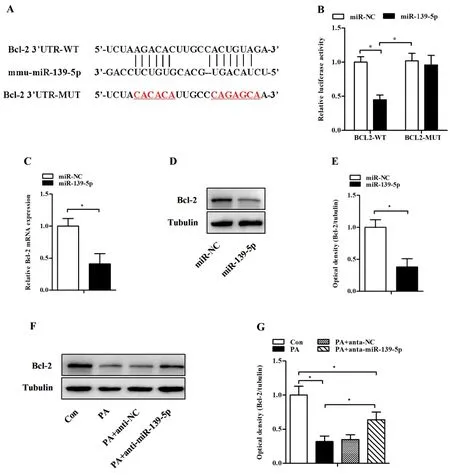
A:miR-139-5p和Bcl-2的预测结合序列。B:Min6细胞转染miR-NC、miR-139a-3p mimic、Bcl-2-WT和Bcl-2-MUT 48 h后测定荧光素酶活性。C~E:miR-139-5p mimic转染后,RT-PCR和Western blot检测Bcl-2的mRNA和蛋白表达。F和G:anti-miR-139-5p处理后,Western blot检测PA孵育Min6中细胞Bcl-2蛋白表达。结果以n=3~4个独立实验的表示,*P<0.05。
2.4过表达Bcl-2拮抗miR-139-5p的促凋亡作用 为进一步阐明miR-139-5p通过调控Bcl-2影响胰岛β细胞凋亡,本研究构建Bcl-2过表达质粒并验证其效能(图4A和图4B)。在Con或HPA孵育的Min6细胞,过表达Bcl-2均能降低miR-139-5p mimic诱导的cleaved capase3蛋白表达增高(图4C和图4D,P<0.05)及凋亡细胞增多(图4E和图4F,P<0.05)。
2.5miR-139-5p在T2DM小鼠胰腺组织表达上调 采用高脂饲料喂养联合STZ注射建立T2DM小鼠模型。如图5所示,DM组小鼠的血糖、胰岛素、甘油三酯和总胆固醇水平显著高于Con组小鼠(P<0.05)。与Con组相比,DM小鼠胰腺miR-139-5p表达明显上调(P<0.05)。此外,DM组小鼠胰岛TUNEL阳性凋亡细胞数显著增加,这与cleaved caspase3蛋白表达增加和Bcl-2蛋白表达减少有关(P<0.05)。

A和B:pcDNA Bcl-2转染后,Western blot检测Bcl-2的蛋白表达。C和D:miR-139-5p mimic+pcDNA vector和miR-139-5p mimic+pcDNA Bcl-2A分别转染Min6细胞,Con或HPA孵育后,Western blot检测cleaved caspase3蛋白表达。E和F:miR-139-5p mimic+pcDNA vector和miR-139-5p mimic+pcDNA Bcl-2A分别转染Min6细胞,Con或HPA孵育后,GreenNucTM检测0.5 mM PA孵育48 h的Min6细胞Caspase-3活性。绿色荧光为细胞凋亡阳性信号,蓝色荧光为DAPI染色细胞核,标尺=50 μm。凋亡细胞百分比以直方图显示。结果以n=3~4个独立实验的表示,*P<0.05。
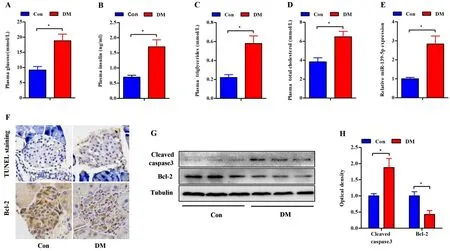
T2DM小鼠血浆空腹血糖(A)、胰岛素(B)、甘油三酯(C)和总胆固醇(D)水平较Con小鼠升高。E:RT-PCR小鼠胰腺组织中miR-139-5p的表达。F:TUNEL检测胰岛凋亡,免疫组化检测胰岛Bcl-2表达。G和H:Western blot检测小鼠胰腺组织cleaved caspase3和Bcl-2蛋白表达。n=6,*P<0.05。
3 讨论
持续暴露于FFA会促进胰岛β细胞凋亡,减少胰岛素分泌[8-9]。成熟的miR-139-5p在哺乳动物中高度保守,已被证明可抑制多种癌症的进展[10-11],并抑制3T3-L1前脂肪细胞分化[12]。在先前研究的基础上[7],我们进一步发现在高脂饲料喂养联合STZ注射建立T2DM小鼠胰腺组织中miR-139-5p表达上调。在小鼠胰岛β细胞株,即Min6细胞中,miR-139-5p在PA孵育后显著升高。在正常培养的Min6细胞过表达miR-139-5p后,细胞凋亡增加,抑制miR-139-5p表达可显著降低PA诱导的Min6细胞凋亡。上述结果表明miR-139-5p上调参与脂毒性导致的胰岛β细胞凋亡。
Bcl-2是重要的抗凋亡蛋白,但脂毒性导致Bcl2表达下调的潜在机制尚不清楚。在本研究中,我们通过报告基因分析阐明了miR-139-5p与Bcl-23′非编码区的直接相互作用,并证明miR-139-5p调控Bcl-2表达,即上调miR-139-5p可显著抑制Bcl-2的表达。抑制miR-139-5p可明显恢复PA诱导的Min6细胞Bcl-2表达下调。Bcl2过表达可拮抗miR-139-5p诱导的cleaved caspase3上调及细胞凋亡。这些结果提示PA诱导的Min6细胞凋亡可能与miR-139-5p靶向调控Bcl-2表达相关。
本研究阐明了miR-139-5p在FFA诱导胰岛β细胞增殖损伤中的作用,揭示了糖脂毒性导致β细胞受损的新机制,为胰岛β细胞保护开辟新的思路。
