肿瘤转移前微环境动物模型的构建与评价方法研究进展
2022-01-24申明陈彦文李杨杨玲玲梁乾坤明海霞
申明,陈彦文,李杨,杨玲玲,梁乾坤,明海霞*
(1.甘肃中医药大学,兰州 730000;2.甘肃中医药大学中西医结合研究所,兰州 730000)
根据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)全球最新癌症数据统计[1]:2020年全球新发癌症病例1929万例,死亡996万例。尽管目前随着靶向治疗及免疫治疗逐渐完善,但癌症死亡率仍居高不下,导致肿瘤患者死亡的主要原因就是转移。自Paget[2]1889年初次提出“种子和土壤”假说用于解释肿瘤的转移,在此基础上,Kaplan等[3]提出了转移前微环镜(pre-metastatic niche,PMN)这一概念,认为原发肿瘤来源的分泌因子在转移前特异性的到达待转移组织器官中,通过相互作用适应性的改变其微环境,从而构建一个适合原发肿瘤转移的生长环境,诱使循环中漂浮的原发肿瘤细胞在此处定植、聚集、增殖,最终形成转移病灶。目前,转移前微环境的研究模型以肺为主[4]。本文将围绕肿瘤微环境形成机制及肺转移前微环境模型构建与评价进行概述。
1 肿瘤转移前微环境的形成
肿瘤转移前微环境的形成机制比较复杂,主要与肿瘤细胞分泌因子(tumor-derived secreted factors,TDSFs)、抑制性免疫细胞的动员募集以及该组织部位基质成分炎性极化三个因素的相互作用有关。而TDSFs、髓源性抑制细胞(myeloidderived suppressor cells,MDSCs)是肿瘤转移的关键[3,5-6]。
TDSFs可通过直接动员和招募MDSCs来促进转移前微环境形成,其中包括促炎因子,如肿瘤细胞坏死因子α(tumor necrosis factor-α,TNF-α)、转化生长因子β(transforming growth factor-β,TGF-β)、血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A),它们会特异性地诱导肺部钙结合炎性蛋白S100A8/A9(S100 calcium binging protein A8/A9,S100A8/A9)的高表达,形成肺转移前微环境。目前作用明确的细胞主要有VEGFR1+造血祖细胞、CD11b+MDSCs。CD11b+MDSCs可以通过表达整合素、多功能蛋白聚糖(Versican)、基质金属蛋白酶(matrix metalloproteinases,MMPs)及在TDSFs作用下分泌多种趋化、炎症因子来动态重塑、建立转移前微环境,促进肿瘤干细胞特性和上皮间质转化(epithelial-to-mesenchymal transition,EMT),从而促进肿瘤发展[7]。
原位肿瘤细胞产生趋化因子-2(C-C motif chemokine ligand 2,CCL2)可招募肿瘤相关巨噬细胞和Treg,同时,CCL2通过与表面的CCR2相互作用增加MDSCs向转移前微环境迁移[8]。肿瘤细胞还通过分泌巨噬细胞迁移抑制因子(macrophage migration inhibitory factor,MIF)、白 细 胞 介 素(interleukin,IL)-8以及纤溶酶原激活物抑制因子1,激活星形胶质细胞进而分泌IL-6、TNF-α,参与肿瘤血管的构建。在CCL2作用下,CD11b+Ly6C+单个核细胞被招募到肺转移前微环境中对局部组织微环境进行改造从而增加肺转移。CD11b+Ly6G+Ly6C+粒细胞还可通过产生铃蟾多样性肽8(bombina variegate peptide,Bv8)蛋白促进肺转移前微环境形成,这些MDSCs是转移前微环境形成过程中的关键细胞成分[7-8]。由此可见,肿瘤细胞分泌的多种细胞因子,如TNF-α、TGF-β、VEGF-A等,可通过直接动员和招募骨髓中的MDSCs,促进转移前微环境的形成。
2 肿瘤的肺转移微环境模型
根据临床数据显示,肺是肿瘤转移常见的器官。大约30%的胃癌患者在中后期阶段会出现肺转移,骨肉瘤患者在远处转移器官中发生在肺部的概率高达90%,乳腺癌、结肠癌、黑色素瘤等均可表现出肺部高转移率[9-10],因此建立肺转移前微环境模型符合临床环境。该模型的建立能够更好的体现在转移前微环境中,多种细胞因子对肿瘤转移过程中不同的调控作用,有助于新型靶向抗肿瘤药物的设计、开发。此外,肺转移前微环境模型具有操作简便、成功率高等优点,可便于观察原发肿瘤转移的发生率及后续发展,为临床抗肿瘤治疗提供了现实依据,有助于制定可行化方案。
肺转移前微环境模型主要包括自发性转移模型和实验性转移模型。目前,人类肿瘤异种移植模型在临床前环境中帮助预测抗肿瘤功效最为常用,通过利用哺乳动物体内微环境所培养的人源性肿瘤细胞来模拟人类肿瘤的进展,动物的基质细胞、血管网和生长因子为肿瘤细胞提供了天然的异质微环境[11]。自发性与诱发性动物模型通常是由人工诱导的癌症动物组成,这些模型易于构建,但会存在较大的不确定性。通过移植人肿瘤组织或注射肿瘤细胞系来产生移植的动物模型能够显示出更高的可控性和致瘤效率,但不能反应肿瘤转移的整个生物学进程。
3 动物的选择及方法
建立实验动物模型,以试图捕捉人类肿瘤发展中复杂的病理过程为目的,长期以来,在临床前环境中提供了评估新型抗肿瘤药物潜力。动物模型能够较好的阐明哺乳动物生物过程的基本原理,而实验室小鼠通常是首选的模式生物,由于具有的高度遗传同源性和特定的无病原体(specific pathogenfree,SPF)维持条件,科学结果的再现性较高,现已在肿瘤定植和转移模型中广泛的使用[12]。
3.1 裸鼠
1969年,Rygaard等[13]首次成功地建立了裸鼠-人肿瘤异种移植模型,此模型很大程度上保留了人类肿瘤细胞在组织病理特征以及对抗肿瘤剂的敏感性,降低了实验和临床研究之间的差距。选择裸鼠建立转移模型,一方面,该小鼠无毛发覆盖,能够可视化观察肿瘤的发展,另一方面,由于存在先天性无胸腺、T淋巴细胞的功能缺乏等特点,裸鼠表现出明显的免疫功能受损,有利于肿瘤细胞的生长、定植和转移,建立肿瘤模型具有较高的成功率[14]。但其灵敏度较低,而Naomoto等[15]基于这一局限,将BABL/c裸鼠通过尾静脉注射人结肠癌细胞系RPM14788建立肺转移前微环境模型,在注射后的第2天,可在肺间质中观察到中性粒细胞浸润形成的炎性微环境,21 d的小鼠肺组织形成多发性转移灶,提示造模成功。该模型具有高度的肺转移率和可重复性,有助于研究肺转移途径且能够更加方便的评估药物疗效。裸鼠作为标准受体现已被广泛用于人源肿瘤异种移植模型(patient-derived xenograft,PDX),尤其体现在胃肠癌的高移植率。Wang等[16]通过BALB/c裸鼠尾静脉注射含人胃腺癌细胞系MGC80-3成功建立肺转移模型,指出MMP-2、MMP-9在胃癌细胞转移过程中过度活化,转移前的微生境中诱发EMT,其标记物β-连环蛋白、E-钙粘蛋白的基因水平降低,而纤连蛋白、波形蛋白和Snail蛋白的表达水平增加。王洁等[17]将临床所获胃癌标本移植到BALB/c裸鼠中建立异种移植模型,之后将荧光染剂MHI-148进行腹腔注射,经检测,微环境中转移瘤趋化因子CXCL12、MMP-2和转移相关IGF1R信号通路等表达上调,最终在小鼠肺组织中可观察到转移灶。Li等[18]选择BALB/c裸鼠,分别通过尾静脉注射和腹腔注射COL10A1敲除的MKN45胃癌细胞建立了胃癌肺转移模型,证明敲除COL10A1可降低EMT,下调MMP-2、MMP-9的表达,从而抑制转移前微环境的形成,以上两种方法均成功地建立了胃癌肺转移前微环境模型。
3.2 SCID小鼠
Bosma在1993年首次定义了同时缺乏功能性T、B淋巴细胞的严重联合免疫缺陷(Server Combined Immune-deficiency,SCID)小 鼠。Knips等[19],首次采用动物模型来研究Merkel细胞多瘤病毒感染对MCC皮肤癌发生、转移作用,选择SCID小鼠肩胛骨皮下注射WaGa和MKL-1皮肤癌细胞,结果显示与MKL-1细胞相比,WaGa肿瘤在转移前微环境中参与炎症反应、生长因子活性及上调Wnt信号通路,更具有侵袭性,在肺中表现出了更高数量的自发性转移。Otani等[20],通过选择SCID小鼠分别原位注射A549人肺腺癌细胞、FT821人大细胞肺癌细胞和PC-9人肺腺癌细胞建立肺癌肺转移前微环境模型,给予抗癌药物CDDP和埃罗替尼进行干预。结果仅检测到A549模型小鼠存在肺转移,且经CDDP治疗后肺部转移情况并未改善,可能与观察到的强烈的氟代脱氧葡萄糖(fludeoxyglucose,FDG)摄取有关,此研究中的异种原位移植模型有潜力成为开发抗癌新疗法的基本工具,可用于许多非小细胞肺癌细胞系和抗癌药物。大量研究表明与裸鼠相比,选择SCID小鼠建立的肿瘤转移模型成功率更高,但存在着T、B淋巴细胞渗露的局限性[21]。
3.3 NOD-SCID小鼠
NOD/SCID小鼠是由NOD和SCID小鼠杂交而成,该小鼠患有由T淋巴细胞浸润和胰岛破坏引起的糖尿病,由于小鼠中成熟T、B淋巴细胞的缺失,NK细胞功能受损等先天和适应性免疫的多种缺陷,使它们成为人类造血干细胞和实体瘤移植更好的受体。然而,在NOD/SCID小鼠中仍存在残留的NK细胞活性[22]。外周血中的循环肿瘤细胞(circulating tumor-cell,CTC)在适合的局部微环境下进入次级或远端器官组织形成转移灶,微环境中的免疫细胞可经历表型变化变成促肿瘤表型,协助肿瘤细胞免疫逃逸以及向远处的组织器官迁移。阙祖俊等[23],在前期实验中成功建立了非小细胞肺癌循环肿瘤细胞系(CTC-TJH-01),通过尾静脉注射法,将GFP/Luc双标的CTC-TJH-01细胞系在NODSCID小鼠中成功地构建了肺癌肺转移前微环境模型,尽可能模拟临床术后肿瘤转移过程,将转移前微环境免疫因素归入评估系统,可用于研究免疫疗法对肿瘤转移的抑制作用。Chiou等[24]将A549肺癌细胞通过尾静脉注射植入NOD-SCID小鼠建立转移模型,以评估卵泡刺激素在器官转移中的作用,所有小鼠肺中均可检测到转移瘤的形成,发现卵泡刺激素可能通过肿瘤细胞和器官微环境之间的相互作用抑制转移前微环境中的血管生成。NOD/SCID小鼠现常用于结直肠癌肺转移前微环境模型构建。Hite等[25]选择NOD-SCID小鼠,通过将荧光素酶标记的HT-29结肠癌细胞采用直肠注射、盲肠壁注射、酸性灌肠等方法成功建立结肠肺转移模型,结果相较其余两组,直肠注射组小鼠肺转移较高且死亡率低,能较好的模拟患者结肠癌的转移进程,是目前用于患者结肠癌转移评估最理想的原位转移模型。实验室在NOD-SCID小鼠的基础上,将其与IL-2受体γ缺陷小鼠或Jak3缺陷小鼠杂交,建立了NK细胞功能性缺失的NOD-SCID-IL2rg-/-(NOG/NSG)小鼠[22]。该小鼠主要体现出对人源化组织的高移植率,有研究显示,将TMD231人乳腺癌细胞分别植入NOD/SCID和NSG小鼠的乳腺脂肪垫中建立乳腺癌肺转移模型,结果显示NSG小鼠的成瘤率更稳定,且更早发现肺转移[26]。Armacki等[27]将Panc1人胰腺癌细胞皮下注射至NSG小鼠中建立胰腺癌肺转移模型,得出外泌体可调控S100 A mRNA向肺成纤维细胞中转移,肺转移灶纤维化增强,粘连蛋白表达增加,从而促进肺转移前微环境的形成。为阐明肿瘤干细胞(CSCs)在转移中的潜在作用,Matsuda等[28]选择NOG小鼠,将PDAC人胰腺癌细胞通过尾静脉注射建立了胰腺癌肺转移模型,且发现肺中CSC标记物高表达,证实PDAC转移潜能与CSC和EMT相关。但由于NOG/NSG小鼠饲养环境严格且价格相对高昂,故目前在肿瘤转移前微环境的动物模型中鲜少使用。而其他品系在不同癌症类型中都存在各自的优势,因此仍是建立肿瘤转移模型重要的资源。
3.4 BABL/c小鼠
BABL/c小鼠对小鼠乳腺肿瘤病毒诱发的乳腺癌具有高度敏感性,是建立乳腺癌转移最常用的动物模型。骨肉瘤的胫内原位注射模型,在过去通常被认为是自发转移的模型,Maloney等[29]对此提出质疑,通过将K7M2骨肉瘤细胞系胫骨内注射至BALB/c小鼠中,注射后1周,通过肉眼观察及HE染色均发现全部小鼠肺部表面有明显转移灶,而在第4周,93%的小鼠在骨髓内形成肿瘤组织。并建立了截肢组模型以确定转移细胞的来源,所得结果均指向该模型应为实验型转移模型。胫内注射模型提供了一种可行的造模方法,但存在注射时肿瘤细胞栓塞这一局限。尽管如此,该模型可用于检查转移后期阶段,如肿瘤细胞外渗及在肺转移前微环境中的过度增殖。Warren等[30]通过细胞转染技术获得ZsGreen/Luc双标的4T1细胞和YAP/TAZ敲除细胞分别经尾静脉注射至BALB/c小鼠中,以测试转肿瘤移是否需要Yes相关蛋白(Yes-associated protein,YAP)和具有PDZ结合序列的转录共活化因子TAZ(transcriptional coactivator with PDZ-binding motif,TAZ)。经用荧光显微镜观察到发光信号,提示造模成功,结果显示对照细胞的小鼠的转移负荷增加速度明显快于YAP/TAZ敲除小鼠。为探讨乳腺癌肺转移前微环境中免疫因子的动态变化,朱文文等[31]通过尾静脉注射和皮下注射两种方法,分别将4T1乳腺癌细胞接种到BABL/c小鼠中,两种方法均成功建立了乳腺癌肺转移前微环境模型,相较于皮下注射法,尾静脉注射法的转移过程较为迅速,并测得肺组织中的Th1型细胞因子在尾静脉组中表现出先升后降的趋势,在皮下注射组处于较低水平,而Th2型细胞因子在两组中均表现出升高的趋势,提示随着癌症发展,可形成免疫抑制微环境促进肿瘤细胞的转移。Rashid等[32]将表达荧光素酶基因的4T1-luc2乳腺癌细胞系对BABL/c小鼠分别进行原位移植法与尾静脉注射法来比较其中的差异,两种造模方式均可达到理想的成瘤率,并对转移瘤进行了基因组微阵列分析以评估不同方法所致转移瘤的基因组图谱,结果提示尾静脉法与术后转移瘤的基因表达没有显著差异。这也是尾静脉法的一大优势,值得一提的是,尾静脉注射法由于不能实现从原发肿瘤到转移病灶的全过程,故此造模方法仅适用于肿瘤发展的中后期阶段的临床研究。
3.5 C57BL/6小鼠
C57BL/6小鼠是一种最常用的近交系小鼠,由于其在遗传方面较为稳定,往往是转基因动物模型构建的首选。Hou等[33]将非靶向基因LLC-sgNTC和Atrx缺陷型Lewis细胞系(LLC-sgAtrx)通过尾静脉注射到C57BL/6小鼠中,结果显示小鼠肺中均产生了转移灶。并证明Atrx缺陷促进了转移前微环境中T细胞的浸润,提高了细胞程序性死亡-配体1(programmed cell death 1 ligand1,PD-L1)和抗原肽-MHC分子复合物Ⅰ类(peptide-major histocompatibility complex class I,pMHCI)在Lewis细胞表面的表达,并增强了T细胞的体外细胞毒性。Zhang等[34]为探讨RGDV-吉西他滨对肿瘤转移的作用途径,同样选择C57BL/6小鼠,将Lewis肺癌细胞注入右腋下皮肤成功建立肺癌肺转移前微环境模型。经检测治疗组小鼠血清中肿瘤坏死因子(tumor necrosis factor)TNF-α、IL-8、MMP-2和MMP-9的表达水平降低,提示RGDV-吉西他滨对转移前微环境有抑制作用。该小鼠也是作为研究黑色素瘤经常选择的动物模型[35]。Fu等[36]尾静脉注射B16F10-Fluc黑色素瘤细胞与体外活化的Pmel-1 CD8+Teff细胞至C57BL/6小鼠中,对照组小鼠检测到肺表面有大量转移结节,而由于免疫记忆,Teff组中CD69、CD25的高表达说明了CD8+T细胞被充分激活。王佳等[37]采用尾静脉注射将B16F10黑色素瘤细胞分别注射到C57BL/6和巨噬细胞Act1表达被靶向抑制的小鼠(anti-Act1)中成功建立黑色素瘤肺转移前微环境模型。相较C57BL/6模型组,anti-Act1小鼠肺组织中的CD45和CD68表达明显降低,转移前微环境中炎症细胞的浸润能力被抑制。孟星君等[38]分别采用腹腔注射、皮下注射及尾静脉注射法将C57BL/6小鼠接种B16F10黑色素瘤细胞,结果显示尾静脉组肺部转移率最高,说明肿瘤细胞主要通过血液循环途径实现转移,转移前微环境中血管的生成是主要推动因素。Sohn等[39]将B16F10-shControl细胞和B16F10-shAhnak细胞通过尾静脉注射至C57BL/6小鼠中,探讨桥粒联结蛋白(recombinant desmoyokin,AHNAK)在肿瘤转移过程中的作用,成功建立了黑色素瘤肺前微环境模型,证明了AHNAK参与TGF-β诱导的EMT,有助于肿瘤细胞的迁徙。关于肿瘤肺转移前微环境模型常见的动物选择及方法如表1所示。

表1 肿瘤肺转移前微环境模型动物选择及造模方法Table 1 Selection of animals and modeling method of the pre-metastasis niche of lung model
4 肺转移前微环境模型的评价方法
模型构建是实验研究进行的前提,现如今随着技术不断完善,多种方法可供选择作为评价模型构建是否成功的指标。当选择模型时,应当尽可能地选择与人类癌症相似的模型为其设计干预疗法。例如,动物肿瘤模型发病机制、进展和分期、病理因素、转移潜能、肿瘤负荷程度、激素反应性和免疫抑制等与人类是否相似,能否适合针对治疗术后环境中的转移性疾病的测试疗法。在肺转移前微环境模型构建中,HE染色法(hematoxylin and eosin stain)是常见的评价手段,所得成功率为100%[40]。荧光素酶(luciferase)和绿色荧光蛋白(green fluorescent protein,GFP)现已被广泛用于细胞生物学、肿瘤学等多种研究,其可作为一种细胞标记物为研究人员提供了检测基因表达和细胞跟踪的方法[41]。生物发光成像是一种高度敏感、高通量的技术,其能够使实验动物的疾病进程呈现可视化并对治疗效果进行纵向评估,检测到的光信号作为肿瘤负荷的定量指标,已在许多肿瘤模型中得到验证[42]。使用荧光作为检测和量化转移的方法,能够更直观地分析候选基因如何影响肿瘤细胞的转移、定植,可以给研究人员提供独立的数据,提高结果的可信度,然而由GFP转染引起的细胞损伤可能会导致对实验结果有一定的误差,因此在实验过程中应仔细考虑GFP对细胞的毒性作用。
正电子发射断层显像(positron emission tomography,PET)是近几年发展迅速的诊断技术,现已被用于评估肿瘤发生发展、转移过程中的代谢途径,其原理为放射性标记的正电子发射断层扫描底物在生理浓度下进行追踪,从而可以对肿瘤模型和肿瘤异质性进行无创成像[43]。另外,对肿瘤转移相关的目标基因及特异性生物标记的定性分析也可作为模型建立的评价指标,通常涉及免疫组化、蛋白印迹分析、实时定量PCR等多种方法。
5 总结和展望
癌症是目前危害人类健康的主要疾病,其转移是导致死亡的主要原因之一,“肿瘤转移前微环境”的提出无疑是一个突破点,抑制PMNs的形成,对肿瘤的复发和转移会有一定的积极作用。癌症发展到中后期,原发性肿瘤不断增值,器官和组织发生病理性改变,形成以低氧、低pH、组织高压为特点的微环境,在适合的局部微环境下,存在于外周血中的循环肿瘤细胞才能“播散”、“定植”、进入次级或远端器官组织,从而发展为转移灶。因此能否对转移前微环境进行干预来达到抗肿瘤作用,从而发现新型药物及疗法,现已成为热门的研究问题。
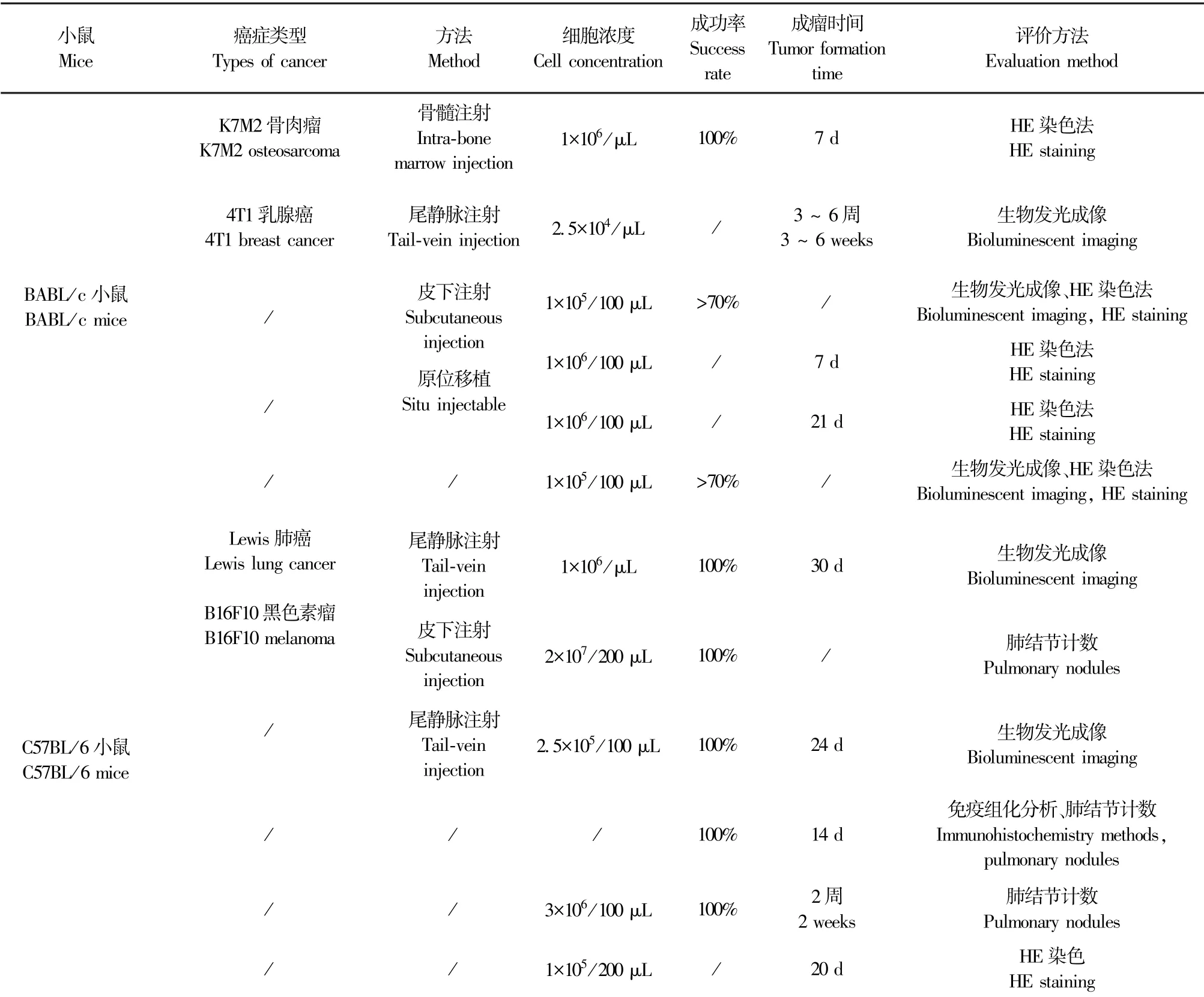
续表1
尽管多数研究人员认为动物模型能够提供关于新型免疫疗法和药物等有价值的临床前信息,但部分肿瘤模型并不能很好地预测人类临床试验,存在着因模型建立不充分而导致多种不可控因素的存在,从而影响结果可行性,这也是为什么实验效果不能在临床中得到体现。因此,无论采用何种模型来评估新疗法,理解每种方法的局限性都是至关重要的。
