C型产气荚膜梭菌产α毒素能力分析及免疫原性试验研究
2022-01-24李生庆张西云胡国元阿宝地刘怀新韩生义李长云祁果李淑萍石田
李生庆,张西云,胡国元,阿宝地,刘怀新,韩生义,李长云,祁果,李淑萍,石田
(1.青海大学畜牧兽医科学院,西宁810016;2.青海省玉树市畜牧兽医站,玉树815000;3.青海省海晏县畜牧兽医站,海晏812220;4.青海大学农牧学院,西宁810016)
产气荚膜梭菌(Clostridum perfringens)又称魏氏梭菌(Clostridum welchii),依据其主要致死性毒素与其抗毒素中和试验,可将此菌分为A、B、C、D、E 5个 型[1]。其中C型产气荚膜梭菌的主要毒力因子为α、β1和β2毒素,这3种毒素毒力均很强,且均具有良好的免疫原性[2,3]。是引起动物出血性、坏死性肠炎和肠毒血症的主要病原菌。临床表现为羊猝死症,其发病急、病程短、死亡率高,给养殖业造成严重的经济损失[4,5]。
目前,对于该病主要采取疫苗免疫预防为主。然而,在青海曾多次发生免疫羊只发病的现象,结合彭小兵等[6]对预防猝狙的梭菌类疫苗的总产量及效检结果的统计发现,C型产气荚膜梭菌各组分不合格的占21批(63.6%)的调查结果[6],推测是疫苗免疫力差导致羊猝疽的连续发生。为了提高羊猝疽疫苗的免疫保护力,本研究对病死羊体内分离的19株C型产气荚膜梭菌菌株进行16S rDNA分子鉴定,并通过产毒试验及免疫试验,筛选出具有代表性的1株海C1菌株,在提高该菌株产毒素能力的基础上,研制成羊猝疽菌苗,进行了家兔及本动物免疫试验,以期有效地预防和控制绵羊羊猝疽的发生和流行。
1 材料与方法
1.1 材料
1.1.1 菌株1974—1990年,由本试验室分离鉴定的羊源C型产气荚膜梭菌19株,菌株名称暂定为C8016、C805、C8老、CP8、WLC、海C2、C6802、WCJ、海C1、他1、C691、海溶小、C592、C721、CD2、WB1、B4、C591、B12。
1.1.2 试剂细菌基因组DNA提取试剂盒及质粒提取试剂盒购自宝生物技术有限公司。
1.1.3 实验动物昆明系小白鼠,体重16~18g,购自青海省地方病研究所小动物繁殖基地;实验用家兔,体重1.5~2 kg,购自青海省互助县家兔养殖基地;实验用羊,体重20~22 kg,由青海省海晏县兽医站协助提供。
1.1.4 培养基配制自制培养基,115℃灭菌50 min,压下pH值8.5。
1.2 方法
1.2.1 分离菌株生物学特性分析
1.2.1.1 菌株产毒能力评估将19株C型产气荚膜梭菌分别接种至自制的VF复合培养基中,37℃厌气培养24 h后,将上述培养物4 mL转移至离心管中,4000 r离心10 min,上清液用1.0%蛋白胨水递倍稀释后,用16~18g昆明系小白鼠静脉注射测定毒力。
1.2.1.2 分离菌株16S rRNA鉴定及系统进化树的构建分别取1.2 mL上述菌株24 h纯培养物于1.5 mL dorf管中,12000r/min离心1 min,弃去上清液,按DNA提取试剂盒要求提取基因组DNA。采用16S rRNA通用引物P3和P4,引物序列分别为
P1:5-AGAGTTTGATCCTGGCTCAG-3;P2:5’-GGTTACCTTGTTACGACTT-3。以提取的基因组DNA为模板进行PCR反应。PCR反应 在50 μL体系中进行,扩增条件为95℃5 min、95℃30s、54℃45s、72℃1 min,30个循环后,72℃延伸10 min。利用OMEGA公司购买的Gel Extraction Kit按说明书提取目的片段,电泳检测后送样测序。通过NCBI提供的BLAST在线搜索服务软件获取其他产气荚膜梭菌16S RNA基因组核酸序列。使用MEGA5.0软件的系统发育树构建功能对基因序列进行分析,选择邻近法构建系统发育树,分析不同分离株基因间的进化关系。
1.2.2 提高C型产气荚膜梭菌产毒能力将筛选出的地方菌株通过最佳培养基配方、调整pH值以及确定最佳产毒时间等参数,最终确定C型产气荚膜梭菌高产毒最优培养方式。
1.2.2.1 不同培养条件下不同培养时间菌株产毒能力分析将制备好的不同菌株种子按2%的比例分别无菌接种至10000 mL 4种不同配方VF培养基中(Ⅰ组:胰蛋白胨+糊精+调pH值;Ⅱ组:胰蛋白胨+糊精+不调pH值;Ⅲ组:示胨+葡萄糖+调pH值;Ⅳ组:示胨+葡萄糖+不调pH值),37℃厌气培养,自接种后3 h开始抽样,每隔1 h抽样,4000 r离心10 min,上清液用1.0%蛋白胨水递倍稀释后,用16~18 g昆明系小白鼠静脉注射测定毒力。分析不同培养条件下不同培养时间菌株产毒能力,筛选最优培养方法。
1.2.2.2 生长过程中调节pH值对菌株产毒的影响在上述实验的基础上,在菌株培养过程中培养物中定时滴加20%的NaOH溶液,调整培养液的酸碱度,并抽样检测毒力,判定生长过程中调节pH对菌株产毒的影响。
1.2.3 羊瘁狙地方菌株菌苗的制备及免疫效果检测
1.2.3.1 菌苗制备利用高产毒海C1地方菌株,结合筛选的最优培养基配方进行大瓶培养,生长6~8h后,按0.5%的剂量加入甲醛,置于37℃杀菌、脱毒72h,经无菌检验后按菌液4份+铝胶1份,每毫升菌苗含氢氧化铝胶为7 mg,按万分之一的量加入1%硫柳汞溶液,充分混合后,分装。
1.2.3.2 家兔免疫攻毒试验取1.5~2.0 kg家兔10只,免疫组8只(每组4只),分为1.0 mL和0.2 mL两个免疫组,均为肌肉注射;对照组2只。免疫21d后,按家兔最小致死量300 MLD/mL(小白鼠静注)攻毒,记录死亡情况。
1.2.3.3 本动物免疫攻毒试验及血清效价测定将羊只随机分为2组,每组4只,每批菌苗按0.5 mL、2.0 mL分别免疫1组,免疫21d后颈静脉采血3~5 mL,置4℃冰箱过夜,待血清析出后,按组别吸出血清待用;同时进行攻毒试验,观察记录死亡情况。
2 结果
2.1 菌株形态及毒力测定
在VF培养基中,37℃培养24h,革兰氏染色呈阳性,菌体两端钝圆,呈粗杆状(见图1);19株菌中毒力达4000 MLD/mL(小白鼠静注)1株(海C1株);3000 MLD/mL的4株(721、海C2、海溶小、他1);2000 MLD/mL 3株(691、乌B1、591);1000 MLD/mL 4株(P8、8016、6802、达2);500 MLD/mL 1株(592);200 MLD/mL 2株(乌兰羔、B12);100 MLD/mL 1株(B4)(见图2)。
图1 常规培养下的菌体形态图
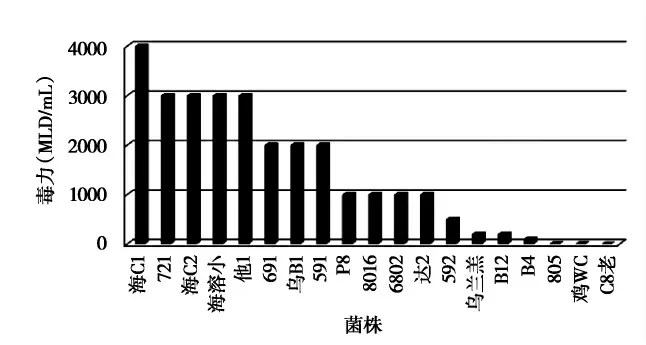
图2 19株C型产气荚膜梭菌产毒能力比较图
2.2 基因组16S rRNA基因扩增与序列分析结果
对其中9株菌获取的菌体DNA经16S rRNA通用引物PCR扩增后,1.5%琼脂糖凝胶电泳检测,结果显示均在1450bp处出现条带,与预期的片段大小一致(如图3所示)。将PCR扩增得到的产物送基因公司测序,并利用DNA Star软件将得到的序列与GenBank公布的C型产气荚膜梭菌、肉毒梭菌参考毒株进行比对,并进行同源性分析,结果表明,其中的高产毒海C1菌株的基因与制苗用参考菌株(C691株)(Clostridium novyi)基因高度同源,同源性均在99.5%以上(如图4所示)。
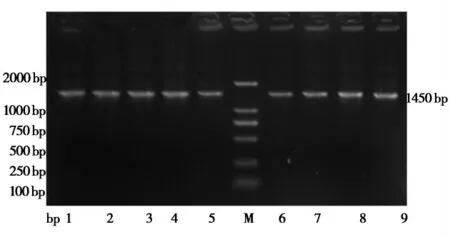
图3 9株地方分离菌株16S rRNA扩增结果
图4 菌株系统进化树示意图
2.3 不同培养方式下菌株产毒素能力分析
2.3.1 4种培养组合方式下的产毒分析 培养基中加胰蛋白胨和示胨的产毒效果相同,碳源以糊精或葡糖糖均可。调整pH值后,产毒均能达到5000~6000 MLD/mL,并对毒素毒力的维持具有一定效果,但毒素在24h后降解严重(见图5)。

图5 海C1菌株在四种培养组合方式下的产毒分析
2.3.2 生长过程中调pH值对产毒的影响调pH值组,2h产毒为2000 MLD/mL(小白鼠静注);3~6h,毒力为5000~6000 MLD/mL(小白鼠静注);不调pH值组,3~4h产毒为2000 MLD/mL(小白鼠静注);5h即降至2000 MLD/mL(小白鼠静注)以下。实验结果证明,调pH值不仅可提高产毒量,且可在3~6h内保持较高毒素水平(见图6)。
图6 生长过程中调pH值对产毒的影响示意图
2.4 疫苗免疫试验结果
2.4.1 家兔攻毒试验结果2.0 mL免疫组,可抵抗1.5 MLD/mL家兔致死量(4/4保护);1.0 mL免疫组,可抵抗1.0 MLD/mL家兔致死量(4/4保护);0.5 mL免疫组,可抵抗1 MLD/mL家兔致死量(3/4保护);对照组2只家兔攻1个家兔致死量均死亡(见表1)。
表1 201901批羊猝狙氢氧化铝菌苗效力检验结果表
2.4.2 绵羊攻毒试验结果试验测得绵羊最小致死量为1500 MLD/mL(绵羊静脉注射)。攻毒试验结果显示,2.0 mL免疫组,最高可抵抗16个羊单位的毒素攻击,0.5 mL免疫组,最高可抵抗4个羊单位的毒素攻毒(1/2保护)(见表2)。
表2 羊瘁狙自制菌苗对绵羊的攻毒试验结果
2.4.3 绵羊免疫血清抗体测定结果按照《中华人民共和国兽药典》的方法测定血清对C型产气荚膜梭菌毒素的中和效价[7]。免疫21d后,2.0 mL免疫组0.1 mL血清可中和12 MLD的毒素量,0.5 mL免疫组0.1 mL血清可中和8 MLD的毒素量(见表3)。
表3 绵羊疫苗免疫21d后免疫血清中和效价测定结果
结果判定:2 mL免疫组血清0.5 mL可中和60 MLD的毒素,即0.1 mL血清可中和12 MLD的毒素;0.5 mL免疫组血清0.5 mL可中和40 MLD的毒素,即0.1 mL血清可中和8 MLD的毒素。
3 结论
从19株分离的地方菌株中筛选出1株(海C1菌株)C型菌株,该菌株具有良好的产毒性能,在含1.0%葡萄糖,pH值8.4~8.6的VF培养基中,通过生长过程中调整pH值,36℃3~6 h产毒最高可达7000 MLD/mL;利用该菌株研制的灭活菌苗对家兔的免疫保护力是1~1.5 MLD/mL(家兔静注),对绵羊的免疫保护力是4~16 MLD/mL(绵羊静注)。免疫羊血清抗体效价达8~12 MLD/mL(小鼠静注)。该分离株具有较强的产毒稳定性和较好的免疫原性,可作为羊猝疽疫苗生产备用菌株。
4 讨论
4.1 在由产气荚膜梭菌所引起的众多家畜“猝死症”的研究报道中,外毒素一直被认为是致动物死亡的主要原因之一[8]。目前,我国用于预防羊猝狙的疫苗主要有羊快疫、猝狙、肠毒血症三联灭活疫苗和羊梭菌病多联干粉灭活苗等。Haagsma[9]指出,产气荚膜梭菌致病是由于它们分泌的毒素和代谢产物导致,无毒素产生就不会出现临床症状。柴同杰等[10]也提出同样的观点,即肠源毒血症是该病快速发病死亡的主要原因。免疫接种是保护的首选措施,疫苗的抗原成分应为类毒素,才能达到可靠的保护效果[11]。因此,C型产气荚膜梭菌疫苗的预防重点应当在对其所分泌外毒素研究的基础上,研制类毒素疫苗。首先要求制苗菌液中毒素的毒力达到一定标准,才能得到高效疫苗,获得良好的免疫效果。本研究对分离的19株菌株及1株制苗菌株的产毒能力进行了对比分析,在合适的培养基上,TB05菌株的产毒能力远远高于其他菌株的产毒能力,且产毒稳定性高,平均能达到7000 MLD/mL,远高于现用疫苗规程规定1000 MLD/mL的产毒最低要求[12],用此菌株所产毒素制成的羊猝疽菌苗对家兔及绵羊具有良好的免疫保护力。
4.2 C型产气荚膜梭菌虽同属于产气荚膜梭菌,但其培养及产毒特性与其他菌存在明显差异,本实验在确定了疫苗候选株之后,对培养条件以及培养基成分进行了摸索和改良。本实验通过对产毒过程的观察研究分析以及间断性取样毒力测定,确定在培养后3~5 h毒素量达到高峰期,随后毒力快速下降(见图6),但通过生长过程中调整pH值,可适当减缓毒素的降解速率。另外,毒素快速降解对于最终抗原浓度的变化以及疫苗免疫效果的影响还需进一步研究。
