Graves病合并甲状腺毒症性心脏病的影响因素及其预测价值
2022-01-24李冰川孙文忠
覃 苑,李冰川,孙文忠
(广西科技大学第二附属医院 1.内分泌代谢科;2.耳鼻咽喉-头颈外科,柳州 545000;3.广西甲状腺肿瘤精准防治研究重点实验室,柳州 545000)
甲状腺功能亢进症(甲亢)80%以上由弥漫性毒性甲状腺肿(Graves 病)引起,高水平甲状腺素对心脏机能产生毒性作用,引发甲状腺毒症性心脏病(thyrotoxic heart disease,THD)。THD 占甲亢患者的5%~10%,是导致患者死亡的严重并发症[1]。现有的研究已证实肌酸激酶、肌钙蛋白、钠尿肽水平可直接反映心肌损伤、心功能失代偿程度[2-3],但此时心脏往往已发生器质性病变,治疗效果不佳。在心肌损伤代偿早期的众多病理生理机制中,炎症反应与氧化应激在心肌细胞的电重构、结构重构中起重要作用[4]。研究发现血尿酸、中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)、红细胞分布宽度(red blood cell distribution width,RDW)作为炎性反应的标志物是主要心血管事件、心力衰竭的独立危险因素[5-7]。高水平的甲状腺素是否直接或间接地通过炎症应激途径损伤心肌,目前相关的研究较少。本文旨在分析Graves 病合并THD 的影响因素及其预测价值,以期为THD的早期干预提供临床指导。
1 对象与方法
1.1 研究对象 本研究为单中心、病例对照研究。选择2017 年6 月至2020 年9 月广西科技大学第二附属医院收治的Graves 病合并THD 的患者为病例组(n=86 例),同时选择同时期在本院收治的单纯Graves 病患者为对照组(n=120 例)。病例纳入标准:(1)对照组符合Graves 病诊断标准[8],同时无原发性或继发性的心脏疾病;(2)病例组符合美国心脏病协会制定的THD 诊断标准[9];(3)年龄≥18 周岁;(4)1个月内未使用经验证可影响本研究指标的治疗(如:抗心律失常药物、碘造影剂、利尿剂、放射碘等)。排除标准:(1)恶性肿瘤、多发内分泌腺瘤、伴瘤内分泌综合征等疾病;(2)冠心病、肺心病、风湿性心脏病等其他原因引起的心脏病;(3)血液疾病、风湿免疫疾病、药物、放化疗、脾功能亢进、急性感染、输血等引起的,或不明原因引起的血细胞数量、分布异常;(4)妊娠、精神疾病患者;(5)临床资料不完整者。本研究患者均已签署知情同意书并经过广西科技大学第二附属医院医学伦理委员会批准。
1.2 资料收集与定义 收集患者性别、年龄、既往病史、体格检查资料以及实验室检查资料等。患者一般资料通过本院电子病历系统收集。空腹采集外周静脉血,测定相关检验项目[载脂蛋白A(ApoA1)、载脂蛋白B(ApoA2)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4);促甲状腺激素(TSH);抗甲状腺球蛋白抗体(TgAb);血尿酸;中性粒细胞;淋巴细胞;红细胞分布宽度(RDW)],需排除有溶血、凝血及脂血等情况的血液标本,所有检验项目及心电图、心脏B 超及胸片等器械检查由广西科技大学第二附属医院相应检验科、医技科室严格按照操作技术规程完成,并准确记录检验时间及结果。NLR=中性粒细胞绝对值/淋巴细胞绝对值。心功能评估参照NYHA分级标准[3]。
1.3 统计学方法 采用R 3.5.1(https://www.r-project.org/)进行数据分析。正态分布计量资料以均数±标准差()表示,组间比较采用独立样本t检验;偏态分布计量资料以中位数(四分位数)[M(P25~P75)]表示,组间比较采用Wilcoxon 检验。计数资料以百分率(%)表示,组间比较采用χ²检验。采用Logistic回归分析影响Graves病合并THD的因素,将单因素Logistic回归分析P<0.15的因素及专业上认为可影响Graves 病合并THD 的因素纳入多因素Logistic 回归,并执行逐步回归。采用受试者工作特征曲线(ROC 曲线)评估各影响因素对Graves 病合并THD 的预测价值,计算ROC 曲线下面积(AUC)、准确性、敏感度、特异度、阳性预测值和阴性预测值。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 本研究共纳入206 例患者进行分析,其中病例组86例(41.7%),男女比例为:1∶3.29,平均(48.02±14.07)岁;对照组120 例(58.3%),男女比例为:1∶1.32,平均(45.31±11.39)岁。两组临床资料比较发现,无论是对照组还是病例组,女性占比均高于男性。性别、血尿酸、中性粒细胞、淋巴细胞、NLR 和RDW 比较,差异有统计学意义(均P<0.05)。见表1。
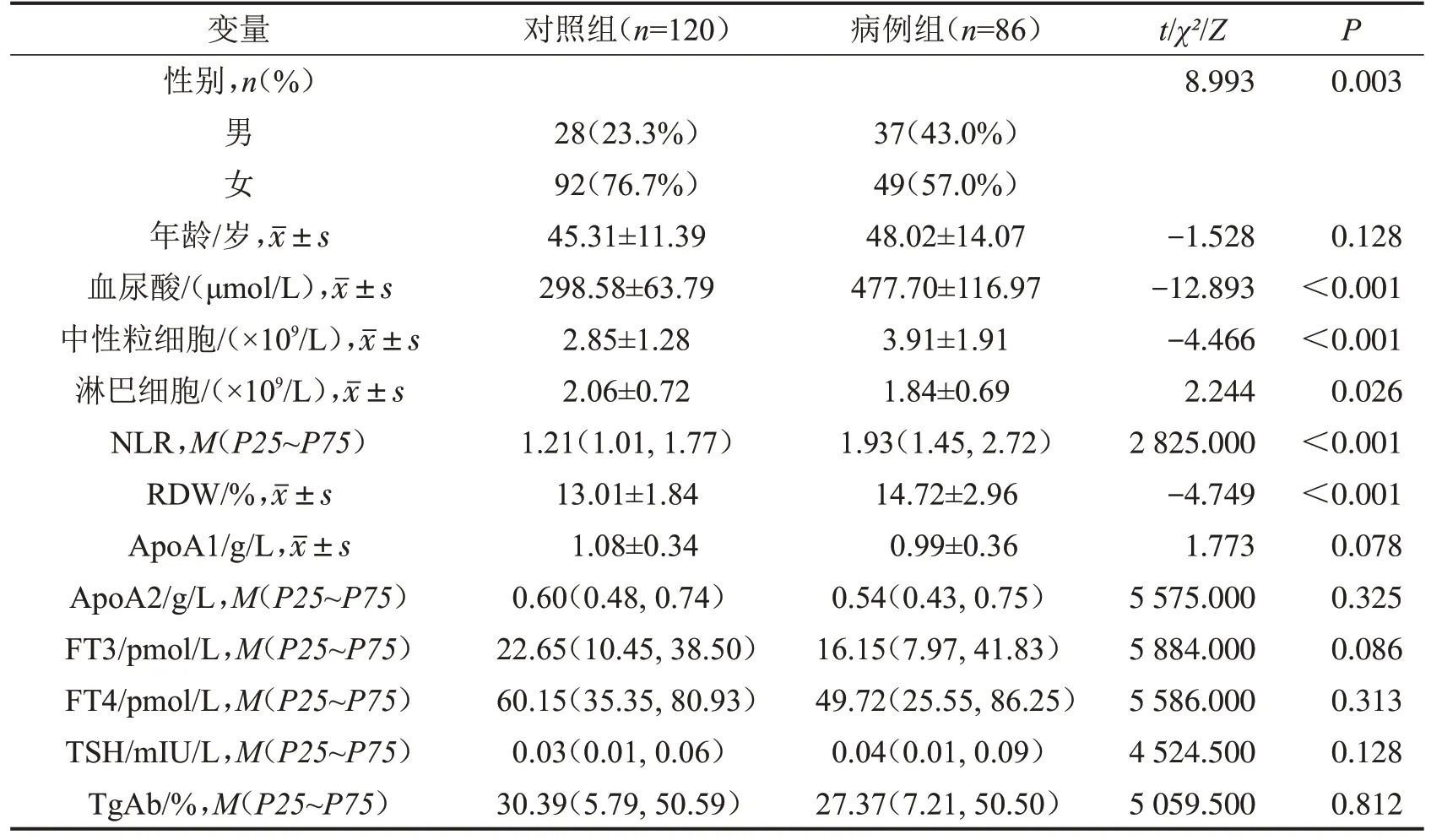
表1 两组患者一般资料比较
2.2 Graves 病合并THD 的影响因素分析 单因素Logistic 回归结果显示,性别、血尿酸、中性粒细胞、淋巴细胞、NLR和RDW是影响Graves病合并THD的潜在因素(P<0.05),见表2。将单因素分析中P<0.15 的因素纳入多因素Logistic 回归,并执行逐步回归,发现年龄大(OR=1.06,95%CI:1.02~1.10,P=0.007)及血尿酸(OR=1.03,95%CI:1.02~1.04,P<0.001)、NLR(OR=2.00,95%CI:1.27~3.16,P=0.003)和RDW(OR=1.66,95%CI:1.21~2.27,P=0.002)水平升高是Graves病合并THD的危险因素,见表3。
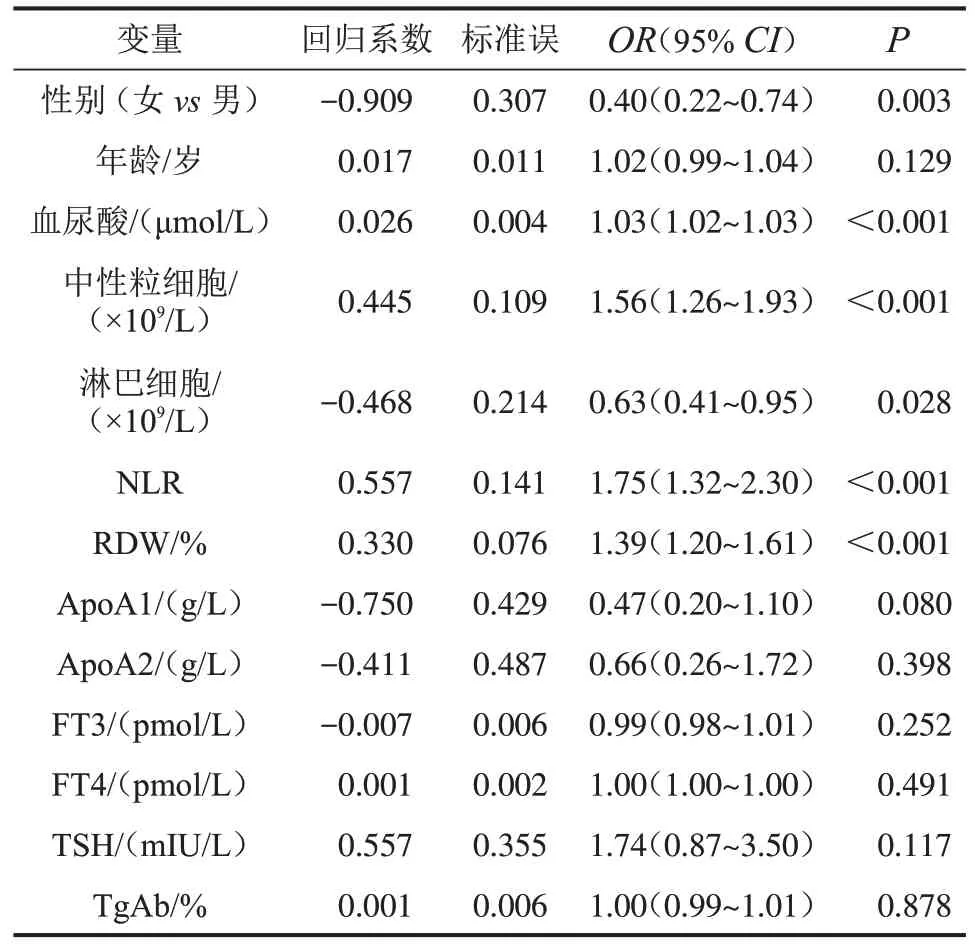
表2 影响Graves病合并THD的单因素Logistic回归

表3 影响Graves病合并THD的多因素Logistic回归分析
2.3 影响因素的诊断价值 ROC 曲线分析结果显示,年龄、血尿酸、NLR 和RDW 的截断值分别为47.5、368.0、1.323、13.65,相对应的AUC 分别为0.569(95%CI:0.487~0.650)、0.924(95%CI:0.887~0.961)、0.726(95%CI:0.657~0.796)和0.708(95%CI:0.636~0.781),进一步将年龄、血尿酸、NLR 和RDW 联合诊断Graves 病合并THD,其诊断效能有所提高(AUC=0.960,95%CI:0.937~0.984),差异有统计学意义(均P<0.05),见表4、图1。
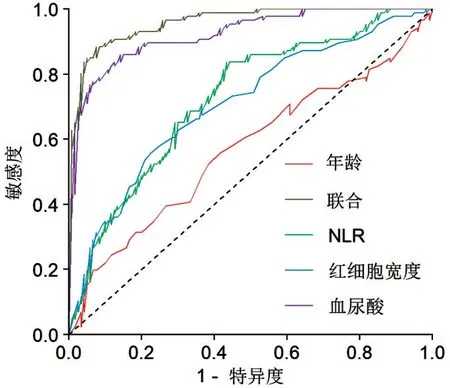
图1 年龄、血尿酸、NLR 和RDW 预测Graves 病合并THD的ROC曲线

表4 年龄、血尿酸、NLR和RDW预测Graves病合并THD的价值
3 讨论
目前临床上,Graves 病患者符合THD 诊断标准[9]时,心脏往往已发生恶性心律失常、心脏扩大、心功能不全等不可逆转的改变。若能及时诊断和治疗,绝大多数的心脏病变可缓解甚至恢复正常。探寻早期预测THD的指标,为临床早期干预提供证据支持显得尤为重要。本研究发现,年龄大及血尿酸、NLR和RDW水平高是THD的危险因素(均P<0.05),均对预测THD的发生有一定的价值,联合这些因素可进一步提高其预测效能。
甲亢状态下腺苷三磷酸消耗量增加,产生大量腺嘌呤核糖核苷酸,通过嘌呤代谢造成尿酸水平升高;另外高水平的甲状腺素通过抑制肾小管功能,降低尿酸的排泄量,进一步升高血尿酸水平[10],细胞内过度累积的尿酸作为一种促氧化剂,激活IL-1β、IL-6、TNF-γ 等诱发心肌细胞溶解、凋亡及纤维化,导致心律失常及心肌重构[4]。本研究的多因素Logistic 回归分析也表明,血尿酸的升高是THD 的危险因素,ROC曲线分析显示,单一指标中AUC最高的为血尿酸(AUC=0.924),是预测THD发生的可靠指标。本研究对照组的血尿酸水平不高(本院参考值范围:142~416 μmol/L),这与以往大多数研究结果不一致。产生这一结果的原因可能为:首先,本研究纳入样本量较少,未收集健康对照组进行比较。其次,我们推测甲亢状态与持续时间造成的缺氧应激环境,可加速黄嘌呤氧化酶和脱氢酶的催化速度[11],从而影响尿酸水平。Sato 等[12]研究曾发现Graves 病患者的肾血流明显增加、尿酸清除率升高,血尿酸清除率增加可能会造成甲亢早期血尿酸水平一过性的正常。本研究显示血尿酸的最佳截断值为368.0 μmol/L,有较高的特异度和良好的敏感度。该结果提示血尿酸>368.0 μmol/L的甲亢患者有可能是THD的潜在风险人群,单次心电图的正常结果尚不能完全排除阵发性心律失常,若进一步完善24 h动态心电图、心脏B超等检查,可能会更加及时地评估心脏是否存在电重构和心肌重构的相关病变。此类患者临床随访中,除了定期复查甲状腺功能,亦要严密监测血尿酸及重视心脏病变的筛查。
NLR作为一种复合炎症标记物,综合反应了以中性粒细胞为主的快速免疫途径和以淋巴细胞为主的长期免疫途径。本研究结果显示,NLR作为危险因素,在THD 的诊断上有较高的预测价值(AUC=0.726)。Erdal 等[13]发现甲亢应激状态下,机体分泌大量的内源性皮质类固醇激素,引起中性粒细胞增多、淋巴细胞计数下降,当活化的中性粒细胞产生的多种蛋白水解酶浓度过高时,会激发氧自由基致心肌损伤、心功能受损,NLR 与心衰病死率呈正相关。ROC 曲线分析显示NLR 截断值为1.323,敏感度为0.837,且临床数据易获得,计算简单,可作为一个便捷的THD 筛查、预测工具。Ma等[14]在对152例轻度认知功能障碍患者进行的一项随机对照试验中观察到,叶酸可以降低患者外周血炎性细胞因子水平,补充叶酸能否降低甲亢患者NLR水平,有待后续临床观察证实。
RDW 是红细胞体积异质性的参数,Rebrova等[15]研究发现,缺氧环境下累积的脂质过氧化物可抑制红细胞膜质子泵的活性,细胞发生肿胀最终导致RDW 升高。本研究中RDW 升高是THD 的危险因素,甲亢高代谢状态引起机体缺氧,RDW改变所致的微循环障碍进一步介导TNF-α、IL-6 等炎症细胞的大量释放,造成心肌损伤。RDW 作为血常规中一个固定参数,可成为THD 预测的简易标记(AUC=0.708)。Mohamed 等[16]和Seo 等[17]最近的研究发现,胰岛素抵抗、高血压可导致RDW 升高,高水平的甲状腺素拮抗胰岛素、促交感神经兴奋,引起糖耐量异常、血压升高。本研究中RDW 的最佳截断值(13.65%)可精细临床对甲亢患者血糖、血压干预的切入值,及时干预异常的代谢状态,降低心脏损害的发生风险。
随着年龄增大,心脏对甲状腺激素毒性作用耐受性下降。Otto等[18]研究发现正常人群随着年龄的增长,血尿酸水平有递增趋势。一项回顾性队列研究证实雌激素水平下降可能是导致绝经后女性高尿酸血症的重要原因[19]。本研究显示,年龄的增加与Graves 病合并THD 的发生风险呈正相关关系(OR=1.06,95%CI:1.02~1.10,P=0.007),年龄的最佳截断值(47.5 岁)处于女性围绝经期,雌激素水平波动对尿酸代谢起着至关重要的作用。甲亢状态下炎症氧化应激效应放大,血尿酸和NLR、RDW通过不同的机制损伤心肌功能,进一步将上述危险因素联合预测THD,其诊断效能有所提高(AUC=0.960),阳性预测值和阴性预测值分别达0.894(95%CI:0.829~0.960)、0.917(95%CI:0.868~0.966)。
本研究存在局限性,以下问题还有待解决:(1)本研究为单中心的病例对照研究,收集纳入的样本量较少,后续可进行多中心、大量本的数据验证。增设正常对照组和治疗前后对照组,以观察疾病控制情况。(2)有病例对照研究[20]和横断面研究[21]已证明,甲亢的持续时间、疗程长短可能与心血管风险的增加有关。由于本回顾性研究未能全面收集这些因素,可能会高估或低估年龄、血尿酸、NLR、RDW 等因素与THD 的真实关联,但基于这些因素构建的诊断模型的AUC 高达0.960,表明本研究的结果仍有一定的价值。(3)性激素水平影响氧化应激的效应,女性按绝经情况分层之后,有待进一步探讨。(4)本研究尚未对血尿酸进行肾功能校正,后续增加肾脏尿酸排泄率测定,可能有助于指导降尿酸药物种类的选择。
综上所述,本研究发现年龄大及血尿酸、NLR和RDW水平高是THD的危险因素,均对预测THD的发生有一定的价值。血尿酸、NLR 和RDW 为临床上易获取的检验指标,更便于疾病的预测和早期诊断,通过干预体内炎性应激状态,降低危险因素,可能对降低THD的发生具有一定的作用。
