LPAR1对骨肉瘤细胞增殖、迁移和侵袭的影响及其机制研究*
2022-01-24吕俊杰钟彩琴张振宇
吕俊杰,钟彩琴,张振宇,刘 朋,姚 鹏
(辽宁锦州市中心医院 1.骨科;2.神经内科,锦州 121000;3.辽宁锦州医科大学附属第一医院骨科,锦州 121000)
骨肉瘤是由间质细胞系发展而来,由于其常伴有较高的转移倾向性,患者的预后情况往往不如人意,病死率居高不下,对骨肉瘤的复发、死亡率的控制仍然是目前临床医学工作中的一个重难点[1]。因此,研究骨肉瘤的发病机制,对于探寻更为有效的防治手段、降低病死率及预防复发转移具有十分重要的意义。近些年的研究显示,溶血磷脂酸受体-1(recombinant lysophosphatidic acid receptor 1,LPAR1)可通过调控多种信号通路来参与肿瘤细胞的增殖、迁移、侵袭、凋亡等过程,与包括结肠癌[2]、卵巢癌[3]、前列腺癌[4]等多种肿瘤的发生、发展过程关系密切。然而,目前有关LPAR1 对骨肉瘤发生、发展的影响及作用机制的研究尚不多见。基于此,本研究讨探了LPAR1对骨肉瘤细胞增殖、迁移和侵袭的影响及其作用机制,以期为临床抗骨肉瘤治疗的应用提供依据。
1 材料与方法
1.1 实验动物 雄性BALB/c裸小鼠20只,4~6周龄,体质量15~20 g,购自锦州医科大学[许可证号:SCXK(辽)2019-0003]。本实验通过动物伦理委员会批准。
1.2 实验材料 人骨肉瘤细胞株MG63、U2OS 购自中国科学院(上海)生物化学与细胞生物学研究所。LPAR1表达质粒购自博迈德公司。
10%FBS、DEME 培养基购自美国Sigma-Aldrich公司;Trizol试剂、Lipofectamine®2000试剂盒购自美国Invitrogen 公司;CCK-8 试剂盒购自英国Abcam公司;Transwell小室及细胞培养皿购自美国BD 公司;Bradford 蛋白定量试剂、Gimsa 染色液购自碧云天生物技术研究所;PVDF膜、ECL化学发光显色液购自美国Millipore 公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国Bender 公司;LPAR1、Ki67、CDK2、CCNB1、BCL2、BAX、pmTOR、mTOR、pAKT、AKT 及β-actin 抗体购自英国Abcam公司或美国Abgent 公司,辣根酶标记羊抗兔IgG(ZB2301)购自北京中杉金桥公司;其他常规化学试剂购自国药集团化学试剂有限公司。
1.3 生物信息学分析 GEO2R 分析骨肉瘤3 个相关数据集GSE33382、GSE16088、GSE14359 中LPAR1 的表达水平。下载TCGA 骨肉瘤数据,以骨肉瘤中LPAR1表达水平的四分位数分组,将骨肉瘤患者分为LPAR1高(上四分之三)/低(下四分之一)两组,采用GSEA 4.0 软件分析LPAR1 表达水平与细胞恶性表型的关系。本研究按照默认参数设置进行富集分析,设置随机组合次数为1 000次。
1.4 细胞培养 将人骨肉瘤细胞MG63、U2OS 培养于含10%灭活FBS 的DMEM 培养液中,置于37 ℃、5%CO2饱和湿度的培养箱中,每2~3 d 换液传代,取对数生长期细胞用于后续实验开展。
1.5 细胞转染及构建稳定过表达LPAR1细胞系在细胞密度达到80%时开始进行转染。参照LipofectamineTM2000试剂盒说明书完成转染。其中以过表达LPAR1质粒转染细胞组记作LPAR1组,空载转染作为空载体组。随后用G418筛选并构建稳定过表达LPAR1 的MG63、U2OS 细胞系。Western blotting 法检测转染各组细胞中的LPAR1 蛋白相对表达水平。
1.6 CCK-8 实验检测细胞活力 取各组细胞制备成单细胞悬液,在96孔板中每孔接种3 000个细胞,置于37 ℃、5%CO2培养箱中常规培养,于规定时间加入稀释后的CCK-8 试剂进行检测,采用DNM-9606酶标分析仪(北京朗普新技术有限公司,中国)检测各孔在450 nm 处的OD 值,此后每天检测1 次OD值,连续检测5 d,绘制生长曲线。
1.7 克隆形成实验检测细胞增殖能力 将37 ℃预温培养液10 mL 加入到培养皿中,取各组细胞制备成单细胞悬液,于6 孔板中每孔接种500 个细胞。十字轻轻晃动使细胞分散均匀后,置于37 ℃、5%CO2饱和湿度的培养箱中常规静置培养。肉眼观察到培养皿中出现可见的克隆时,终止培养。弃去上清,PBS洗涤,加入醋酸/甲醇(1∶3)溶液固定15 min,Gimsa 染色液染色20 min,流水缓慢清洗,空气干燥。计数肉眼可见的克隆数。
1.8 流式细胞术检测细胞周期及细胞凋亡 取各组细胞制备成单细胞悬液,调整为1×106个/mL后在6 孔板中接种,置于37 ℃、5%CO2培养箱中常规培养。48 h 后收集各组细胞到离心管中,1 000 r/min离心5 min,PBS 洗涤,弃去上清,PI 染色,4 ℃避光孵育30 min。采用FACSCalibur流式细胞仪(BD 公司,美国)进行上样检测,计数2万个细胞,使用细胞周期拟和软件ModFit分析结果。对于细胞凋亡,则根据Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书进行染色后上机检测,计算细胞凋亡率。
1.9 Transwell 小室法检测细胞侵袭能力 细胞迁移和侵袭检测在Transwell 小室中进行。行细胞侵袭实验时,先取Matrigel 稀释液并用移液器均匀涂抹在小室底部,待其均匀凝固。取各组细胞制成单细胞悬液,于小室内每孔加入1×105个细胞,置于37 ℃、5% CO2培养箱中常规培养。24 h 后取出小室,PBS 洗涤,10%中性甲醛溶液固定,结晶紫染色。在显微镜下随机选择10个高倍(×100)视野,统计过膜的细胞数目。
1.10 Western blotting 实验检测蛋白表达水平 提取各组细胞培养48 h 后的总蛋白,Bradford 调节蛋白浓度。经SDS-PAGE 凝胶电泳、电转膜至PVDF膜,密封2 h,分别添加LPAR1、Ki67、CDK2、CCNB1、BCL2、BAX、pmTOR、mTOR、pAKT、AKT 及β-actin一抗(1∶400),4 ℃孵育过夜,加入HRP 标记的二抗(1∶1 000)继续孵育1 h,TBST 漂洗,ECL 发光液显色,暗室曝光。
1.11 裸鼠分组及体内成瘤实验 将18 只裸鼠随机分为2 组,每组9 只。于裸鼠右腋下分别注射稳定过表达LPAR1和空载对照的MG63细胞,每组注射5×106个细胞。饲养期间动态观察肿瘤生长情况,每2 d 用游标卡尺测量皮下移植瘤的最大长径(a)、横径(b),肿瘤体积计算公式:V=1/2ab2,绘制肿瘤生长曲线。饲养14 d后将所有裸鼠处死,取出皮下肿块并记录体积、质量。
1.12 免疫组化法检测LPAR1 在瘤体组织中表达情况 取各组小鼠瘤体组织标本经脱水、透明、石蜡包埋,常规制成3 μm 切片。参考SP 免疫组化试剂盒说明书进行免疫组化实验,在显微镜下随机选择10个高倍(×400)视野,统计阳性着色细胞所占百分数。LPAR1以细胞质呈棕黄色为阳性表达。
1.13 统计学方法 采用GraphPad Prism 与SPSS 22.0软件进行数据统计分析,计量资料采用均值±标准差()表示,两组间比较采用独立样本t检验,以P<0.05 为差异具有统计学意义。在GSEA 中,以错误发现率(false discovery rate,FDR)<0.25 的基因集为显著富集基因集。
2 结果
2.1 LPAR1的功能基因集富集
利用GEO2R 分析骨肉瘤3 个数据集中的差异基因,结果发现LPAR1 在骨肉瘤中低表达,见图1A。经GSEA分析,结果显示,负调控细胞增殖、负调控细胞周期、细胞凋亡基因集及负调控细胞迁移、侵袭和肿瘤转移的基因集富集在LPAR1高表达组,见图1B~G。

图1 LPAR1在骨肉瘤中的表达水平且与细胞恶性表型的关系
2.2 LPAR1对人骨肉瘤细胞增殖、周期及凋亡的影响
Western blotting 实验结果显示,LPAR1 组的人骨肉瘤细胞系MG63、U2OS 的LPAR1 的蛋白明显高于空载组(P<0.05),提示成功构建稳定过表达LPAR1 的人骨肉瘤细胞系MG63、U2OS,见图2A。与空载体组相比,LPAR1 组人骨肉瘤细胞MG63、U2OS 的细胞活力、克隆形成率均出现明显下降(P<0.05),见图2B~C。与空载体组相比,LPAR1组人骨肉瘤细胞MG63、U2OS处于G0/G1期的比例明显上升,处于S期的比例明显下降,细胞凋亡率明显上升,细胞Ki67、CDK2、CCNB1、BCL2 蛋白表达明显下降,BAX蛋白表达明显上升(均P<0.05),见图2E~G。
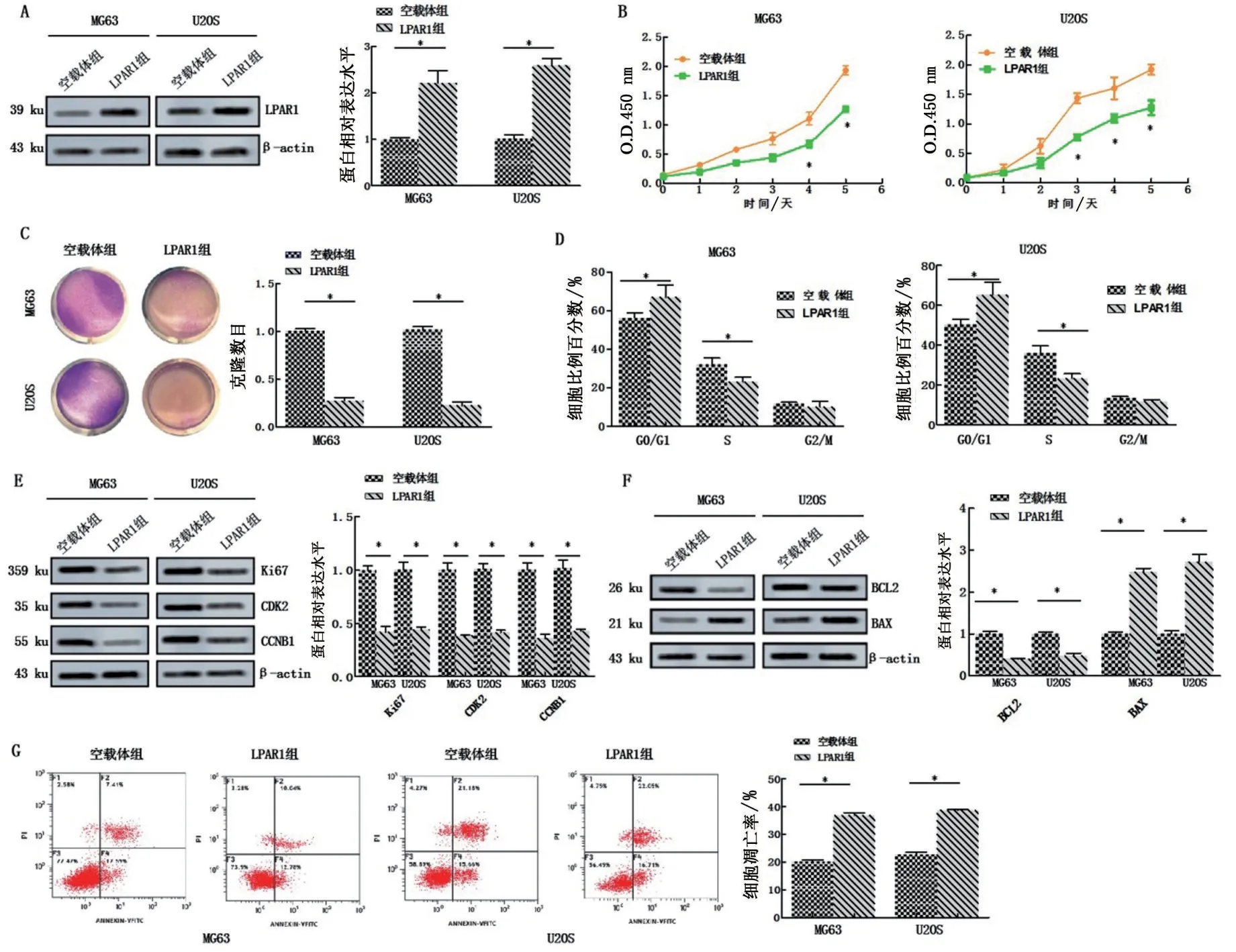
图2 LPAR1对人骨肉瘤细胞增殖、周期及凋亡的影响
2.3 LPAR1 对人骨肉瘤细胞迁移和侵袭能力的影响
Transwell小室结果显示,与空载体组相比,LPAR1组人骨肉瘤细胞MG63、U2OS的细胞迁移和侵袭能力均出现明显下降(P<0.05),见图3。
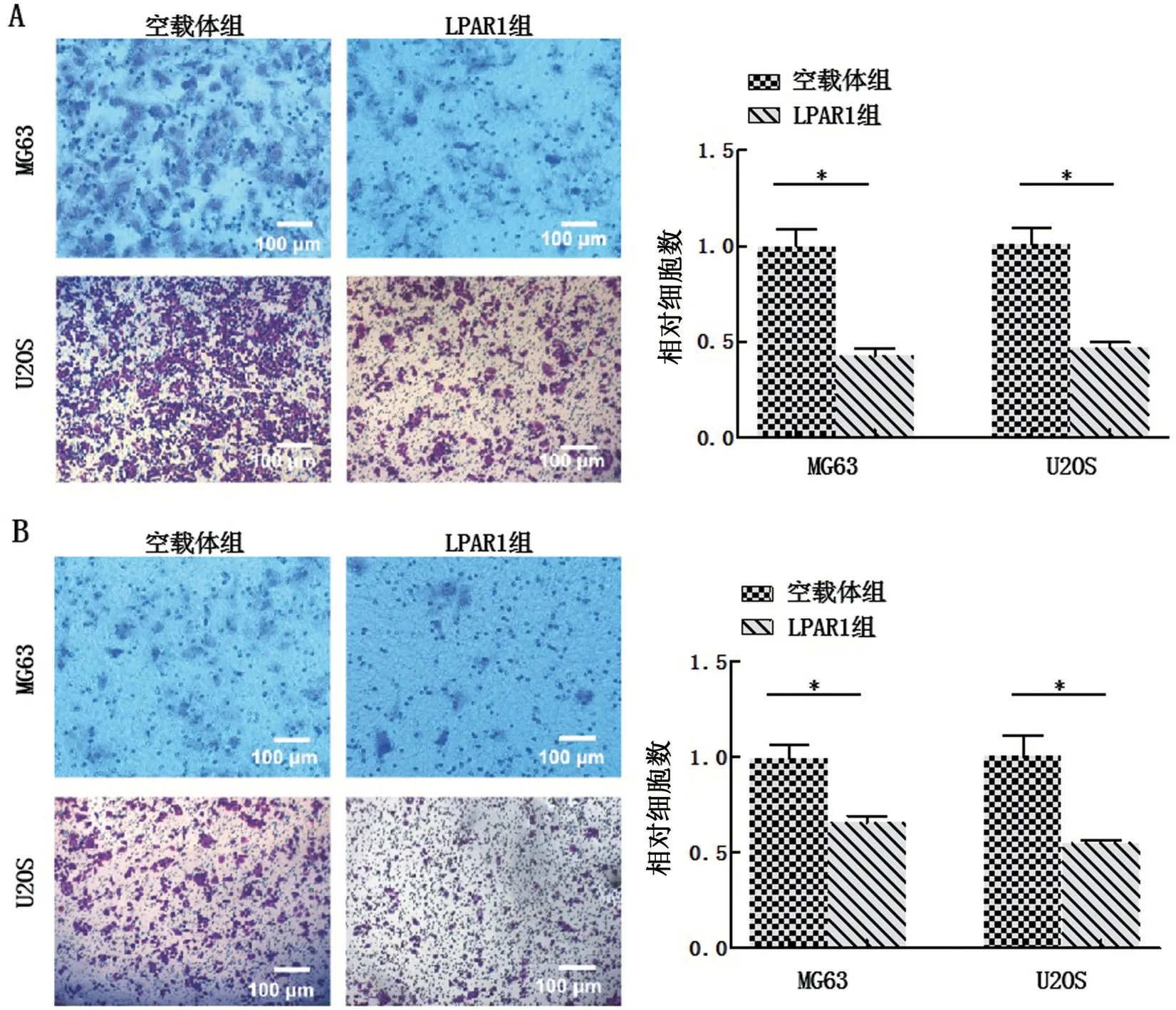
图3 LPAR1对人骨肉瘤细胞迁移和侵袭能力的影响
2.4 LPAR1对裸鼠成瘤的影响
与空载体组相比,LPAR1 组裸鼠的瘤体体积、质量明显下降(P<0.05),见图4A~D。与空载体组相比,LPAR1组小鼠瘤体组织中的LPAR1蛋白表达水平明显上升(P<0.05),见图4E。

图4 LPAR1对裸鼠成瘤的影响
2.5 LPAR1对AKT信号通路相关蛋白表达的影响
与空载体组相比,LPAR1 组人骨肉瘤细胞MG63、U2OS 中pmTOR/mTOR、pAKT/AKT 表达明显下降,见图5。
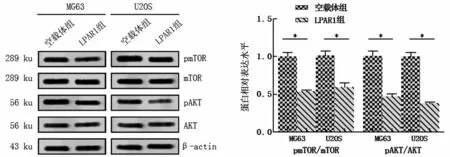
图5 LPAR1对AKT信号通路相关蛋白表达的影响
3 讨论
溶血磷脂酸(lysophosphatidic acid,LPA)作为一种细胞间磷脂类信号分子,因其能够在细胞的多种生理功能中发挥效应而逐渐受到医学界的广泛关注[5]。研究显示,其能够通过G蛋白耦联受体(Gprotein-coupled receptors,GPRs),来引发生长激素样作用,进而对生物体细胞的生长、增殖、分化、血小板聚集等多种过程造成影响,并在各种病理过程的发生、发展中扮演了重要角色[6-7]。LPAR1是GPRs之一,能与LPA结合,有证据表明,LPAR1在肿瘤的发生、发展和侵袭性生长发挥了至关重要的作用,但其确切作用机制仍在探讨中[8]。在本实验中,主要分析LPAR1 在骨肉瘤中的表达情况及其对人骨肉瘤细胞MG63、U2OS 增殖、迁移和侵袭能力的影响,并尝试探讨可能的作用机制。
目前,有关LPAR1 对于肿瘤细胞增殖、迁移及侵袭能力的影响尚未有定论。Fukushima 等[9]研究报道,过表达LPAR1对胰腺癌细胞的侵袭活性具有促进作用,而Ma等[10]研究则指出,LPAR1在胃癌组织中显著下调,且LPAR1下调促进了细胞的增殖和迁移。本研究基于生物信息学分析发现,LPAR1在骨肉瘤中低表达,且GSEA分析结果显示,与负调控细胞增殖、负调控细胞周期、负调控细胞侵袭及细胞凋亡信号通路相关的基因集均明显富集在LPAR1高表达组,提示LPAR1能够抑制骨肉瘤细胞的增殖、侵袭,并促进凋亡。
同时,本研究选择人骨肉瘤细胞MG63 和U2OS细胞系为研究对象,通过构建稳定过表达LPAR1的细胞系来分析LPAR1对细胞增殖、迁移和侵袭能力的影响。CCK-8、克隆形成实验结果显示,与空载体组相比,LPAR1 组的细胞活力、克隆形成率均出现明显下降;流式细胞术结果亦表明过表达LPAR1能够阻滞细胞进入S期,抑制细胞增殖,并促进细胞凋亡。Ki-67是常见的调控细胞增殖的蛋白之一,其表达水平与细胞增殖能力呈正相关关系[11-12];BCL2则是在细胞凋亡过程中起关键作用的蛋白质,能抑制细胞凋亡[13]。CDK2、CCNB1是常见的两种细胞周期调控蛋白:CDK2对细胞从G1期过渡到S期十分重要;CCNB1则能与CDKs结合,促进细胞的G2/M 期转变[14]。本研究Western blotting 实验结果显示,与空载体组相比,LPAR1 组中上述细胞周期相关蛋白表达明显失调,与CCK-8、克隆形成实验及流式细胞术结果相符,进一步表明过表达LPAR1 对人骨肉瘤细胞MG63、U2OS 的增殖活性具有抑制作用,提示LPAR1在骨肉瘤细胞中具有抗肿瘤细胞增殖的特性。Transwell小室结果显示,与空载体组相比,LPAR1组细胞迁移和侵袭能力均出现明显下降,提示过表达LPAR1对人骨肉瘤细胞的迁移、侵袭具有抑制作用。
在体外实验的基础上,本研究还进行了裸鼠成瘤实验,发现肿瘤生长明显受抑制,其成瘤体积、质量均明显下降;同时,采用免疫组化法观察到LPAR1 组小鼠瘤体组织中LPAR1 蛋白表达明显高于空载体组,提示LPAR1 确实在骨肉瘤的发生、发展过程中起到重要作用;表明过表达LPAR1能够抑制裸鼠成瘤。近年来研究发现,多种特定的信号传递通路在恶性肿瘤的发生、发展及侵袭转移过程中发挥了关键效用。其中,Akt/mTOR 信号通路参与调控包括骨肉瘤在内的多种肿瘤细胞的增殖、迁移、粘附、肿瘤血管生成等过程[15]。本研究观察人骨肉瘤细胞MG63、U2OS中Akt/mTOR信号通路相关蛋白表达情况发现,与空载体组相比,LPAR1 组人骨肉瘤细胞MG63、U2OS 中pmTOR、pAKT 蛋白表达明显下降,提示过表达LPAR1能通过去磷酸化抑制Akt/mTOR信号通路,这可能是导致细胞增殖、迁移及侵袭能力下降的重要机制之一。
综上所述,LPAR1 在骨肉瘤中低表达,且过表达LPAR1 能够抑制人骨肉瘤细胞MG63、U2OS 的增殖、迁移和侵袭能力,促进凋亡,抑制裸鼠成瘤,其机制可能是通过抑制AKT信号通路来实现。
