下调整合素β1对大肠癌细胞的西妥昔单抗化疗敏感性的影响及机制研究*
2022-01-24张壮苗邓黎黎马丽辉
张壮苗,邓黎黎,张 岩,马丽辉
(海南三亚市人民医院肿瘤血液科,三亚 572000)
大肠癌是世界上最常见的恶性肿瘤之一,我国大肠癌的发病率和死亡率均高于世界平均水平,严重威胁着人民身体健康。当前大肠癌治疗首选外科手术,药物化疗是术前、术后重要的辅助治疗手段[1-2]。西妥昔单抗是一种针对表皮生长因子受体(epidermal growth factor receptor,EGFR)的嵌合单克隆抗体,属于治疗转移性大肠癌的一线化疗药物,对大肠癌有确切的抑制作用。但化疗过程中,肿瘤细胞对化疗药物产生的抵抗能力使得西妥昔单抗的临床治疗效果大大降低,而难以彻底清除的肿瘤细胞引起肿瘤复发和转移,是导致大肠癌治疗失败和患者死亡的主要原因[3]。因此,如何提高大肠癌化疗敏感性一直是临床研究重点和热点。
整合素β1(integrin β1,ITGB1)是一种重要的黏附分子,在恶性肿瘤的进展中起重要作用,可促进肿瘤细胞的侵袭和转移[4]。既往研究表明,大肠癌中ITGB1 表达上调,ITGB1 高表达与大肠癌患者整体生存时间短等不良预后有关,可作为潜在预后预测因子[5]。也有研究表明ITGB1 在乳腺癌、鼻咽癌等癌细胞产生化疗耐药性中起着重要作用,靶向ITGB1可以提高紫杉醇、吉西他滨等化疗药物的敏感性[6-8]。但目前关于ITGB1 在大肠癌治疗过程中改善药物化疗敏感性的研究较少,ITGB1 对西妥昔单抗敏感性的作用效果及分子机制尚不完全清楚。因此,本研究探讨ITGB1表达变化对西妥昔单抗抗大肠癌化疗敏感性的影响及机制。
1 材料与方法
1.1 患者和组织样本收集 收集在海南三亚市人民医院行手术切除且经病理检查确诊的56 例原发性大肠癌患者的肿瘤组织和癌旁正常组织。排除合并其他系统性肿瘤或肿瘤发生转移者,排除术前接收化疗或放疗的患者。本研究经过医院医学伦理委员会批准,批准文号为:2020-1-143。所有患者均自愿签署知情同意书。
1.2 主要材料与试剂 人大肠癌LS174T 细胞(美国ATCC 细胞库);RPMI1640 培养基、胎牛血清、链霉素与青霉素(武汉普诺赛生命科技有限公司);西妥昔单抗(100 mg/20 mL/瓶)(德国默克里昂制药公司);特异性干扰ITGB1 表达的siRNA 和无干扰作用的siRNA(上海吉凯基因科技有限公司);LipofectamineTM2000转染试剂、Trizol试剂盒(美国Invitrogen公司);CCK-8试剂盒(武汉默沙克生物科技有限公司);膜联蛋白V-异硫氰酸荧光素(Annexin VFITC)/碘化丙啶(PI)细胞凋亡检测试剂盒、二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒、细胞裂解液(碧云天生物技术研究所);SYBR Premix Ex Taq 荧光定量试剂盒、反转录试剂盒(日本Takala公司);兔源Cleaved caspase-3、Bax、Bcl-2、SHh、Gli1、Ptch1、c-Myc抗体,鼠源β-actin、GAPDH抗体,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔、山羊抗鼠二抗(美国Abcam 公司);PVDF 膜、ECL试剂(美国Millipore公司)。
1.3 细胞培养 将大肠癌LS174T 细胞置于含10%胎牛血清的RPMI1640 培养基中,在37 ℃、5%CO2恒温培养箱中培养传代,取对数生长期细胞开展实验。
1.4 细胞转染与分组 取对数生长期LS174T 细胞,以1×105个/孔接种于24孔板,细胞培养24 h后,随机分为5 组:空白对照组(正常培养)、NC-siRNA组(转染无干扰作用的siRNA)、ITGB1-siRNA 组(转染特异性干扰ITGB1 表达的siRNA)、西妥昔单抗组(终浓度为50 μg/mL的西妥昔单抗干预24 h)、ITGB1-siRNA+西妥昔单抗组(转染特异性干扰ITGB1表达的siRNA,同时用终浓度为50 μg/mL的西妥昔单抗干预24 h)。转染操作严格按照LipofectamineTM2000转染试剂说明书进行。各组转染细胞于细胞培养箱中培养6 h 后更换新鲜培养基,继续培养48 h后取各组细胞用于后续实验。
1.5 实时荧光定量PCR(RT-qPCR)法检测ITGB1 mRNA 表达水平 用Trizol 法提取大肠癌组织、癌旁组织及各组细胞总RNA,应用酶标仪测定RNA纯度和浓度,按照反转录试剂盒说明书将RNA反转录合成互补链cDNA,应用荧光定量PCR 试剂盒进行RT-qPCR 反应。引物序列如下:ITGB1 上游引物:5’-ATGTGTCAGACCTGCCTTGG-3’,下游:5’-GCTGGGGTAATTTGTCCCGA-3’;GAPDH 上游引物:5’-GAGTCAACGGATTTGGTCGT3’,下游:5’-GACAAGCTTCCCGTTCTCAG-3’。反应体系(20 μL):10 μmol/L 上、下游引物各0.5 μL,cDNA 模板2 μL,SYBR Premix Ex Taq 11.5 μL,ddH2O 5.5 μL。反应条件:95 ℃60 s,95 ℃15 s,60 ℃30 s,72 ℃45 s,重复40个循环。以GAPDH为内参基因,采用2-△△Ct法计算目的基因相对表达量。实验重复3次。
1.6 CCK-8法检测LS174T细胞增殖活性 将各组细胞按照1×105/mL 的浓度接种于96 孔板,置于细胞培养箱中培养24 h,每孔设置5个复孔,每孔加入10 μL 的CCK-8 溶液,混匀后继续在细胞培养箱孵育4 h,采用酶标仪检测450 nm 处的吸光度(OD)值,以OD值反映细胞增殖活力。实验重复3次。
1.7 流式细胞术检测LS174T细胞周期分布情况收集各组细胞,3 000 r/min 离心10 min 收集沉淀细胞,预冷的磷酸盐缓冲液(PBS)冲洗2次后,加入预冷的75%乙醇固定,置于4 ℃冰箱过夜,再次离心收集细胞,PBS 冲洗2 次后,加入50 μL 水解酶RNase A,37 ℃水浴1 h,加入200 μL PI 染液避光孵育30 min,采用流式细胞仪检测细胞周期分布。实验重复3次。
1.8 流式细胞术检测LS174T细胞凋亡情况 收集各组细胞,调整细胞密度为2×104/mL,按200 μL/孔接种于6 孔板,每组设置5 个复孔,培养过夜,收集细胞,3 000 r/min离心10 min收集沉淀,用预冷PBS洗涤2遍,加入500 μL结合缓冲液重悬细胞,分别加入5 μL Annexin V-FITC溶液和5 μL PI溶液,室温下避光孵育15 min,流式细胞仪检测分析各组细胞凋亡情况,计算细胞凋亡率。实验重复3次。
1.9 Western blotting 法检测LS174T 细胞凋亡相关蛋白及Hedgehog信号通路相关蛋白表达水平
收集各组细胞,用含蛋白酶抑制剂的细胞裂解液在冰上裂解30 min提取总蛋白,BCA试剂盒测定蛋白浓度。蛋白经10%SDS-PAGE 电泳分离,将分离的蛋白湿法转移至PVDF膜上,室温下在含5%脱脂牛奶的TBST 缓冲液中封闭1 h,TBST 缓冲液洗涤3 次×10 min,分别加入兔源Cleaved caspase-3、Bax、Bcl-2、SHh、Gli1、Ptch1、c-Myc 一抗(1∶1 000)和鼠源β-actin、GAPDH 一抗(1∶1 000)在4 ℃冰箱孵育过夜,TBST缓冲液洗涤3次×10 min,加入相应HRP标记的山羊抗兔二抗、山羊抗鼠二抗(1:5 000)在室温下孵育1 h。采用ECL 试剂显影,分析蛋白条带灰度值,计算目的蛋白相对表达量。实验重复3次。
1.10 统计学方法 采用SPSS 25.0 软件进行实验数据处理分析,实验结果以均数±标准差()表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ITGB1 在大肠癌组织中表达水平 大肠癌组织中ITGB1 mRNA 相对表达量显著高于癌旁正常组织(P<0.05),见图1。
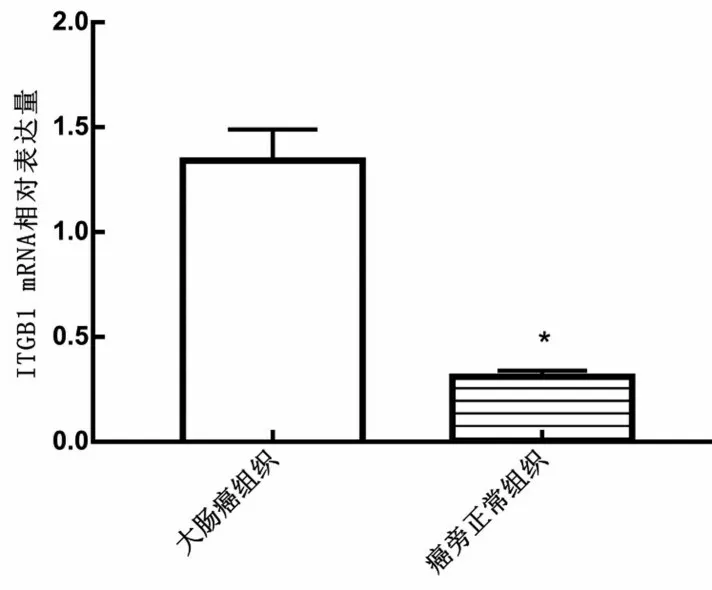
图1 ITGB1在大肠癌组织中表达水平
2.2 转染后LS174T 细胞ITGB1 mRNA 表达水平比较 转染48 h 后,NC-siRNA 组和西妥昔单抗组LS174T细胞ITGB1 mRNA相对表达量与空白对照组比较,差异无统计学意义(P>0.05);ITGB1-siRNA组和ITGB1-siRNA+西妥昔单抗组LS174T细胞ITGB1 mRNA 相对表达量均显著低于空白对照组(P<0.05);ITGB1-siRNA 组和ITGB1-siRNA+西妥昔单抗组LS174T细胞ITGB1 mRNA相对表达量比较,差异无统计学意义(P>0.05),见图2。

图2 转染后LS174T细胞ITGB1 mRNA表达水平比较
2.3 ITGB1 表达下调对西妥昔单抗抑制大肠癌细胞增殖活性的作用 NC-siRNA组细胞增殖活性与空白对照组比较,差异无统计学意义(P>0.05);ITGB1-siRNA 组和西妥昔单抗组细胞增殖活性显著低于空白对照组(P<0.05);ITGB1-siRNA+西妥昔单抗组细胞增殖活性显著低于ITGB1-siRNA 组和西妥昔单抗组(P<0.05),见图3。

图3 ITGB1 表达下调对西妥昔单抗抑制大肠癌细胞增殖活性的作用
2.4 ITGB1 表达下调对西妥昔单抗阻滞大肠癌细胞G2/M周期的作用 与空白对照组比较,NC-siRNA组细胞周期分布无明显差异(P>0.05),ITGB1-siRNA 组和西妥昔单抗组细胞阻滞于G2/M 期,该期细胞数量显著升高(P<0.05),S期细胞数量显著降低(P<0.05),G0/1 期细胞数量无明显变化(P>0.05)。ITGB1-siRNA+西妥昔单抗组G2/M 期细胞数量显著高于ITGB1-siRNA 组和西妥昔单抗组(P<0.05),S期细胞数量显著低于ITGB1-siRNA组和西妥昔单抗组(P<0.05),G0/1 期细胞数量无明显变化(P>0.05),见图4。

图4 ITGB1表达下调对西妥昔单抗阻滞大肠癌细胞G2/M周期的作用
2.5 ITGB1 表达下调对西妥昔单抗促进大肠癌细胞凋亡的作用 与空白对照组比较,NC-siRNA 组细胞凋亡率、Cleaved caspase-3、Bax、Bcl-2蛋白表达量比较,差异无统计学意义(P>0.05),ITGB1-siRNA 组和西妥昔单抗组细胞凋亡率显著升高(P<0.05),Cleaved caspase-3 和Bax 蛋白表达量显著升高,Bcl-2 蛋白表达量显著降低(P<0.05);ITGB1-siRNA+西妥昔单抗组细胞凋亡率、Cleaved caspase-3和Bax蛋白表达量均显著高于ITGB1-siRNA组和西妥昔单抗组(P<0.05),Bcl-2 蛋白表达量显著低于ITGB1-siRNA 组和西妥昔单抗组(P<0.05),见图5。

图5 ITGB1表达下调对西妥昔单抗促进大肠癌细胞凋亡的作用
2.6 ITGB1 表达下调对西妥昔单抗调控大肠癌细胞Hedgehog 信号通路相关蛋白表达的作用 与空白对照组比较,NC-siRNA 组SHh、Gli1、Ptch1、c-Myc 蛋白表达量比较,差异无统计学意义(P>0.05),ITGB1-siRNA 组和西妥昔单抗组SHh、Gli1、Ptch1、c-Myc 蛋白表达量显著降低(P<0.05);ITGB1-siRNA+西妥昔单抗组SHh、Gli1、Ptch1、c-Myc蛋白表达量均显著低于ITGB1-siRNA 组和西妥昔单抗组(P<0.05),见图6。

图6 ITGB1表达下调对西妥昔单抗调控大肠癌细胞Hedgehog信号通路相关蛋白表达的作用
3 讨论
大肠癌在我国发生风险较高,且大部分患者在确诊时肿瘤已发生转移,导致治疗难度增加,患者预后差[9]。目前大肠癌的治疗以手术和化疗为主,西妥昔单抗是大肠癌的常用化疗药物,以西妥昔单抗为主的联合化疗或综合治疗也是大肠癌治疗的临床常用方案。西妥昔单抗是一种靶向分子药物,主要通过与EGFR 的胞外结构域结合,阻断细胞内信号转导通路的激活,调控肿瘤细胞增殖和凋亡;该药还可竞争性阻断EGFR 与其配体的相互作用,阻断EGFR 下游信号转导通路,进而抑制肿瘤细胞增殖、侵袭和转移[10-11]。但当化疗药物使用次数增多或作用时间过长时,肿瘤细胞会产生耐药性,致使西妥昔单抗等化疗药物达不到预期效果。因此深入研究大肠癌耐药的相关分子机制是提高西妥昔单抗等药物化疗敏感性的主要途径之一。
大量研究证实,整合素在肿瘤进展及耐药性产生中的作用受到广泛关注,其中ITGB1在多种恶性肿瘤中高表达并促进肿瘤细胞侵袭、转移[12-13]。在肝癌、肾癌中,ITGB1 通过调控ROCK1、Mcl-1 等表达促进细胞增殖、迁移和侵袭[14-15],而在食管鳞癌和乳腺癌中,ITGB1 是肿瘤耐药的重要效应因子[16-17]。本研究结果显示,ITGB1 在大肠癌组织中高表达,ITGB1 表达下调显著增强西妥昔单抗抑制大肠癌细胞增殖、阻滞细胞G2/M 周期及诱导细胞凋亡的作用(P<0.05)。此外,本研究结果显示,下调ITGB1表达并给予西妥昔单抗干预后,大肠癌细胞中促凋亡蛋白Cleaved caspase-3 和Bax 表达显著上调,抗凋亡蛋白Bcl-2表达显著下调(P<0.05),表明ITGB1 表达下调能够显著增强西妥昔单抗调控大肠癌细胞凋亡蛋白表达的作用,提示ITGB1表达下调可增强大肠癌细胞对西妥昔单抗的化疗敏感性。
Hedgehog 信号通路在人体发育和各种生理过程中起着重要调控作用,多数情况下该信号通路处于高度抑制状态,一旦发生失调则容易引发肿瘤。Hedgehog通路中信号传导取决于SHh蛋白的表达,低SHh信号条件下,SHh与Ptch1结合减少,Gli活性发生改变,出现转录抑制因子的功能,而在高SHh信号条件下,SHh 与Ptch1 结合,Gli 保持原有活性,行使转录激活功能,激活的Hedgehog通路介导下游多种生长因子表达,引起细胞分裂和修复受损DNA的原癌基因c-Myc 表达水平上调,从而引起一系列细胞反应,最终调控细胞增值、分化、转移、凋亡和化疗耐药性产生等生物学过程[18-19]。相关研究报道,Hedgehog 通路在大肠癌细胞迁移、侵袭以及化疗耐药性中发挥重要作用[20-21]。Song等[22]研究发现ITGB1 能够通过调节Hedgehog 通路介导大肠癌细胞生物学行为。本研究结果显示,ITGB1 表达下调联合西妥昔单抗显著下调大肠癌细胞中SHh、Gli1、Ptch1、c-Myc 蛋白表达(P<0.05)。提示ITGB1 表达下调可能通过抑制Hedgehog 信号通路增强大肠癌细胞对西妥昔单抗的化疗敏感性。
综上所述,ITGB1 表达下调能够显著增强西妥昔单抗对大肠癌细胞的增殖抑制、周期阻滞及诱导凋亡作用,其机制可能与抑制Hedgehog信号通路的活性有关。本研究为大肠癌的治疗和耐药机制的研究提供了新思路,但本研究仅在细胞水平开展研究,且未应用通路抑制剂证实,后续还需更多的实验研究作进一步的证实。
