褪黑素对布比卡因脊髓神经毒性的神经保护的作用机制*
2022-01-24陈美云紫罗云鹏韦丽玲刘敬臣
陈美云紫,赖 坚,罗云鹏,余 悦,周 刚,韦丽玲,刘敬臣
(广西医科大学第一附属医院麻醉科,南宁 530021)
与局部麻醉药(local anaesthetics,LA)神经毒性相关的椎管内神经并发症主要包括短暂性神经综合征(transient neurologic syndrome,TNS)以及马尾神经综合征(cauda equina syndrome,CES),一旦发生,轻则导致住院时间延长,医疗费用增加,重则导致永久性损害,终身残疾。但局麻药神经毒性的发生机制和有效的防治措施尚不明确。因此,探索局麻药引起神经毒性的发生机制、寻找有效治疗药物是目前迫切需要解决的问题。布比卡因作为椎管内麻醉的常用局麻药物,具有潜在的神经毒性作用。我们前期研究发现布比卡因神经毒性与神经元凋亡密切相关,但其具体机制尚未明确[1-3]。近年来,研究发现小胶质细胞在神经损伤中发挥重要作用[4-5],而布比卡因鞘内注射引起的神经毒性是否与小胶质细胞有关鲜有报道。褪黑素(melatonin,MT)是一种主要有脑松果体分泌的吲哚杂环类激素,具有抗氧化、减轻炎症反应、抗凋亡等生理作用[6]且极易通过血脑屏障。近年来,MT 的神经保护作用受到越来越多关注,有实验性研究证实,MT对急性脊髓损伤[7]及各种神经系统疾病[8]均有神经保护作用。而MT对布比卡因诱发的神经毒性是否有治疗作用,目前尚未见相关报道。本研究拟建立布比卡因脊髓神经毒性大鼠模型,并观察MT 对该模型的神经保护作用并探讨其相关机制。
1 材料与方法
1.1 药物与主要试剂
PE-10 导管购自Smith Medical 公司(英国);布比卡因(货号:B5274)和褪黑素(货号:M5250)均购自Sigma 公司(美国);CD86、Bax、IL-1β 抗体均购自沈阳万类科技有限公司,IBA1 抗体、594 荧光二抗均购自Abcam 公司(英国),GAPDH、Bcl-2 抗体购自武汉三鹰生物技术有限公司,Caspase-3抗体购自CST公司(美国);RIPA蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂、PMSF、5×蛋白上样缓冲液、BCA检测试剂盒、柠檬酸钠抗原修复液、DAPI染液均购自碧云天生物科技有限公司(中国),ECL化学发光试剂盒购于沈阳万类科技有限公司。
1.2 实验动物
SPF级成年雄性SD大鼠24只,体重260~280 g,购于广西医科大学实验动物中心,实验动物生产许可证号:SCXK 桂2020-0003,实验动物使用许可证号:SYXK 桂2020-0004。对大鼠进行分笼饲养,随意获得食物及水,并在20~25 ℃下保持12 h/12 h 明暗循环。本动物实验已取得广西医科大学实验动物伦理委员会批准,审批号:202007057,严格遵循“3R原则”进行。
1.3 动物分组与给药
按随机数字表法把24 只SD 大鼠均分为4 组:假手术组(S 组)、生理盐水组(N 组)、布比卡因组(B 组)、褪黑素与布比卡因共处理组(M 组),每组6只。B组及M组各鞘内注射5%布比卡因0.12 mL/kg,共3次,每次间隔90 min;M组鞘内注射后立即腹腔注射MT 12.5 mg/kg,连续3 d,每天1 次。B 组鞘内注射后立即腹腔注射与M 组等量MT 溶媒,连续3 d,每天1 次;N 组鞘内注射生理盐水0.12 mL/kg,共3 次,每次间隔90 min,腹腔注射MT 溶媒同B组;S组鞘内置管后,不行鞘内注射,腹腔注射MT溶媒同B组。各组于给药后3 d取材。
1.4 蛛网膜下腔置管动物模型的建立
采用改良Yaksh 法[9]对各组大鼠进行鞘内置管。鞘内置管前用生理盐水冲洗无菌PE-10 导管,于L5~L6椎间隙置入。如置管过程中,大鼠出现甩尾反应、导管内有清亮脑脊液流出,则可证明导管在蛛网膜下腔。固定导管,皮下埋管于颈部引出,再次固定导管于颈部皮肤,后封口。置管后单笼饲养2 d,下肢出现运动障碍者予以剔除;其余大鼠予以鞘内注射2%利多卡因20 μL,注射后30 s 内出现下肢及鼠尾丧失感觉且不能活动,并于30 min内恢复者,为造模成功,否则予以剔除。成功造模的大鼠,单笼饲养2 d后用于后续实验。
1.5 检测指标
1.5.1 光镜观察HE染色病理学改变 各组大鼠于水合氯醛麻醉后,用4 ℃生理盐水行心脏灌注直至肝脏发白,立即取出脊髓腰膨大组织置于4%多聚甲醛中固定24 h后,石蜡包埋,5 μm厚连续切片,后行HE 染色,显微镜下观察各组脊髓组织病理学改变。
1.5.2 Western blotting法检测各组相关蛋白表达 提取组织总蛋白,BCA 法检测各组蛋白浓度,加入上样缓冲液混匀,煮沸变性分装后待用;SDSPAGE 凝胶电泳使蛋白分离,后蛋白湿转至PVDF膜,5%脱脂牛奶室温封闭1 h;一抗:Bcl-2、Caspase-3、CD86(1∶1 000),Bax(1∶800)、IL-1β(1∶500)以及内参蛋白GAPDH(1∶5 000)4 ℃条件下过夜;TBST洗膜;二抗HRP 标记山羊抗兔(1∶10 000),室温孵育1 h,TBST 洗膜;ECL 化学发光发暗室曝光显影,结果用Image J软件分析,以目的条带灰度值与内参蛋白GAPDH条带灰度值的比值来反映对应蛋白的相对表达水平。
1.5.3 免疫荧光法检测各组IBA1 免疫阳性细胞率量 取各组相应石蜡切片,60 ℃烤箱烤片1~2 h,脱蜡后用柠檬酸钠行抗原修复,PBS洗片,0.5%Triton X-100室温通透10 min,PBS洗片,5%驴血清室温封闭1 h,IBA1 一抗(1∶50)4 ℃孵育过夜,PBS 洗片,羊抗鼠594 荧光二抗(1∶100)室温避光孵育 1 h,PBS漂洗后DAPI染核室温5 min,PBS洗片,滴加抗荧光猝灭剂盖盖玻片封片;于荧光显微镜下观察拍照,蓝色荧光为细胞核染色,代表整片所有细胞数,红色荧光为IBA1 免疫阳性细胞数,代表小胶质细胞数量。结果用Image J软件测定各组IBA1免疫阳性细胞数并进行分析。阳性细胞率越高,表示小胶质细胞增殖越多。
1.6 统计学方法
采用SPSS 20.0 统计软件分析数据。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 脊髓组织病理学改变
S 组和N 组脊髓组织光镜下未见明显异常改变,灰质及白质结构致密,细胞排列规则,神经元形态正常、结构完整,细胞核正常清晰,尼氏小体丰富。B 组脊髓组织损伤严重,灰质和白质区域有空泡形成,细胞排列紊乱,神经元细胞水肿或萎缩,胞核固缩,尼氏小体溶解,出现小胶质细胞吞噬现象。M组脊髓组织损伤较B组轻,灰质及白质水肿空泡较少,损伤神经元减少,见图1。
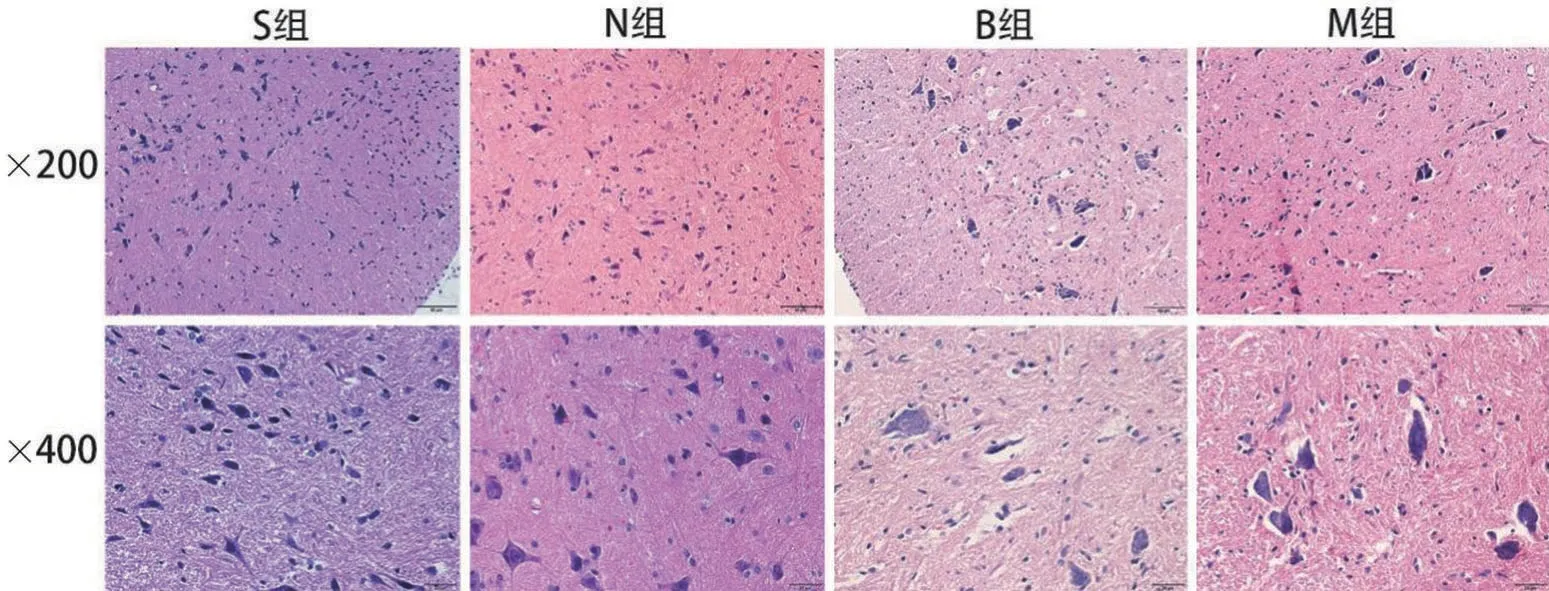
图1 各组HE染色光镜下脊髓组织损伤情况
2.2 各组脊髓组织Bcl-2、Bax、Caspase-3、CD86、IL-1β的蛋白表达比较
与S组比较,N组凋亡相关因子Bcl-2、Bax、Caspase-3、小胶质细胞M1型激活相关因子CD86、炎性因子IL-1β蛋白表达无明显差异(均P>0.05)。与N组比较,B组和M组Bax、Caspase-3、CD86、IL-1β 蛋白表达明显上升,Bcl-2 蛋白表达明显下调(均P<0.05)。与B组相比,M组Bax、Caspase-3、CD86、IL-1β 蛋白表达明显下调,Bcl-2 蛋白表达上升(均P<0.05),见图2。

图2 各组蛋白相对表达量比较
2.3 各组脊髓组织IBA1免疫阳性细胞率比较
与S 组相比,N 组IBA1 免疫阳性细胞率无明显差异(P>0.05)。与N 组比较,B 组和M 组IBA1 免疫阳性细胞率明显升高(P<0.05)。与B 组相比,M 组IBA1 免疫阳性细胞率明显降低(P<0.05),见图3、图4。

图3 各组IBA1免疫荧光染色情况
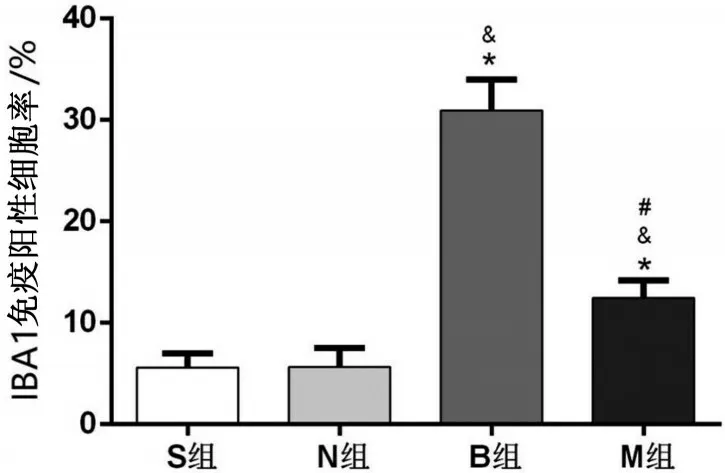
图4 各组IBA1免疫阳性细胞率比较
3 讨论
LA 因其确切的麻醉镇痛效果,在临床上被广泛运用于椎管内麻醉。椎管内麻醉是指将LA注入蛛网膜下腔或者硬膜外腔,暂时阻断神经传导功能,从而使该神经支配的区域产生麻醉效果。但随着临床经验的积累及相关理论研究发现,LA 具有潜在的神经毒性,运用于椎管内麻醉时,可导致围术期神经并发症发生。神经细胞死亡是LA神经毒性的主要病理学改变。布比卡因作为临床常用的蛛网膜下腔LA 已被证实可致神经元凋亡[10-11]。本实验对成年雄性SD大鼠行椎管内置管术,将5%布比卡因注入到蛛网膜下腔,建立布比卡因脊神经毒性大鼠模型。本课题组前期研究发现,该模型大鼠于给药后3 d损伤最严重[2-3],因此,本研究在给药后3 d处死大鼠并完成相关实验。
小胶质细胞作为中枢神经系统的免疫活性细胞,对内环境的微小病理改变极为敏感。当神经元受到损伤时,内源性胶质细胞会增多,这一现象称为“反应性胶质增生”,这是一个涉及小胶质细胞增殖、募集和激活的过程。IBA1是小胶质细胞和巨噬细胞特异性的钙结合蛋白,在中枢神经系统中可特异性标记小胶质细胞。研究发现,在急性脊髓损伤大鼠模型中可见IBA1 免疫阳性小胶质细胞增殖[12]。小胶质细胞有静止和激活两种状态,其中激活状态可分为经典激活M1 型和交替激活M2 型。其中,被激活的M1型小胶质细胞主要释放IL-1β等促炎因子[13]。在大脑中动脉缺血再灌注大鼠模型中,M1型小胶质细胞释放的IL-1β可导致神经元损伤[14]。有文献报道,将利多卡因注射到背根神经节可引起常驻免疫细胞的激活及引起神经炎症[15]。CD86 高表达于M1 型小胶质细胞,常作为M1 型小胶质细胞标记物[16]。本研究发现,S 组及N 组IBA1免疫阳性细胞数、CD86 及IL-β 蛋白表达量无明显增多,表明置管操作及鞘内注射生理盐水未引起小胶质细胞增殖、激活;与N组相比,B组及M组IBA1免疫阳性细胞数明显增多、CD86及IL-1β蛋白表达量相对于N组明显上调,表明5%布比卡因鞘内注射可导致大鼠脊髓组织小胶质细胞增殖、M1 型激活增多及IL-1β表达增多;与B组相比,M组上述各指标表达减少,表明MT可减轻5%布比卡因鞘内注射导致的小胶质细胞增殖、激活。
当受到有害刺激时,神经细胞可发生尼氏体溶解、神经元萎缩及脱髓鞘等基本病理改变,如病变持续发展,最终可导致神经细胞死亡。当神经细胞死亡后,小胶质细胞发生增生性变化,对坏死的神经元进行包围吞噬作用,这一过程称为小胶质细胞的嗜神经细胞现象。本研究发现,S 组及N 组脊髓组织HE 染色光镜下观察结构致密,神经细胞形态正常;与N组相比,B组及M组神经细胞发生不同程度萎缩、尼氏体溶解及形态改变,嗜神经细胞现象增多;与B组相比,M组损伤神经细胞及嗜神经细胞现象减少。综上所述,表明鞘内注射5%布比卡因可导致大鼠脊髓组织及神经细胞损伤,而MT 可减轻该损伤。Bcl-2、Bax 及Caspase-3 是常见的凋亡相关蛋白,Bcl-2 可抑制细胞凋亡的发生,Bax 可促进细胞凋亡,细胞凋亡是否发生主要由Bcl-2及Bax决定,而Caspase-3是细胞凋亡过程中主要的终末剪切酶。研究表明,Bcl-2 蛋白表达降低、Bax 及Caspase-3蛋白表达增多是细胞凋亡增多的迹象[17]。本研究发现,S 组及N 组凋亡相关蛋白蛋白水平无明显升高或降低;与N组相比,B组及M组抗凋亡分子Bcl-2 蛋白水平下调,促凋亡分子Bax、Caspase-3 蛋白水平上调;与B 组相比,M 组抗凋亡因子Bcl-2 蛋白表达上调、促凋亡因子Bax及Caspase-3蛋白表达下调。表明MT 可减少5%布比卡因鞘内注射导致的大鼠脊髓细胞凋亡。
MT是主要由松果体在昼夜节律的暗相合成和分泌的激素,具有神经保护作用。与MT 神经保护作用相关的机制有抑制促炎细胞因子、减少氧化应激、抗细胞凋亡及钙离子拮抗等[18]。其中,抑制促炎因子的机制与小胶质细胞密切相关,有文献报道,MT可以通过多种信号通路抑制小胶质细胞的过度激活,减少炎症因子和自由基的产生[19]。在脊髓损伤小鼠模型中,发现MT 可以减少小胶质细胞增殖并下调IL-1β的表达,从而发挥神经保护作用[12]。与上述研究结果相似,本研究发现MT可减轻5%布比卡因鞘内注射引起的脊神经毒性,减少脊髓组织小胶质细胞增殖及下调IL-β蛋白表达;与上述研究结果不同在于,本研究发现MT下调IL-1β蛋白水平可能与抑制小胶质细胞向M1型激活相关。
本研究存在一定局限性,虽然发现了布比卡因的脊神经毒性与小胶质细胞增殖及M1 型激活相关,但其具体机制尚不明确;在该模型中,M1 型小胶质细胞对神经元细胞的确切影响也有待更深入研究。此外,已证实MT 可通过抑制小胶质细胞增殖激活及下调IL-β 对布比卡因脊神经毒性模型大鼠发挥神经保护作用,但MT 是否通过其他途径发挥神经保护作用还有待进一步研究。本研究通过建立动物模型寻找LA神经毒性的可能机制,为LA神经毒性的防治提供了新的实验思路及治疗靶点。
