粪菌移植疗法对大鼠脊髓损伤后的作用研究*
2022-01-24刘明富农海斌宗少晖
刘明富,刘 槃,宁 宇,张 琼,农海斌,宗少晖△
(1.广西医科大学第一附属医院,南宁 530021;2.广西医科大学公共卫生学院,南宁 530021)
脊髓损伤(spiral cord injury,SCI)是由于脊髓结构破坏,引起脊髓神经功能障碍的中枢神经系统疾病[1-3],2017年调查显示,我国SCI发病数高达37/100万人[4],其中北京60.2/100 万,上海25/100 万[5],给社会带来沉重负担。SCI 后免疫细胞出现过度活化,免疫炎性因子如白细胞介素(IL)、肿瘤坏死因子(TNF)-α、补体蛋白分子等大量释放,形成炎性因子风暴,对SCI 处组织及细胞进行暴风雨般的自杀式攻击,给机体组织造成扩大化的损害[6-7]。因此,控制损伤部位过度的炎性反应在SCI后继发性损伤及神经再生等一系列重要进程中可发挥关键性作用。肠道菌群是位于肠道中的共生微生物群,在机体生理活动中发挥着关键作用。最新研究发现,肠道菌群能够影响机体免疫系统,在维持免疫细胞功能上发挥重要的作用,由肠道菌群失衡引起的免疫炎症过度激活,可影响到中枢系统疾病[8]。近年来,粪菌移植(FMT)研究进展迅猛,一开始常用于胃肠道疾病,近些年来也开始用于自身免疫性疾病、神经系统疾病等[9-10]。本研究拟探讨FMT 对大鼠SCI 后炎性反应的影响及可能机制,对FMT 疗法能否促进SCI修复进行评价,为其临床应用提供理论依据。
1 材料与方法
1.1 实验动物 SPF 级成年SD 大鼠36 只,体重180~220 g,由广西医科大学实验动物中心提供,动物生产许可证号:SCXK(桂)2020-0002,动物使用许可证号:SYXK(桂)2020-0003。所有动物置于SPF级动物房内饲养,温度20~25 ℃,相对湿度50%~60%,12 h/12 h明暗循环。适应性喂养1周后开始实验。本研究动物实验符合伦理审查标准(编号:201910031),严格遵循“3R”原则。
1.2 SCI 模型的建立 通过改良Allen's 击打法建立SCI模型。大鼠麻醉后,取仰卧位;以T10为中心点,切开皮肤约4 cm,分离各层组织,暴露脊髓组织,脊髓呈现乳白色,使用克氏针(10 g)于3.5 cm高度进行垂直击打,此时大鼠尾巴摆动,双后肢及躯体轻微抽搐并伸缩,脊髓迅速充血、水肿,提示造模成功。
1.3 粪菌液的制备 收集健康大鼠新鲜粪便,使用烧杯称取10 g,加入生理盐水50 mL充分搅拌,使用100 μm 滤网进行过滤,滤液以12 000 r/min 离心10 min,取沉淀加入等量生理盐水,重复上述步骤3次,粪菌液制备完成。
1.4 实验分组和处理 将SD 大鼠随机分为3 组,即对照组(A组)、SCI组(B组)、FMT治疗组(C组),每组12只。A组仅手术暴露,不进行击打,B组和C组建立SCI 模型。C 组灌胃给予菌液,1 次/d,剂量为10 mL/kg,连续灌胃14 d,A组和B组灌胃给予等量生理盐水。
1.5 肠道菌群测序 于术后14 d 收集各组粪便标本,采用16S rDNA V3-V4高度保守区进行HiSeq平台测序。
1.6 体重和Basso-Beattie-Bresnaha(BBB)评分各组分别于术前(0 d)及术后1 d、3 d、7 d、14 d称体重,并评估大鼠后肢功能恢复情况。BBB评分分为3个部分:(1)0~7分,评估后肢踝关节、膝关节和髋关节恢复情况;(2)8~13 分,评估后肢的承重和前、后肢协调恢复情况;(3)14~21 分,评估后肢主动爪位置与身体平行情况[11]。评分越高,表明大鼠运动功能恢复越好。
1.7 脊髓组织IL-10、IL-4 和IL-17 含量测定 术后14 d,取脊髓组织按照1∶10(g/mL)比例加入RIPA 裂解液,充分研磨后再冷孵育20 min 充分裂解,14 000 r/min 离心20 min,取上清液,采用酶联免疫吸附试验(ELISA)法检测脊髓组织中IL-10、IL-17和IL-4含量。
1.8 苏木精—伊红(HE)染色 术后14 d,取损伤处脊髓组织用4%多聚甲醒固定24 h,梯度乙醇脱水,石蜡包埋,3 μm厚切片,行HE染色;冲洗,干燥,树脂封片,显微镜下观察脊髓组织病理学改变。
1.9 尼氏染色 制作病理切片(步骤同HE 染色),采用焦油紫作为核心染料,染色1 h 后用离子水冲洗,用分化剂进行脱色,乙醇脱水和二甲苯透明后用中性树胶封片。尼氏体呈深蓝紫色颗粒或斑块状,细胞核淡蓝色,背景无色或浅蓝色。
1.10 统计学方法 采用SPSS 23.0 统计软件进行数据分析,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 HiSeq平台测序结果 物种累积曲线反映的是抽样个数对物种多样性的影响;当抽样个数较少时,发现的物种并不全面,并不能表征整个群落结构,随着抽样个数的增加,发现的物种数越来越多,也更能表征这个群落结构。当曲线末端上升趋势趋于平缓时,则表明采样量足够,见图1A。在关键物种门水平差异比较结果中,B 组拟杆菌门(Bacteroidetes)和螺旋体菌门(Saccharibacteria)数量减少(P<0.05,P<0.01),变形菌门(Proteobacteria)数量增多(P<0.05),表明SCI 后肠道菌群发生了改变,见图1B。

图1 HiSeq平台测序结果
2.2 3 组大鼠体重比较 与A 组比较,B 组和C 组在术后1 d体重无明显差异(P>0.05),术后3 d、7 d、14 d 体重均明显下降(均P<0.05);与B 组比较,C组于术后1 d、3 d、7 d、14 d 体重均无明显差异(均P>0.05),见图2。
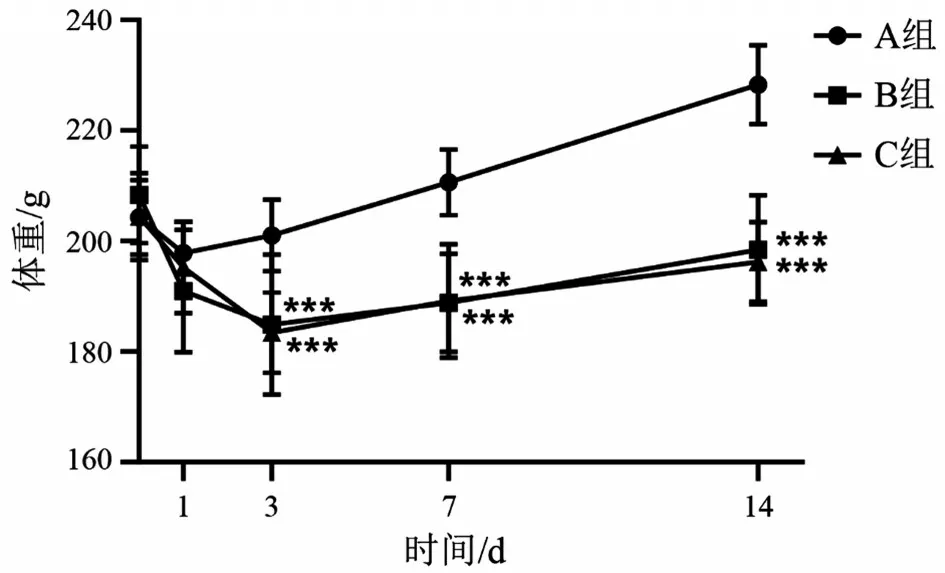
图2 SCI后大鼠体重变化
2.3 3 组BBB 评分比较 与A 组比较,B 组与C 组术后1 d,3 d,7 d,14 d的BBB评分均明显下降(P<0.05);与B 组比较,C 组术后1 d,3 d,7 d,14 d 的BBB评分均明显升高(均P<0.05),见图3。
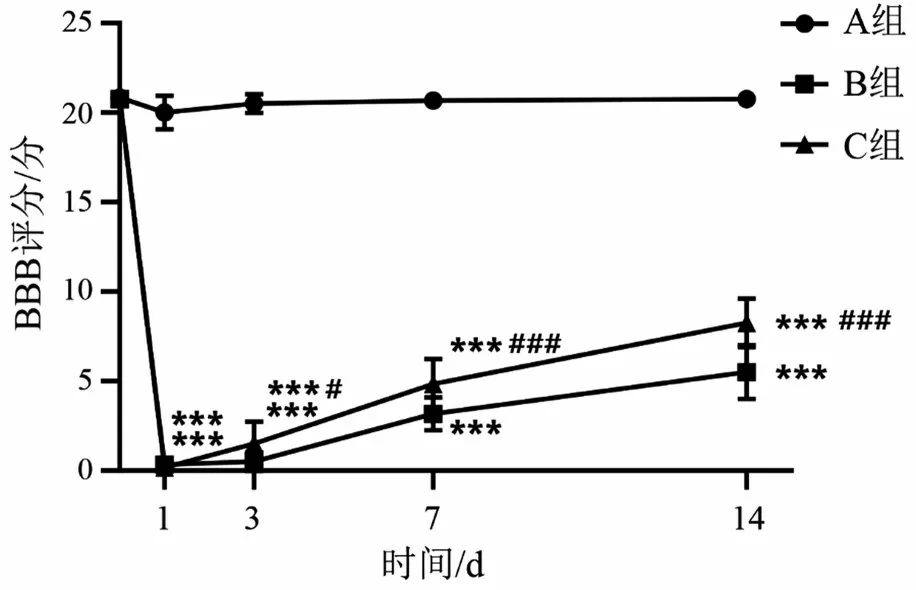
图3 SCI后大鼠运动功能变化
2.4 3 组脊髓组织炎症因子水平比较 与A 组比较,B组脊髓组织IL-10含量显著下降,IL-17含量明显上升(均P<0.05),C 组IL-10 和IL-4 含量明显上升,IL-17含量明显下降(均P<0.05);与B组比较,C组IL-10 和IL-4 含量明显上升,IL-17 含量明显下降(均P<0.05),见图4。
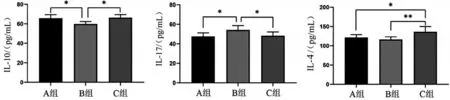
图4 SCI后14 d 3组脊髓组织炎症因子水平比较
2.5 脊髓组织病理学变化 A组脊髓组织规整,细胞大小形态正常;B组在损伤处有炎性细胞浸润,细胞数量减少,有空泡,出现病理性改变;C 组损伤情况明显减轻,细胞变性水肿情况改善,见图5。
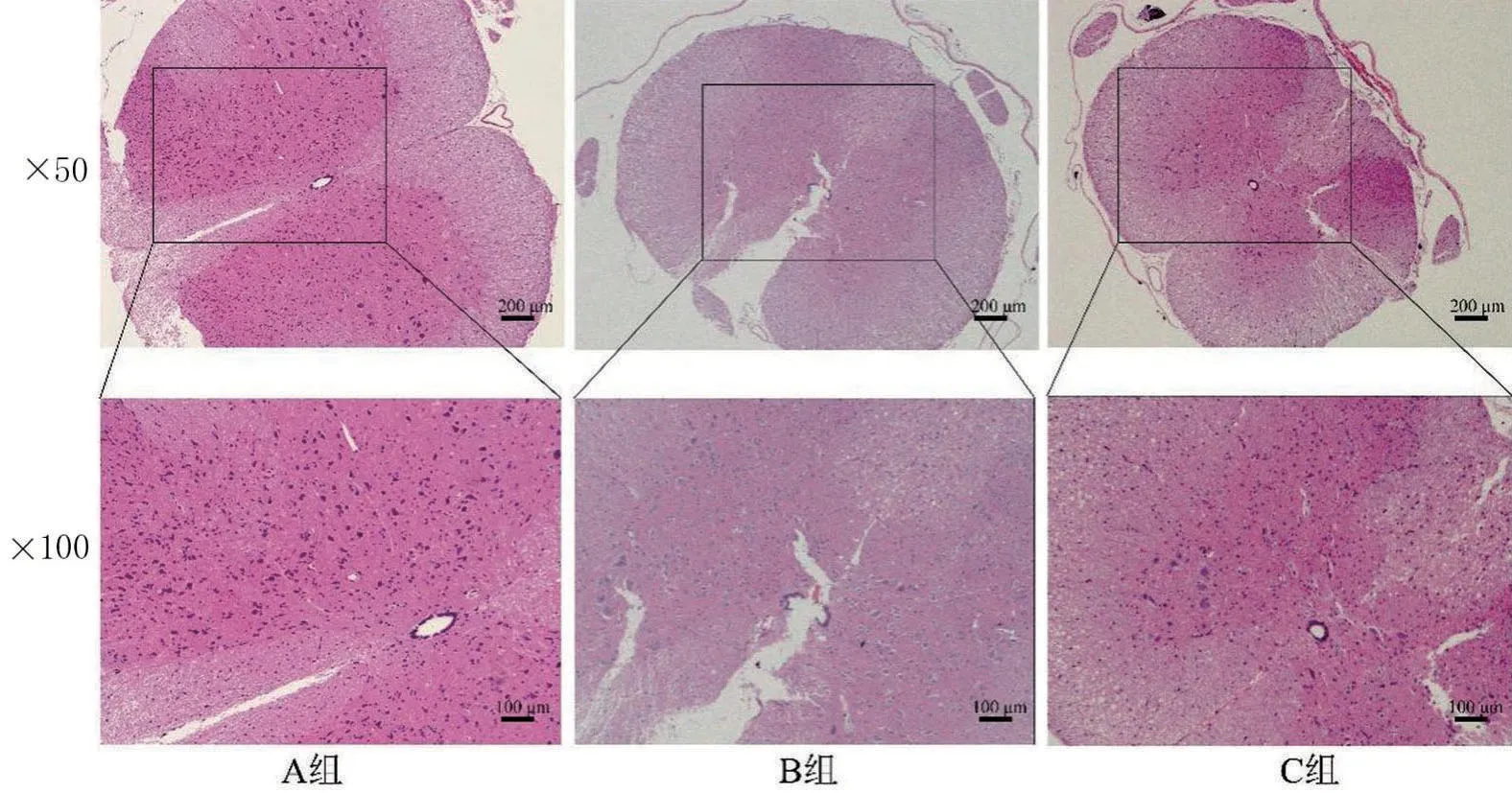
图5 SCI后14 d脊髓组织HE染色图
2.6 脊髓组织神经元形态观察 A 组神经元细胞形态清晰完整,胞核较大且呈圆形,有数量较多的尼氏小体;B组神经元细胞出现溶解坏死,存活的神经元形态各异大小不一,尼氏小体数量相较于A组明显减少;C组神经元细胞相较于B组细胞核清晰,坏死细胞减少,尼氏小体数量增多,见图6。
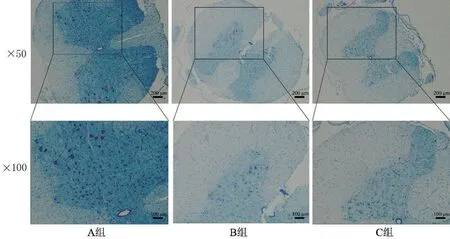
图6 SCI后14 d脊髓组织尼氏染色图
3 讨论
SCI 后的继发性损伤是指脊髓破坏后,由免疫失衡、自由基诱导的细胞焦亡等引起的瀑布放大式组织自毁级联反应,会导致损伤区域扩大,使瘫痪扩展到更高节段,其损毁程度远大于脊髓破坏本身[12]。因此,抑制SCI 后由免疫失衡引起的炎症反应对促进SCI 修复具有重要意义。16S rRNA 测序结果中,损伤组Bacteroidetes 和Saccharibacteria数量减少,Proteobacteria数量增加,使损伤组肠道菌群平衡失调。Proteobacteria包括很多病原菌,如沙门氏菌、霍乱弧菌、幽门螺杆菌等都对人体有害。而Bacteroidetes可以产生短链脂肪酸,其作为能源物质,可纠正电解质,降低神经胶质细胞NF-κB 的活化,进而减少促炎因子的释放从而保护神经元[13],因此,纠正SCI 后的肠道菌群紊乱具有潜在的治疗作用。本实验使用FMT 治疗维持肠道菌群平衡后发现,C 组BBB 评分比损伤组有明显提高,提示维持肠道菌群平衡对SCI 后神经功能恢复有促进作用。但大鼠体重经FMT治疗后并没有显著升高,可能的原因是治疗时间不够,体重回升较慢。HE 染色和尼氏染色结果显示,SCI后组织存在炎性浸润,出现了神经元细胞溶解坏死,尼氏小体数量急剧减少,经过FMT 治疗后,脊髓组织中炎性反应减少,坏死细胞数量减少,尼氏小体数量增加,提示FMT 疗法可改善脊髓组织的形态与功能。
免疫失衡导致的炎症是继发性SCI中主要的损害因素之一。SCI 时可激活神经细胞、胶质细胞等产生促炎细胞因子(IL-17、TNF-α)、趋化因子(MCP-1、MCP-2)、金属蛋白酶等,进一步攻击脊髓组织[14]。其中IL-17 可通过激活NF-kB 信号通路促进各种细胞因子的表达[15],引起炎性级联放大反应,加重SCI。IL-10主要由调节性T细胞分泌,对TNFα、IL-17等促炎因子起到抑制作用,进而阻断小胶质细胞的抗原呈递功能以及减少星形胶质分泌炎性因子[16]。IL-4 主要由活化T 细胞产生,在炎症反应中起到抗炎作用[17],可缓解炎症因子对脊髓组织的破坏。研究结果发现,SCI 组脊髓组织中的促炎因子IL-17含量上升,而抗炎因子IL-10和IL-4含量下降,经FMT 治疗后,IL-17 的释放得到抑制,含量较SCI 组有明显下降,而IL10 和IL-4 含量升高,提示FMT疗法能够有效抑制炎症反应,降低脊髓继发性损伤带来的危害。
综上所述,FMT 疗法能够降低SCI 后脊髓组织中的炎症反应,减少由IL-17 引起的炎性级联放大效应,通过调控免疫平衡从而抑制脊髓继发性损伤中的炎症反应,进而在SCI的治疗中发挥重要作用。
