Pristane诱导小鼠弥漫性肺泡出血模型的建立及评估*
2022-01-24孙宏梅农光民
孙宏梅,农光民,陈 峋
(广西医科大学第一附属医院儿科,南宁 530021)
系统性红斑狼疮(systemic lupus erythemato-sus,SLE)是一种涉及多器官系统和组织的多因素、异质性自身免疫性疾病。弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH)是SLE 的肺部严重并发症[1],常导致急性呼吸衰竭,以咯血、呼吸困难及快速进展的贫血为临床特点,胸部X 线或高分辨CT常提示双侧弥漫性肺泡浸润[2]。在SLE 的病人中,DAH 发病率仅为0.6%~5.4%[3],但死亡率可高达29.2%~61.9%[4]。DAH的诊断依赖于临床表现结合实验室、放射学以及必要时的肺部病理检查。支气管镜下肺泡灌洗时,同一病变部位连续3 次出现血性且逐渐加深的灌洗液支持DAH诊断。此外,在支气管肺泡灌洗液中,含铁血黄素细胞≥20%也可诊断DAH,并且含铁血黄素细胞的多少与病情严重程度密切相关[5]。目前临床上,DAH 的治疗以糖皮质激素、免疫抑制剂为主[6],也有用利妥昔单抗[7]、血浆置换[8]、丙种球蛋白[9]、间充质干细胞移植[10]、活化因子VII[11]、ECMO[12]治疗的个案报道。然而,有文献指出,现有的治疗方式虽能缓解DAH 临床症状,但副作用明显且易复发[13-14]。此外,目前临床上仍缺少关于DAH治疗的随机对照试验,且尚无统一治疗方案。因此,DAH小鼠模型的建立及评估有利于通过动物实验为DAH 的治疗打下理论基础。目前小鼠DAH的诊断主要是以肺部病理检查为主,这一定程度上限制了动态观察小鼠肺出血的严重程度,同时也阻碍了动态评估药物干预DAH 小鼠的疗效。有研究表明,DAH 患者在急性期时肺部CT 多呈磨玻璃影改变,可根据磨玻璃影的密度来判断肺出血的严重程度[15];此外,在慢性发作期或复发期DAH患者的肺CT 多呈现支气管或细支气管扩张、网状或蜂窝状改变[16],因此高分辨CT在DAH的诊断、病程及肺出血程度的判断中起重要作用[17]。基于以上,笔者希望通过Pristane 诱导建立小鼠DAH 模型并从临床、影像以及病理学三方面对其肺出血的严重程度进行综合评估,为后续探讨DAH的疗效提供评价指标。
1 材料与方法
1.1 实验动物 由长沙天勤实验动物公司提供SPF 级雌性,8~10 周龄、体重(20±2)g 的C57BL/6J小鼠,动物实验许可证为SCXK(湘)2019-0014。饲养环境为温度22~26 ℃,相对湿度40%~70%,SPF级动物实验室适应性喂养1周后进行试验。小鼠随机分为实验组和正常对照组,每组9 只。本研究经广西医科大学第一附属医院医学伦理委员会批准通过[伦理编号:2020(KY-E-048)]。
1.2 主要试剂及仪器 Pristane(大连美仑生物技术有限公司),PBS、普鲁士蓝染色试剂盒、苏木精-伊红(HE)染液(武汉谷歌生物科技有限公司),切片机(德国徕卡公司),光学显微镜(日本Olympus 公司),CoulterLH750 型自动血液学分析仪(美国贝克曼公司),小动物多排Mirco-CT 成像系统(Latheta LCT-200,日本Hitachi Aloka医疗公司)。
1.3 造模与分组 采用电脑随机分配代码的方法将小鼠随机分为实验组和正常对照组,并分别予一次性腹腔注射0.5 mL 的Pristane[18]或等量PBS。每日监测小鼠体重。
1.4 小鼠一般情况观察 每日测量小鼠体质量并记录,同时观察小鼠活动度、毛色、皮肤、呼吸等一般情况[19]。
1.5 血常规检查 干预后第14 天通过小鼠眼球采血,血液与乙二胺四乙酸二钾(EDTAK2)混合抗凝,用自动血液学分析仪检测红细胞(RBC)计数、血红蛋白(Hb)浓度。
1.6 Micro-CT 检查 分别于第0、第7、第14、第21天对小鼠进行Micro-CT检查,动态观察小鼠肺部影像学情况。
1.7 肺组织病理学观察 药物干预后第14 天处死小鼠。打开胸腔,分离出两肺,对比两组小鼠肺组织大体病理改变。随后将小鼠肺组织经4%多聚甲醛固定24 h,石蜡包埋,脱蜡水洗后分别进行苏木精—伊红(HE)染色及普鲁士蓝染色,镜下对比观察其病理学改变。
1.8 统计学方法 采用SPSS 17.0软件进行数据分析,计量资料用均数±标准差()表示,组间采用两独立样本t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般情况比较 经Pristane腹腔注射的小鼠逐渐出现毛色无光泽、消瘦、贫血(足底苍白无血色)等征象(图1),同时伴有呼吸急促、行动缓慢、弓背、颤抖等症状,而正常对照组小鼠无上述情况出现。

图1 干预后正常对照组(A)和实验组(B)的一般情况比较
2.2 两组体重变化比较 药物干预前两组小鼠体重比较,差异无统计学意义(P>0.05),干预第7 天两组小鼠体重比较,差异仍无统计学意义(P>0.05)。但干预后第14 天正常对照组体重上升而实验组体重明显下降(P<0.05),见图2。除此之外,实验组第14 天时体重较第7 天时下降(3.57±1.13)g,下降幅度约17.62%,而较干预前体重下降(2.74±1.57)g,下降幅度约14.10%。
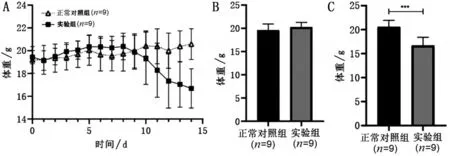
图2 干预后小鼠体重变化趋势
2.3 两组血常规比较 与正常对照组比较,实验组RBC 计数均值下降4.27×1012/L,Hb 浓度均值下降58.17 g/L,实验组Hb 浓度及RBC 计数明显低于正常对照组(均P<0.001),见图3。
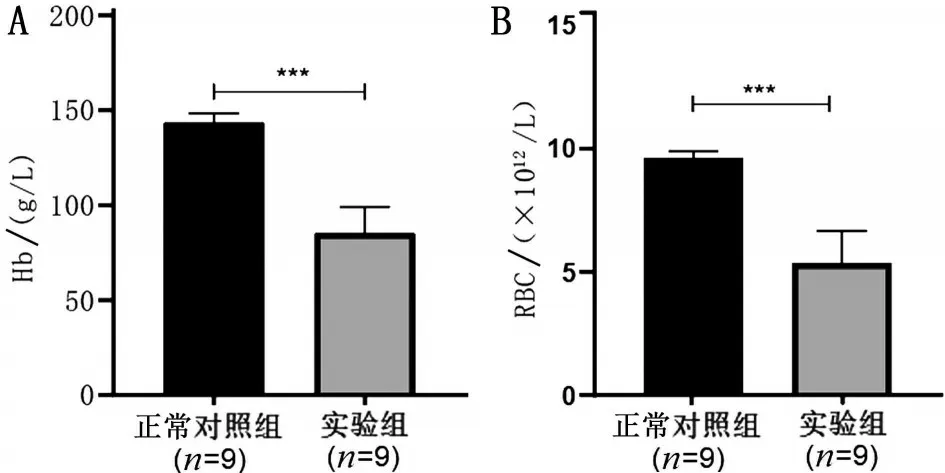
图3 干预后小鼠的Hb(A)和RBC(B)水平比较
2.4 两组影像学表现比较 与正常对照组比较,实验组小鼠肺部CT在第14 天、21 天可观察到双肺透光性降低,多个肺叶呈斑片状密度增高影和毛玻璃样阴影,边界模糊,见图4。
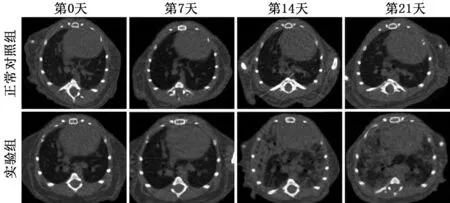
图4 干预后不同时间段正常对照组和实验组小鼠的肺部CT影像学表现
2.5 两组病理学表现比较 肺组织大体病理观察:根据肺出血面积将肺大体病理分为无出血(0%)、部分出血(25%~75%)和完全出血(75%~100%)[13,20-21]。PBS 干预后的正常对照组,在各阶段肺组织始终呈淡红色,未见出血及组织肿胀(无出血)。而Pristane干预后的实验组,在第7天即可见肺组织颜色暗红,部分肺叶散在分布的点状出血灶(部分出血),肺组织肿胀不明显。在第14 天则可见实验组肺组织颜色进一步加深,各肺叶呈大片状出血或弥漫性出血(完全出血),肺组织明显肿胀,见图5。
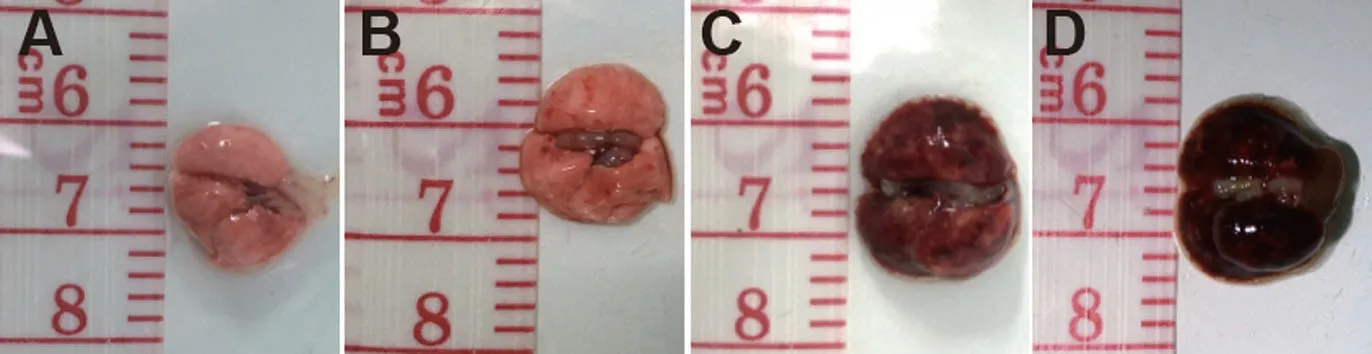
图5 两组小鼠肺组织病理学表现染色结果
HE染色下,PBS干预的正常对照组在各阶段均可见肺组织结构完好,肺泡腔内无出血,肺泡壁无增厚。而Pristane 干预的实验组在第7 天即可见到肺组织部分结构消失,肺泡壁可见巨噬细胞及中性粒细胞等炎症细胞浸润,肺泡腔内少许红细胞;在第14天实验组则可见肺组织结构紊乱,炎症细胞浸润明显,肺泡腔内可见大量红细胞,肺泡壁及毛细血管壁增厚,见图6。
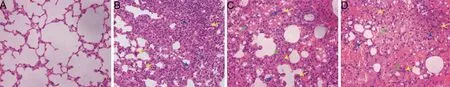
图6 两组小鼠肺组织HE染色结果(×400)
普鲁士蓝染色下,正常对照组小鼠肺组织在各阶段始终呈阴性反应。而实验组在第7天可见部分肺组织的肺泡腔及间隔内少许呈阳性反应的肺含铁血黄素细胞,在第14天实验组则可见大量肺含铁血黄素细胞分布于肺泡腔和间隔内,见图7。
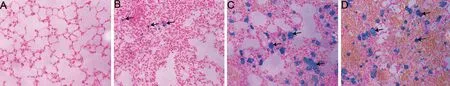
图7 两组小鼠肺组织普鲁士蓝染色结果(×400)
3 讨论
目前国内外对于SLE-DAH 的临床研究多限于个案报道和小样本的队列研究[22-24],且尚无统一的治疗方案[6]。临床研究表明,DAH 作为SLE 致命性并发症,多发生在SLE病程的早期,且可独立导致SLE总体存活率的降低[24]。在本研究中发现Pristane 诱导小鼠第14 天时DAH 发病率约为51.06%,死亡率约为7.14%。因此,早期诊断DAH及急性期的有效治疗对改善SLE 患者的预后及生存质量至关重要[25]。
Pristane是一种饱和萜类烷烃,常用于诱发啮齿动物关节炎[26]和狼疮[27-28],其经腹腔注射后可诱导小鼠出现与人类SLE 相关性DAH 相似的免疫病理学特征[29-30]。值得注意的是小鼠通常在腹腔注射Pristane后4~6个月才出现与狼疮性肾炎类似的肾脏病变,相关特异性自身抗体则在7 个月以后出现[31]。而DAH 通常出现在病程早期,Pristane 腹腔注射后14 d 内即可观察到严重的肺出血[32-33]。这与人类SLE-DAH 的起病先后顺序一定程度上是相符的[24]。因此,将其作为研究人类SLE-DAH发病机制的动物模型是可行的。本研究用Pristane 干预小鼠后第14 天,实验组小鼠肺切片HE 染色镜下可观察到各肺叶弥漫性出血、肺组织结构破坏及炎症细胞浸润等病理学表现。同时,实验组小鼠肺组织普鲁士蓝染色可观察到大量巨噬细胞吞噬渗出红细胞后形成的含铁血黄素细胞。HE染色及普鲁士蓝染色的结果与人类DAH的病理特征是相似的[34],这也提示了腹腔注射Pristane可成功诱导建立小鼠DAH模型并具有类似的DAH病理学改变。此外,通过对比第7 天时实验组的HE 染色与普鲁士蓝染色结果发现,虽然常规HE 染色可用于大多数肺出血的诊断,但在早期肺泡出血不明显时,普鲁士蓝染色或许能更加直观地通过提示含铁血黄素的存在来证实肺出血,并可评估其出血性质[34]。
本研究观察到实验组小鼠出现足底苍白无血色、行动迟缓、呼吸急促、体重下降等行为学改变,这与Chowdhary等[35]的研究结果不一致。这可能与不同的观察时间点有关。在本研究中,实验组小鼠行为学改变通常出现在Pristane腹腔注射第7天后,猜测可能与DAH 的严重程度有关。小鼠体重变化上,药物干预第7 天时两组体重并无明显差别,第7 天以后正常对照组体重继续上升,而实验组体重急剧下降(P<0.05)。原因可能是因为DAH 在第7天后迅速进展并严重影响小鼠机体功能。小鼠体重监测方便且灵敏,可综合反映小鼠机体功能情况,有研究用最大体重下降的小鼠数量占比作为评估rh-DNase-1 治疗小鼠DAH 疗效的指标[33]。本实验观察到,实验组第14 天时体重较第7 天时下降(3.57±1.13)g,下降幅度约17.62%,较干预前体重下降(2.74±1.57)g,下降幅度约14.10%,这与小鼠肺部CT 及肺组织病理切片提示的肺出血进展时间基本符合,表明通过对比造模及药物干预前后小鼠体重变化的绝对值及百分比或许在一定程度上能间接地反应药物疗效及出血程度。
在未完善支气管镜下肺泡灌洗及肺活检的患者中,明确DAH的诊断十分困难,而CT作为非侵入性诊断的检查方法,可结合贫血、咯血、呼吸困难等临床特征早期诊断DAH[36],并可根据CT 的不同影像学表现判断患者处于DAH的急性期、慢性发作期还是缓解期[16]。然而,既往并无文献资料报道关于DAH 小鼠血液学检查和肺部影像学情况。本研究发现,实验组小鼠RBC 计数均值下降4.27×1012/L,Hb浓度均值下降58.17 g/L,分析这是小鼠急性肺出血后所致失血性贫血,这与人类DAH急性期的贫血表现是一致的[6]。此外,实验组小鼠肺部CT 从第7天的轻度磨玻璃影逐渐加重,至第14~21天时呈双肺弥漫性浸润影,这也与人类DAH的影像学特征类似[6,14]。小动物多排Mirco-CT 检查灵敏度高,可重复性强,且为无创,有助于连续评估小鼠DAH 的病情进展及严重程度。这可为后续进一步研究小鼠DAH的药物治疗效果评价奠定基础。
目前已有研究通过对比各组小鼠DAH发病率、死亡率以及病理切片的出血面积[20,21,33]来进行疗效评估。但经腹腔注射Pristane 可广泛分布于小鼠体内,其细胞毒性亦可直接导致小鼠的死亡,这使得我们无法判断小鼠的死亡原因究竟是因为DAH 还是Pristane 的毒性所导致[33]。或许也可以通过动态监测小鼠行为学改变及肺部CT 来序贯评估小鼠DAH的程度,从而避免直接肺活检对实验动物的致死性。
综上,本研究证实了Pristane 诱导小鼠DAH 模型无论从临床症状、影像学、以及病理学方面均与人类DAH 具有相似性。综合动态观察小鼠行为学表现和肺部CT检查可实现对小鼠DAH的辅助诊断以及严重程度判断。
