用于治疗法洛四联症的肺瓣支架有限元评估
2022-01-24贾云超曾赣鹤陈思荆腾贺照明
贾云超,曾赣鹤,陈思,荆腾,贺照明,2
1.江苏大学流体机械工程技术研究中心生物医学工程系,江苏镇江 212013;2.德州理工大学机械工程系,美国德克萨斯州拉伯克 79409
前言
法洛四联症(Tetralogy of Fallot,TOF)是先天性心脏病中最常见的发绀性心脏病,发病率为0.19‰~0.26‰。TOF 患儿连带问题是右心室流出道(Right Ventricular Outflow Tract,RVOT)或肺动脉瓣狭窄,治疗方法有姑息手术和根治手术。姑息手术常应用于因各种原因(如肺动脉发育不良)而不能够直接进行矫正术的患儿,优先保证患儿的存活,再争取进一步手术的机会[1-4]。根治手术即四联症矫正术,通过各种方式疏通或重建RVOT,具体术式包括RVOT 切开疏通、RVOT 补片、肺动脉瓣及瓣环切开、跨瓣环补片、带瓣膜跨环补片、同种或异种带瓣管道替换等等,但会导致迟发渐进的再狭窄合并肺动脉瓣反流[5-6]。对于成年后愈发严重的患者,一般采用二次开胸手术重建RVOT 或带瓣管道中功能不全的肺动脉瓣。当前经导管肺动脉瓣置换术(Transcatheter Pulmonary Valve Replacement,TPVR)是自Bonhoeffer 教授[7]于2000年首次报道后逐渐兴起的一种微创介入手术方式,可以代替外科开胸肺动脉瓣置换。但由于介入瓣的植入通常需要一定的环形锚定区,即支架的支撑段,植入部位的解剖结构若不能提供支架的良好锚定,很可能会出现支架的上移、下滑或无法完全打开[8]。而初次手术后RVOT 解剖类型多样[9],或带瓣管道中无处锚定,因此在二次介入治疗时容易出现支架无支撑段的问题。对介入瓣的设计、释放的位置和扩张的大小有很高的要求,有时还需采用包括预支架在内的改良植入技术[10-11]。这样非手术方式植入的人工瓣膜常常表现出固定性不足,从而导致狭窄和/或反流[12]。同时,二次放置的介入瓣膜寿命有限,易遭受组织变性、结构性瓣膜退化、细胞排斥反应和体细胞生长,通常10~15年后会出现衰败,因此需要进行远期干预[13-16]。尤其是对婴幼儿植入带瓣导管后,下一次瓣膜更换的中位时间仅为7.5年,2岁以下患者RVOT 重建手术5年后免于再次干预的比例仅为46.1%[17-18]。为了避免再次开胸手术,患者难免会采取瓣中瓣技术在已经衰败的介入瓣中再经皮植入一个新瓣膜[19]。
为了解决上述介入瓣难以固定和需要多次更换瓣膜的问题,本文提出一种针对婴幼儿手术放置肺动脉瓣的治疗方法。这种肺动脉瓣由金属支架和生物材料瓣膜构成,支架内嵌生物瓣瓣叶,直接在开胸手术时作为手术瓣放置,局部缝合固定。支架的设计考虑了二次扩张和介入瓣支撑。随着患者年龄的增长,初次放置的肺动脉瓣相对于人体需求显得狭窄,此时采用介入球囊对初次瓣膜进行2 mm 的扩张,以缓解远期狭窄,由于初次瓣膜预留了余量,所以撑开2 mm 之后不会出现反流。患者成年后,在生物瓣膜接近失效达到狭窄限度时进行第二次扩张,采用瓣中瓣治疗,在初次瓣膜中放置一个介入瓣,期望初次瓣膜支架能够成为新植入介入瓣的支撑段,本研究以21.6 mm为第二次扩张后的最大目标尺寸[20-21]。
本文研究目的是:(1)讨论这种肺瓣支架的力学行为,评估其可行性和安全性;(2)比较分析支架网格交接处对支架性能的影响。应用有限元分析方法,设计了两类网格连接构型(“X”型和“H”型)的肺动脉瓣支架,针对球囊扩张支架过程和撤去球囊卸载过程进行模拟。探究两次扩张方案是否可行,期望支架不会断裂或大幅度回弹,即是否产生一定的塑性变形,使得支架保持新的形态,同时也不会因应力过大而产生断裂的危险。在过去对支架扩张进行数值分析的研究中,着重了解应力分布以及支架断裂的可能性,最高的应力一般发生在支杆交叉处,这表明该位置可能有最高的断裂风险[22-23],本文强调了两种交接段长度的差别,比较两类构型的优劣,提出优化意见。
1 材料与方法
1.1 支架设计与材料选择
支架的设计基于肺动脉瓣和管道组织的几何一致性,以及支架结构如何与RVOT 延伸相互作用,包含了确保设计实施的基本设计特征[24-27]。使用三维CAD 建模软件Solidworks 建立两个支架几何模型,不考虑内嵌的生物瓣膜。支架内径12.8 mm,外径13.6 mm,壁厚0.4 mm,网格宽0.3 mm,近端至远端距离(即长度)为17.3 mm,谷部至近端距离9.2 mm,由120°的阵列组成,两个支架唯一区别在于具有重复的“X”型还是“H”型菱形网格交叉结构,其中“X”型支架的网格连接段长度为0.2 mm,“H”型支架为0.4 mm,如图1所示。将其导入Hypermesh 中划分有限元网格,在Hyperview和ABAQUS中进行分析。
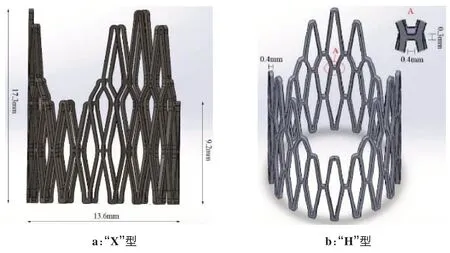
图1 肺瓣支架几何模型Figure 1 Geometric models of pulmonary valve stents
支架的常用材料有不锈钢和镍钛合金。镍钛合金作为一种记忆合金,具有很好的机械强度、疲劳性能和生物相容性,目前广泛应用于支架产品中。本文支架的植入方式为开胸手术放置,不是通过鞘管介入放置,所以不需要利用超弹性和形状记忆的特性,且需要支架产生一定的塑性变形以使其稳定,不至于回缩。因此,我们选择316L不锈钢,该材料机械性能优良,在X 射线下具有较好的可视性,也具有很好的耐腐蚀性[28-30]。材料参数如表1和图2所示,其中延伸率即发生永久变形而不至于断裂的性能,是塑性应变部分的百分比表示,同种材料的极限应变量是大于延伸率的,因此如果塑性应变与延伸率相比仍然更小,则材料一定安全。

表1 316L不锈钢材料参数Table 1 Material parameters of 316L stainless steel
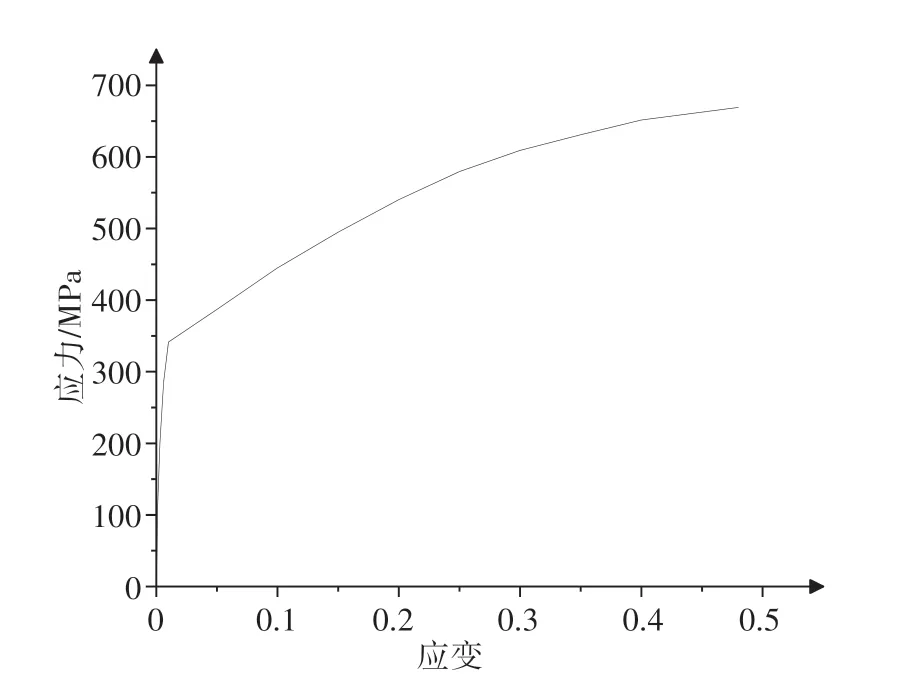
图2 316L不锈钢本构曲线Figure 2 Constitutive curve of 316L stainless steel
1.2 有限元分析
支架与球囊的有限元模型如图3所示。球囊模型通过圆柱面建立,直径与支架模型的内径相同,支架和球囊的中心点与轴线重合,在球囊和支架的内表面之间建立接触单元,设置面与面接触(surface-tosurface contact),接触类型为罚函数接触(penalty contac tmethod),不考虑摩擦,假设始终为圆形扩张,初始应力为零,约束支架和球囊的轴向位移和整体的周向转动。支架和球囊的单元类型分别为六面体线性非协调模型单元(C3D8I)和四边形曲面单元(SFM3D4R)。用位移载荷替代实际的压强载荷,在球囊的内表面施加位移加载,进行匀速扩张,再撤掉球囊卸去载荷,支架自由回缩。由于材料属性为率无关,采取Standard 隐式分析,则增量步中包含的时间步为迭代步,所以计算结果与步长无关。定义了4个分析步(Step)。Step 1:第1 次扩张的加载过程(球囊加载扩张支架);Step 2:第1次扩张的卸载过程(撤去球囊使支架自由回弹);Step 3:第2 次扩张的加载过程(球囊加载扩张支架);Step 4:第2次扩张的卸载过程(撤去球囊使支架自由回弹)。每个分析步的名义时间设置为1,再均分为10个增量步。
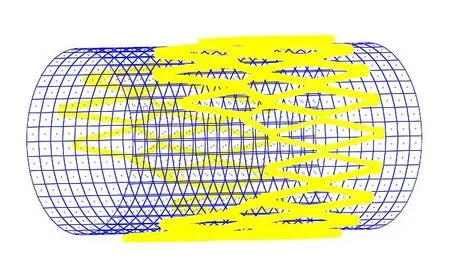
图3 肺瓣支架有限元模型Figure 3 Finite element model of pulmonary valve stent
观察支架的变形和弹性恢复。记录各变形过程中的应力应变,应力采用von Mises应力,特别是关注加载过程结束后最大应力的分布。应变采用等效塑性应变,这是记录变形历史的一个表征塑性应变累积值的量,会把回缩时产生的塑性应变也计算进去,将其与材料的工程参数延伸率对比,重点关注卸载过程结束后的等效塑性应变分布。选择支架危险结点,提取应力-应变曲线,记录不同位移加载下的变形结果,包括径向扩张量、径向回复率、锥度,径向回复率是表征支架回缩的参数,锥度表示支架由圆柱形向锥形变化的程度,分别定义为:

在前期的仿真中发现,较小扩张量的情况下,支架径向回复率较大,这样的回缩导致支架并不能完全达到既定的直径,因此要以高于既定扩张量的数值进行扩张。第1 次扩张量设置为直径2.5 mm,第2次扩张是在此基础上继续将支架直径扩张6 mm。
2 结果
2.1 第1次扩张
图4展示了第1 次扩张阶段“X”型和“H”型支架的Mises 应力。如图4a、b 所示,支架主体区域,即支柱和网格交叉区域的部分节点应力已超出材料的屈服强度340 MPa,进入强化阶段,最大应力分别为371.7 Mpa(“X”型)和367.5 MPa(“H”型)。相比加载,卸载后的应力大幅减少,如图4c、d 所示,最大应力分别降低至347.8 MPa(“X”型)和341.0 MPa(“H”型)。最大应力均出现在连接交叉处。图5展示了第1 次扩张阶段“X”型和“H”型支架的等效塑性应变。如图5a、b 所示,主体区域产生的等效塑性应变在0.005左右,网格交叉处的应力集中点产生较大应变,最大等效塑性应变为0.060(“X”型)和0.053(“H”型)。相比加载,卸载后的等效塑性应变有极小的增加(图5c、d)。第1 次扩张阶段加载后和卸载后的支架扩张量如图6所示。卸载回弹后支架躯干部分径向位移为0.93 mm(“X”型)和0.96 mm(“H”型),径向回复率均为17%。但支架近端会大量回缩,远端继续产生少量的扩张,由圆柱形变为远端宽近端窄的锥形,其中最大直径出现在远端,为16.17 mm(“X”型)和16.24 mm(“H”型),最小直径出现在近端,为14.76 mm(“X”型)和14.78 mm(“H”型),锥度分别为0.081 6(“X”型)和0.084 6(“H”型)。
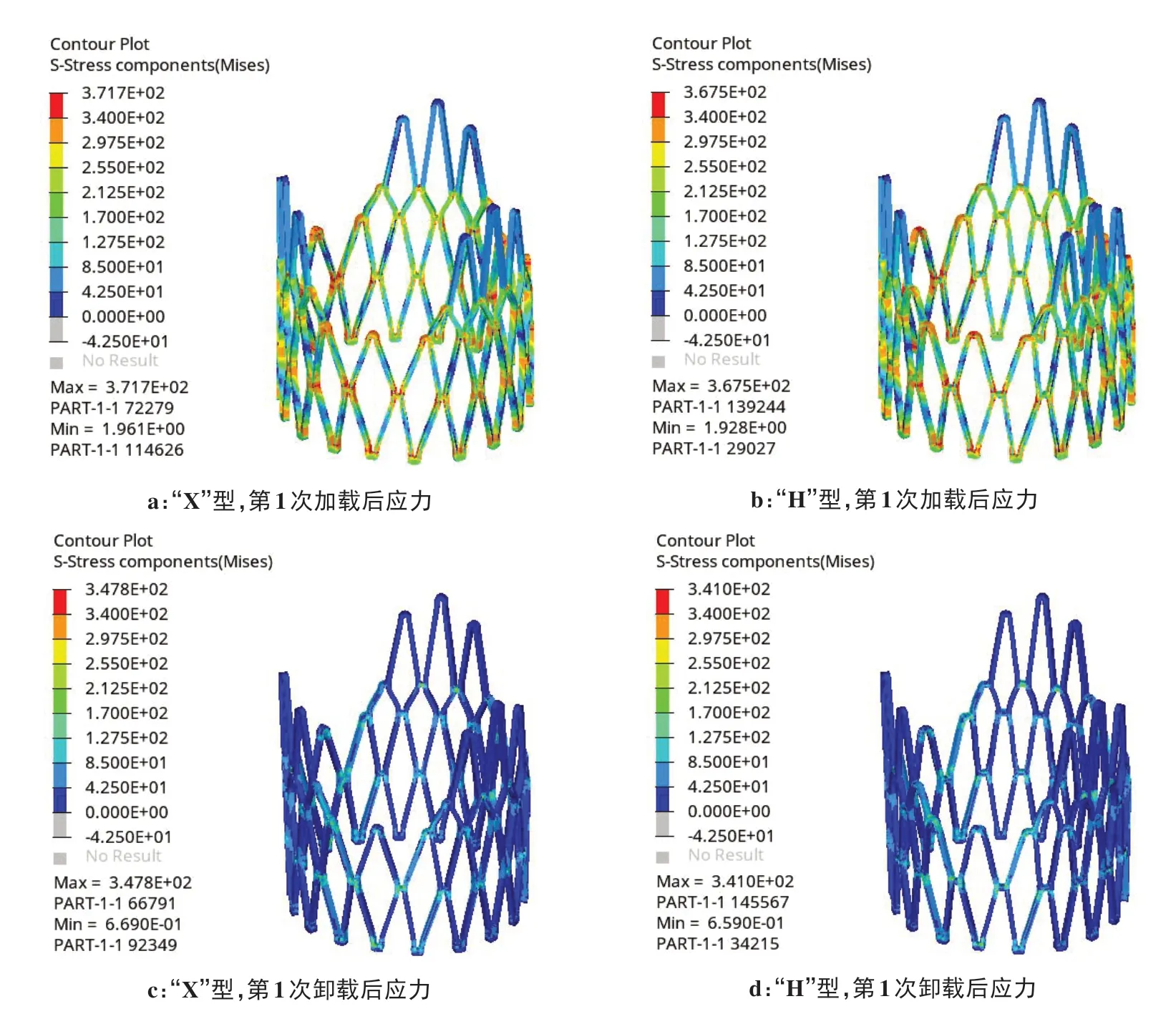
图4 第1次加载后和卸载后的应力Figure 4 Stresses after the first loading and unloading
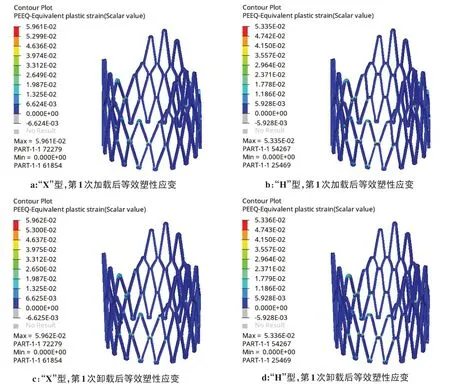
图5 第1次加载后和卸载后的等效塑性应变Figure 5 Equivalent plastic strains after the first loading and unloading
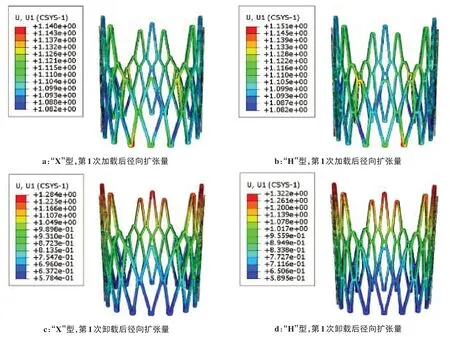
图6 第1次加载后和卸载后的径向扩张量Figure 6 Radial expansions after the first loading and unloading
2.2 第2次扩张
图7展示了第2 次扩张阶段的Mises 应力和等效塑性应变。在球囊加载过程中,两种支架主体区域的应力变化均不大,最终维持在400 MPa以内。加载后最大应力为472.3 Mpa(“X”型)和471.4 MPa(“H”型),卸载后最大应力分别降低至397.4 MPa(“X”型)和365.3 MPa(“H”型)。图8展示了第2 次扩张阶段的等效塑性应变。等效塑性应变大多在0.001~0.01范围内,即使是网格交接处的单元达到2.040(“X”型)和2.005(“H”型),也未超出材料破坏极限。正如材料本构曲线所示,在大变形后期,应力的变化幅度减小,而应变变化明显。此阶段支架径向扩张量如图9,两种支架差别不大,加载过程总体均达到需求的直径,即21.6 mm,卸载回弹后支架主体区域直径约为21.4 mm,径向回复率约为2%,锥度分别为0.083 5(“X”型)和0.082 3(“H”型)。
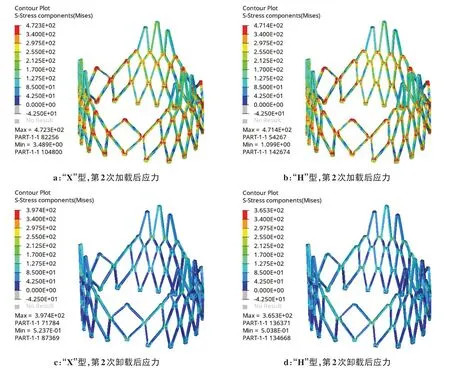
图7 第2次加载后和卸载后的应力Figure 7 Stresses after the second loading and unloading
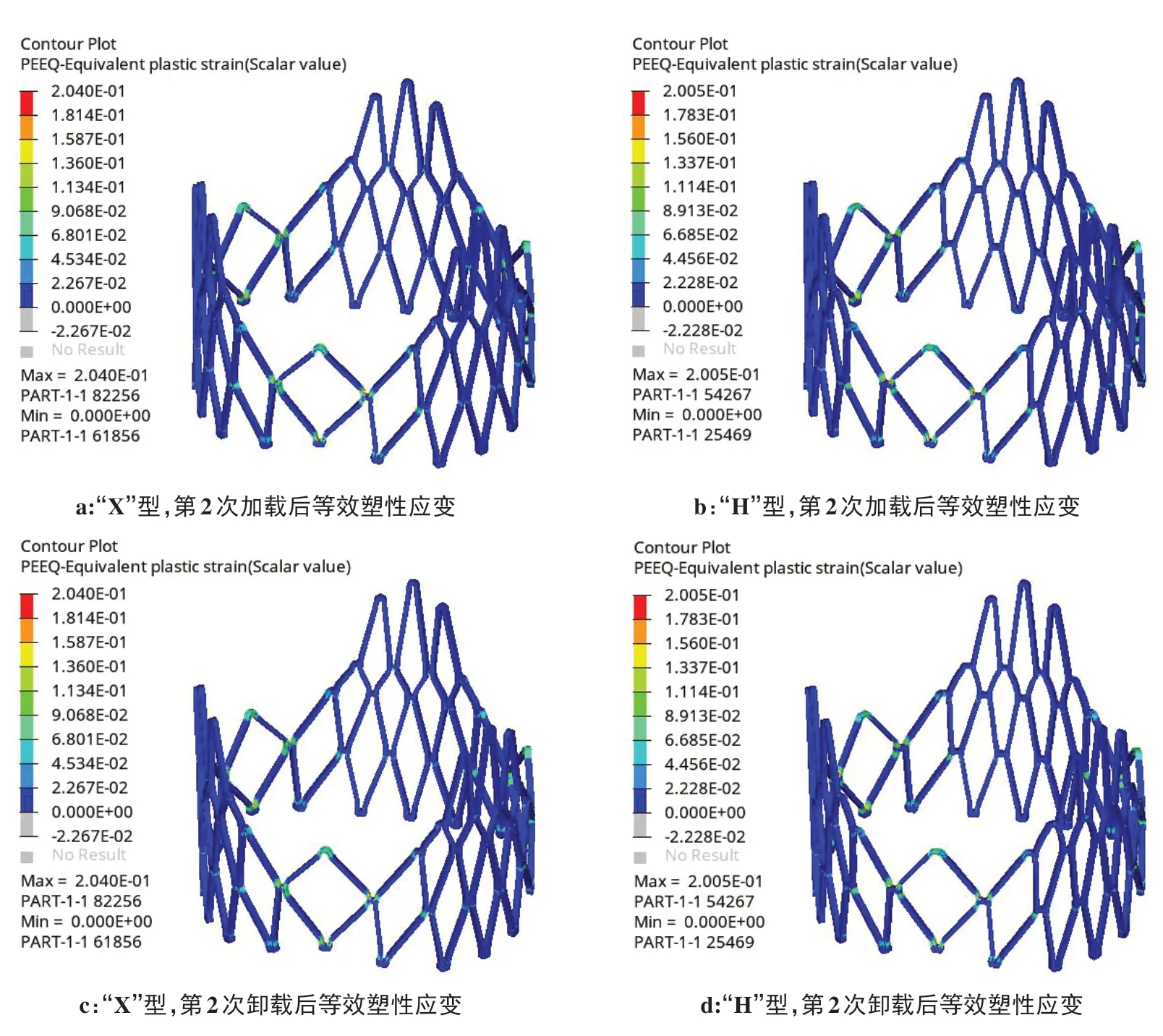
图8 第2次加载后和卸载后的等效塑性应变Figure 8 Equivalent plastic strains after the second loading and unloading
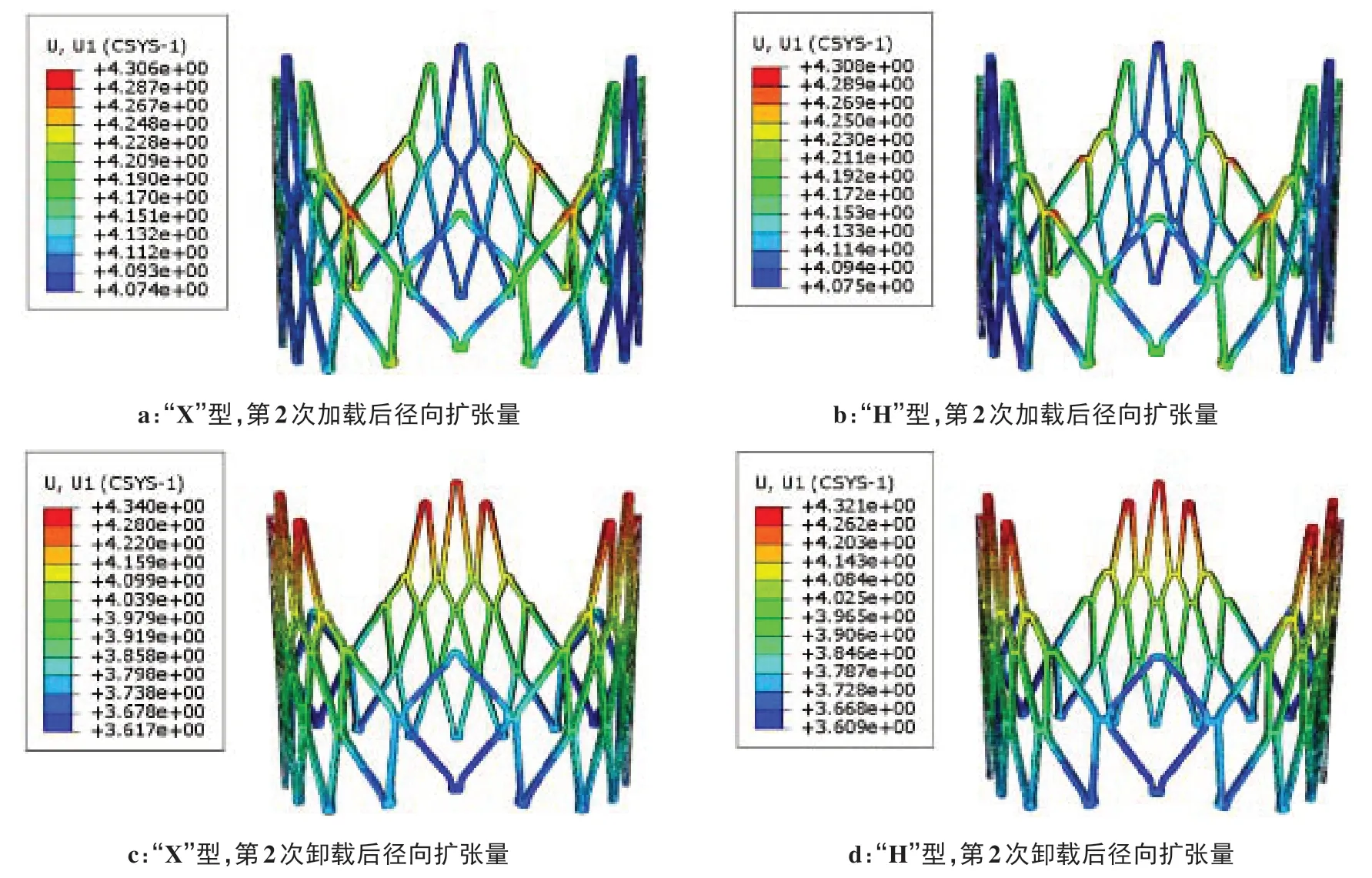
图9 第2次加载后和卸载后的径向扩张量Figure 9 Radial expansions after the second loading and unloading
2.3 检验一点的力学变化
危险点容易出现在网格交接处,在“X”型支架的等效塑性应变云图中找到最大值点A(图10)。查询A 点等效塑性应变、Mises 应力和扩张量的数值曲线(图11a、b、c),其中横坐标为时间步,0~1为第1 次加载过程,1~2为第1 次卸载过程,2~3为第2 次加载过程,3~4为第2次卸载过程,并绘制应力-应变曲线(图11d)。该点第1 次扩张过程结束后等效塑性应变达到0.044 0,由于这是一个累积量,因此不会减少,在第2 次扩张过程结束后达到了0.199 5。加载过程中材料很快进入塑性变形,之后应力增长缓慢,卸载时,应力下降并再次缓慢回升,这是弹性变形部分的应力恢复,和由于自由回缩而新产生的塑性变形。位移同样产生回缩,径向回复率约为7%。观察应力-应变曲线,具备明显的塑形材料本构特征,第1 次扩张加载时达到弹性极限,小部分进入塑性变形,卸载时恢复弹性部分,保留塑性应变,第2 次扩张再次完成弹性变形,后续全部为塑性变形。A点力学行为符合材料变形规律和设计要求。

图10 A点的位置Figure 10 Location of point A
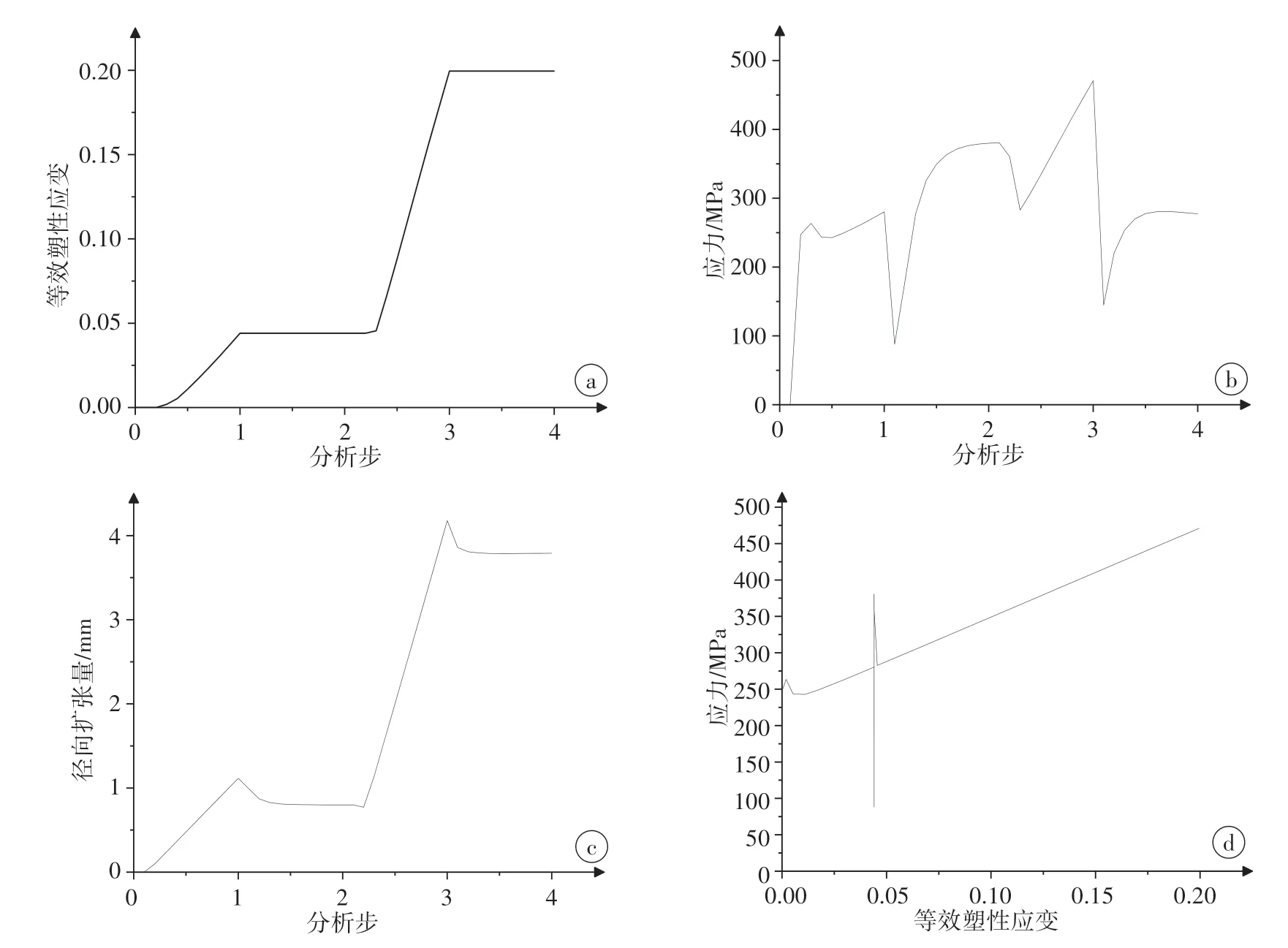
图11 A点的等效塑性应变曲线(a)、应力曲线(b)、扩张量曲线(c)以及应力-应变曲线(d)Figure 11 Equivalent plastic strain curve(a),stress curve(b),expansion curve(c)and stress-strain curve(d)of point A
3 讨论
3.1 治疗方法
在目前的研究中,提出一种治疗TOF 肺动脉狭窄的新方法,即在开胸手术时作为手术瓣放置肺动脉瓣,远期介入球囊进行二次扩张,在生物瓣膜接近失效达到狭窄限度时进行第三次瓣中瓣治疗,初次放置的肺动脉瓣支架作为其支撑段。对于过去的治疗方法,人工瓣膜和带瓣管道缓解了最初的症状,但也是导致再次手术的重要原因,需要远期复杂的支架介入过程。文中提出的治疗方法中,带瓣支架在开胸手术时就植入体内,并能够进行两次扩张以适应患者人体变化,起到长久治疗作用。
本文对方法中的肺动脉瓣手术支架的力学行为进行了分析,用有限元法模拟了球囊扩张和自由回缩过程。对两种连接构型的肺瓣支架,从Mises 应力、等效塑性应变、扩张量等方面进行了评估,为这种支架的设计进行验证和提供指导,并强调了支架网格连接方式产生的影响。一般来说,基于类似产品的临床应用,该手术支架可能是一种可行的设计。
3.2 应力、应变
在新型支架设计中,模拟扩张和卸载过程,找到扩张时的最大应力和卸载后的塑性应变出现的位置和大小,并将其与支架材料参数进行比较。当产生稳定的塑性变形,不会过度回缩或产生不可控的扩张时,即达到需求。而当塑性变形过多,产生安全隐患,就要设法提高材料的强度,或对支架结构进行优化,避免支架因过度扩张而造成的损坏。本研究中支架的应力和塑性应变均在可接受范围之内,并能维持变形后的新形态,作为瓣中瓣的支撑平台,验证了该方法可行。
设计之初考虑到网格交接处会产生较大应力和应变,因此将连接方式作对照。结果表明,“X”型支架和“H”型支架表现出相似的应变和应力行为,相比“X”型支架,“H”型支架显示出更低的应力和塑性应变。同时,“X”型支架在每次卸载后,主体区域的应力回复量大于“H”型支架,说明“X”型支架更容易被撑开和回缩,即稳定性不足。因此可以增加连接点接触面积或夹角,使拐角处过渡更为平缓,能够有效改善应力过大的危险,减少应力集中点,并增强稳定性。
3.3 扩张量
径向回复率和锥度也是优化支架设计的重要指标。虽然该支架可以安全达到想要的扩张量,但支架径向回复率较大,这样的回缩导致支架并不能完全达到既定的直径,比如文中第1 次扩张,想达到最终扩张量为2 mm,需要进行2.5 mm 的加载。但值得注意的是,临床应用中是实时操控球囊,因此相比于最终扩张量,我们应当更关注对支架锥形变化的改善。第1次扩张时支架近端回缩严重,远端容易受到近端影响,整体会变为锥形,原因是近端网格密集,远端稀疏,近端更易回缩,在回缩时如同杠杆般使得远端向外扩张,并且该扩张量大于远端本身的回缩量。也正因如此,回缩过程会产生塑性应变。而第2次扩张支架的锥度变化并不明显,这是更多的塑性应变产生发挥的作用。对比“X”型支架和“H”型支架,径向回复率无明显差异,但可以注意到,“H”型支架锥度略小于“X”型支架。综上所述,拥有更低的应力应变、更强的稳定性和更小锥度的“H”型支架是更好的选择。
3.4 局限性
本研究仅利用有限元模拟评估了肺瓣支架的两次扩张过程,没有对所提治疗方法进行临床验证。
4 结论
提出了一种治疗婴幼儿TOF 的临床应用方法,初次手术时开胸植入肺动脉瓣,不需要远期复杂的支架介入过程,能够进行两次球囊扩张以适应患者变化,起到长久治疗作用。并对该肺瓣支架进行了设计和研究,有限元分析结果表明:(1)支架扩张和卸载后的应力和塑性应变均在可接受范围之内,并能维持变形后的新形态,作为瓣中瓣的支撑平台,验证了该方法的可行性;(2)最大应力和塑性应变出现在支架网格交接处,数值大小取决于连接方式,连接段越短,应力和塑性应变越大;(3)改善支架网格的连接处,可以有效降低应力应变、提高稳定性和减小锥形化。为肺瓣支架的设计修正提供了指导。
