经颅直流电刺激治疗时颅内电场数值仿真
2022-01-24刘习杰谭云华
刘习杰,谭云华
1.宜春学院电子通信系,江西宜春 336000;2.北京大学应用电子学研究所,北京 100871
前言
经颅直流电刺激(transcranial Direct Current Stimulation,tDCS)是一种神经调控技术,作为非侵入式物理治疗,越来越多地用于精神疾病和疼痛管理。美国食品药品监督管理局(FDA)报告认为tDCS具有操作简单,使用成本低廉的优点,是一种相对新颖,较少设备依赖的脑刺激形式,对患者的终生和慢性治疗更可行[1]。
Knotkova等[2]研究论文指出,连续5 d tDCS临床治疗慢性疼痛后,患者自我评估减轻疼痛有效。神经性疼痛组中有76%患者表示有效,包含面部疼痛、疱疹神经痛和复杂的局部疼痛综合征。受伤性疼痛治疗组中77%患者表示有效缓解疼痛,包括腰痛。头痛治疗组中,83%患者表示治疗有效。Knotkova临床试验结果还表明tDCS对多种其它慢性疼痛也具有镇痛效果。tDCS 还能治疗多种精神健康疾病。Nitsche 等[3]、Bennabi 等[4]研究表明tDCS 对抑郁症有改善作用。Herrera-Melendez[5]运用tDCS 对患有精神分裂症以及药物依赖上瘾患者进行治疗,试验具有疗效结果。除此之外,Fregni[6]临床试验验证tDCS可以增强记忆。
tDCS 通过置于头皮的一对或多对电极,以弱直流电无创地刺激大脑皮层的兴奋性。tDCS电极上常施加小于2 mA 的电流。有阳极刺激(anodal stimulation)和阴极刺激(cathodal stimulation)两种工作模式,见图1[7]。阳极刺激产生内向电流,膜电位朝着去极化变化(兴奋性刺激),而阴极刺激引起外向电流,膜电位朝着超极化(抑制性刺激)进行[5]。神经元对刺激活动的响应与治疗电极设定极性相关。颅内极性根本上由颅内电场的空间分布决定,与神经元所在空间位置相关;所以,对颅内电场分布进行数值量化分析,有助于深入理解tDCS治疗的有效性。
有研究指出,大脑个体之间的差异导致tDCS治疗结果变化,使得不同临床研究结果的可重复性普遍较低[8-9]。如果对颅内电场分布进行数值量化分析,可以直接对比个体治疗靶区的电场强度是否变化,是否高于0.7 V/m的有效刺激阈值,可更准确解释tDCS治疗有效性机制。笔者注意到国内关于tDCS的研究较少讨论治疗靶区电场强度,比方胡昔权教授[10]在讨论tDCS结合虚拟现实训练治疗脑卒中患者上肢功能时,就没涉及治疗靶区的有效电场刺激强度。
将tDCS 具体治疗实施方案比喻成治疗处方,那么讨论tDCS 治疗处方的功效,会涉及到电流强度和刺激持续时间等刺激剂量参数。临床试验处方多遵循安全电流2 mA 的限制,采用25 和35 cm2两种规格的电极片,治疗持续时间为5~30 min。处方的不同电流强度和治疗持续时间设定,会影响治疗有效性[11]。tDCS治疗处方还关联电极放置位置和馈电极性。电极位置借用10-20脑电图电极系统标记,如图2所示。作为示例,在表1中,给出了6 种治疗处方。其中重度抑郁症(MDD)处方,阳极连F3,阴极连FP2、F8;精神分裂症治疗处方,阳极连F3 和FP1,阴极连TP3。表1是文献中用35 cm2电极进行治疗的部分处方[6,12-16]。
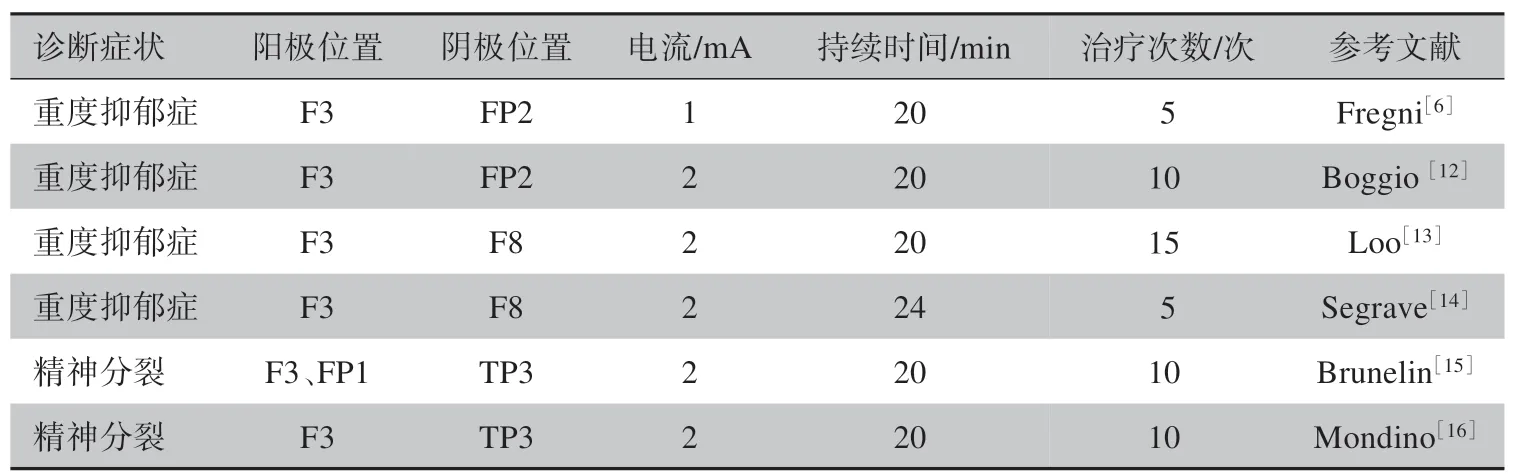
表1 用35 cm2电极进行治疗的部分处方Table 1 Partial prescriptions for treatment with 35 cm2 electrodes
1 脑组织分割和电场计算模型的网格生成方法
分析计算颅内电场数值,先得获取3D头颅数据。头颅数据可由Philips Achieva机器采集成年男子头颅MRI 数据。Achieva MRI 机器的空间分辨率为(1×1×1)mm3,数据输出格式为DICOM。该机器可扫描256层,每层视野范围(256×256)mm2;层厚1 mm,无间隙。
取得MRI 数据后,接着通过脑组织分割标定不同脑组织相对区域位置。脑组织分割目的是完成脑内电磁场不同介质边界的定义。脑组织分割可由ScanIP软件进行处理。ScanIP是一款数字3D图像建模工具软件,能完成MRI 图像数据导入,组织分割处理等一系列过程。ScanIP还内嵌网格生成模块,输出结果可以直接导入COMSOL,并在COMSOL 中进行有限元计算。此外,ScanIP 还导入事先由Solidworks设计的tDCS电极设计文件。
在ScanIP 输入成年男子头颅MRI 数据,通过设置灰度,ScanIP 自动按灰度将组织定义为不同脑组织。选择脑组织灰度值需要脑解剖知识,并反复尝试。此脑组织自动分割过程不完善,后续要借助ScanIP 软件内嵌的3D 可视化交互编辑工具,对自动分割的结果做人工编辑,例如处理骨骼、大脑皮层折叠、脑脊液(CSF)等的MRI对比度缺失。编辑过程需脑组织解剖知识,才可正确完成组织分割修改。全部头颅组织分割完成后,得到脑组织区域分布。图3展示重建后3D 模型结果,依次为白质、灰质、CSF、颅骨、脂肪、头皮。

图3 ScanIP中脑组织分割后部分结果Figure 3 Some results of brain tissue segmentation in ScanIP
接着建立头颅网格数据模型,准备有限元数值计算。在此之前,需要导入事先设计的tDCS电极文件,此电极文件可由Solidworks创建。电极导入,放置在选定位置,结果见图4。考虑网格生成参数关乎有限元数值解运算迭代次数和计算精度,因此在网格生成时要合理平衡网格生成密度、总节点数、模型复杂性、准确性之间的关系。选择网格密度即精度配置,对体积小的脑组织,或对重要研究区域,选高精度。对于体积大,或对于非重点研究区域,选低精度。精度设置完成后,在网格创建算法窗口界面单击“+FE free”。

图4 两对电极放置在F3(正极)-P08(负极)和F4(正极)-P07(负极)Figure 4 Two pairs of electrodes are placed at F3(anode)-P08(cathode)and F4(anode)-P07(cathode)
完成网格生成的各项配置,单击“Full model”,启动ScanIP 网格划分,开始创建有限元计算网格。使用四核3.1 GHz CPU 和512 GB 内存计算机,生成网格大约需要3 h。本例生成网格总计23 104 974 个四面体单元,其中头皮5 549 178 个,颅骨3 490 965 个,脂肪3 614 410 个。导出网格文件(COMSOL*.mph扩展文件),导入COMSOL得到图5所示模型图。

图5 导入COMSOL中的头颅网格模型图Figure 5 Head mesh model imported into COMSOL
2 tDCS治疗时颅内电场数值计算实现
实现电场数值计算,可使用开源或商用软件工具。本文讨论tDCS 治疗处方剂量数值分析,运用COMSOL Multiphysics 软件实现数值求解。COMSOL Multiphysics 是多物理学科计算仿真软件,亦能用于生物领域电磁场工程计算。基于安全的规范,tDCS 治疗处方电极最大电流设为2 mA。电极片大小为(5×7)cm2。当给电极接通直流电流时,形成一个电场边界,电场边界数值计算按照以下的步骤实施。
第一步,将已经生成的头部和电极合并网格数据导入COMSOL,如图5所示。在COMSOL中,给不同脑组织和电极的介电常数和导电率赋值,建成高分辨率3D人头电场边界问题数字模型。重建过程中,脑组织电导率引用文献[17]。皮肤电导率为0.465 S/m;脂肪电导率为0.025 S/m;颅骨电导率为0.010 S/m;CSF电导率为1.650 S/m;灰质电导率为0.276 S/m;白质电导率为0.126 S/m;电极电导率为5.99×10^6 S/m;头皮和电极间的导电胶电导率为4.5 S/m。
第二步,在COMSOL中选择遵循的物理学科。在AC/DC菜单下面选择电流交互界面。因为tDCS研究的电场是稳定,不随时间变化的,故选静态模式。继续在COMSOL中为相应边界设置电流密度和电位。本文讨论的tDCS处方,4个电极分别放置在F3(正极)-P08(负极)和F4(正极)-P07(负极)。此时边界,第一组电极中与头皮接触的阳极表面,其外加法向电流密度设为n⇀·J⇀1=2 mA/25 cm2=0.8A/m2,阴极表面接地电位φ1=0;第二组电极中,阳极法向电流密度设为n⇀·J⇀3=0.8A/m2,阴极接地电位φ3=0,颅内脑组织的各个分界边界均是电流密度法向连续且电位连续。
完成上面设置后,单击COMSOL 中计算按钮。四核3.1 GHz CPU 和512 GB 内存计算机在大约2 h后收敛,算出头颅静态电场分布。颅内电场计算主要技术路径如图6所示。

图6 颅内电场计算的技术路径Figure 6 Technical path of intracranial electric field calculation
3 颅内电场数值计算结果及讨论
用COMSOL 完成数值计算,不同的计算机性能会需要不同的时间,对于内存低配的计算机可能会出现内存不足而中断。图7~图9呈现了颅内电场的可视化图解。图7依次是白质顶视、侧视,灰质顶视、侧视,CSF 顶视、侧视,颅骨顶视、侧视,皮下脂肪,头皮的可视化电场分布。

图7 颅内脑组织电场分布Figure 7 Electric field distribution of intracranial tissues
电场强度在白质和灰质部位为0 V/m(蓝色)~1.8 V/m(红色)。电极片之下区域的电场强度高于0.7 V/m 的有效刺激阈值,表示tDCS能够在这些区域有效调控神经,达到物理治疗的作用。可选择数值-颜色对照的范围,如果最大值选0.7 V/m,就能清楚看到白质和灰质中电场强度高于0.7 V/m 的区域范围(红色),见图8。

图8 颅内灰质和白质高于0.7 V/m的电场分布Figure 8 Electric field distribution of intracranial gray matter and white matter above 0.7 V/m
图9是电场分布横截面图解。图中颅骨和其它脑组织分界面的颜色分界对比清晰,说明颅骨中电场大小明显不同其它脑组织中电场大小,表现为电场在跨颅骨进入到CSF、灰质和白质,经历了快速减弱的过程,最大从18 V/m降为1.2 V/m。

图9 颅内电场在头颅横截面的分布(多层片电场分布,V/m)Figure 9 Distribution of the intracranial electric field at the cross-section of the skull (electric field distribution of the multilayer sheet,V/m)
临床治疗中电极位置偏移导致个体治疗响应存在差异。笔者以tDCS 治疗抑郁症状为例,讨论电极位置偏移对治疗量化剂量的影响。假定治疗的电极放置在F3 和F4,即左背外侧前额叶皮层(DLPFC)和右DLPFC 的正上方。笔者将无偏差的F3 电极位置称之为正位。以正位为中心,假设电极向8个方向偏移:东、西、南、北,以及东南、西南、西北、东北,每次移动为1/4 电极大小(圆盘直径),最大移动一个直径大小(4/4),共32种中央位置偏移方案。完成32个偏移电极放置场景的颅内电场计算,读取每次计算结果中的P 点和Q 点电场数值。结果如图10所示。图10显示在2 mA 激励下,皮质中P 和Q 点电场范围为0.29~0.65 V/m。图11显示此时各位置误差所产生的电场剂量偏差为14.55%~53.85%。

图10 不同电极偏移位置下P点和Q点的电场强度Figure 10 Electric field intensity values at points P and Q with different offsets of the electrode positions
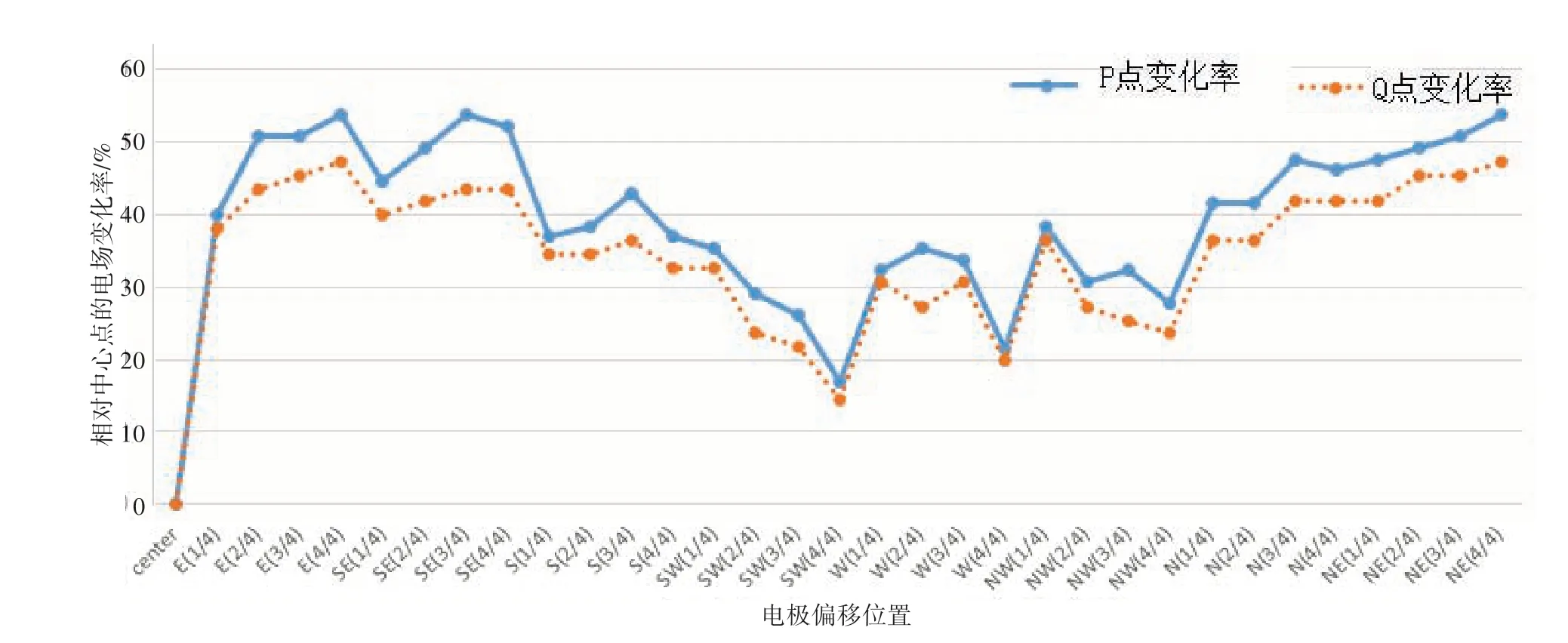
图11 不同电极偏移位置下P点和Q点的电场强度变化率Figure 11 Electric field intensity change rates at points P and Q with different offsets of the electrode positions
针对模型所得数值解的可靠性,即模型计算结果与直接人类颅内测量对照,本文预期有14%的误差。Huang等报道[18]和本文介绍的方法是一致的,他通过10 名癫痫患者头建模计算,对比电场计算数值与测量数值,在头皮位置电场强度相关为r=0.86。
4 结论
颅内电场数值仿真计算可以让我们在从事tDCS治疗时,以及在从事相关仪器研制工作中受益。tDCS优化治疗,即是希望电场高于0.7 V/m 的区域范围和希望调控的区域重合,而在调控外的区域低于0.7 V/m。个体治疗响应会存在差异,临床治疗当中对个体剂量进行优化自然会有帮助。人工经验化的优化思路成本高且盲目。而以头部数字电磁场模型建模,通过精确了解大脑中电流分布,预测了整个组织上产生的电流空间分布是否适合,可以找到tDCS治疗合理优化处方,克服人工优化的缺点。
其次,电极位置误差会成为颅内电场剂量差异的主要来源之一。仿真计算可为tDCS治疗操作选择正确电极位置提供指导。
最后,tDCS 计算模型中显示电场在跨颅骨时经历快速减弱。启示在新的神经调控设备研制,如果tDCS 治疗的电极置于颅骨下,一方面可使电极激励方案具备替代DBS 潜力,另一方面会比目前的tDCS更有效实现目标区域神经调控。有关这两方面的研究,将在后继工作中展开。
致谢:Marom Bikson 教授提供作者使用其脑组织分割完成后模型,特此向Bikson 教授表示感谢。Huang Yu 博士提供了非常重要的意见,使本文得到完善,亦特此表示感谢。
