四君子汤治疗胃黏膜损伤的机制探究
2022-01-24孙玉婷刘明晖王长宏
孙玉婷,刘明晖,方 爽,王长宏*
(1.吉林大学中日联谊医院,长春 130033;2.中国人民解放军联勤保障部队第九六五医院,吉林 吉林 132011)
胃溃疡(gastric ulcer, GU)是消化系统常见疾病,其发病与病原体感染、非甾体类药物和心理因素等相关[1-2]。近来研究发现氧化应激参与了GU的形成,GU发生的高危因素中,如HP感染[3]、NSAIDs损伤[4]、乙醇破坏[5],有ROS的产生参与。当体内的活性氧簇(ROS)的过度产生破坏细胞内源性氧化平衡后,就会发生氧化应激应答[6-7]。Keap1/Nrf2/ARE 是目前研究较热门的抗氧化信号通路之一,Nrf2是维持细胞内氧化平衡的重要转录因子,当机体受到大量ROS刺激时,Nrf2会与Keap1分离,游离状态下的Nrf2会进入到细胞核内,与抗氧化元件ARE结合,启动很多下游的抗氧化基因和解毒基因的激活转录,如血红素氧合酶-1(HO-1)、醌氧化还原酶-1(NQO1)等,从而发挥清除氧自由基、抑制细胞凋亡等作用,避免机体免到受氧化损伤[8-9]。因此我们可以通过调节氧化机制来改善治疗GU。
四君子汤出自宋代《太平惠民和剂局方》,由人参、茯苓、白术、炙甘草组成。在临床上治疗消化道溃疡(PU)、慢性胃炎、消化不良等疾病,在治疗安全性、降低西药副作用以及减少复发率方面[10-11],都被证实有良好的效果。但四君子汤治疗GU是否可以通过激活Nrf2信号通路,调节氧化应激来达到治疗GU的效果尚不明确。本研究主要通过体外实验,利用乙醇诱导胃黏膜上皮细胞GES-1细胞氧化损伤,检测氧化调节因子Nrf2及其下游调控的HO1、NQO1的表达量,从而来探究SJZD保护胃黏膜的抗氧化作用机制。
1 材料与方法
1.1 试剂和材料
1)四君子汤:药物均经专家鉴定符合药典要求,按照人参12 g,茯苓12 g,白术12 g,炙甘草8 g,药物来源及药液制作方法参考如下[12],制备母液浓度为1 g·mL-1,浓缩后配制含生药2 000 mg·mL-1、1 000 mg·mL-1、500 mg·mL-1、100 mg·mL-1、50 mg·mL-1药液备用。2)试剂:RPMI-1640培养基、胎牛血清购自赛默飞世尔科技有限公司;青霉素链霉素双抗、显影液、0.22 μm PVDF膜、RIPA细胞裂解液、蛋白酶抑制剂购自碧云天生物技术有限公司;SYBR®Premix Ex Taq™ II购自宝日医生物技术有限公司。3)试剂盒:CCK-8细胞活力检测试剂盒、活性氧检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、RNA抽提试剂盒(柱式)、cDNA合成试剂盒、BCA蛋白浓度试剂盒购自碧云天生物技术有限公司。4)细胞系:人胃黏膜上皮细胞系GES-1购自武汉普诺赛生命科技有限公司。
1.2 细胞培养
GES-1细胞用RPMI-1640培养基(含10%血清和1%双抗),培养在37 ℃,5%二氧化碳 的细胞培养箱中,定期用支原体检测试剂盒检测,确保无污染。
1.3 细胞活力检测
将GES-1细胞接种到96孔板(4×104/孔),分6个浓度梯度组及1个空白对照组,每组6个复孔。待细胞贴壁后,更换为100 μL浓度分别为2 000 mg·mL-1、1 000 mg·mL-1、500 mg·mL-1、100 mg·mL-1、50 mg·mL-1、0 mg·mL-1的 SJZD药物培养24 h,弃药物培养液,加入完全培养基100 μL,4 h后,每孔加入10 μL CCK工作液,再培养2 h后,检测各孔OD值,选择后续实验最适SJZD浓度。
细胞接种及分组同上,分别在0 mg·mL-1、500 mg·mL-1的 含SJZD药物培养基中24 h,加入100 μL 含 0%、1.0%、2.5%、5.0%、7.5%、10.0%无水乙醇的培养基继续培养4 h。按照上述CCK-8试剂步骤检测,选择最佳无水乙醇浓度。
细胞生长抑制率:生长抑制率(%) = (对照组OD值-实验组OD值)÷(对照组OD值-空白孔OD值)×100%。
1.4 凋亡检测
将GES-1细胞接种到6孔板(1×105/孔),贴壁后,更换为含药物的培养基,24 min后,加入2 mL含0%或5%无水乙醇的培养基继续培养,继续培养4 h,收集细胞(含上清),按细胞凋亡检测试剂盒说明书进行凋亡染色并送流式分析。凋亡细胞定义为Annexin V阳性的细胞。
1.5 ROS流式检测
将1×105个GES-1细胞接种到6孔板,贴壁后,换含药物或PBS的培养基,24 h后,实验组加入含5%无水乙醇的培养基,继续培养4 h,收集细胞试剂盒按说明书进行ROS染色并送流式分析。
1.6 实时荧光定量PCR
细胞用药物处理24 h,用5%无水乙醇的培养基处理细胞,4 h后,按实际说明书操作,用RNA提取试剂盒提取RNA,并进行cDNA合成,随后将cDNA产物与指定引物和SYBR®Premix Ex Taq™ II进行实时荧光定量PCR反应。利用ΔCT值相对定量法分析实时荧光定量PCR结果。公式为:ΔCT对照=CT对照目标基因-CT对照内参基因;ΔCT样本= CT样本目标基因-CT样本内参基因;ΔΔCT=ΔCT样本-ΔCT对照;基因相对表达量= 2^-ΔΔCT。
1.7 Western Blot
细胞用药物处理24 h,用5%无水乙醇的培养基处理细胞,4 h后,收集细胞,加入5倍体积的RIPA细胞裂解液(含蛋白酶抑制剂),在冰上裂解30 min。用BCA蛋白浓度试剂盒测定蛋白浓度后,用SDS上样缓冲液与样本混合并在100℃加热10 min,随后进行SDS凝胶电泳,将蛋白转移至PVDF膜后进行封闭、一抗和二抗孵育后,用ECL显影液在显影仪下显影并拍照记录。
1.8 统计学方法
采用 SPSS 19.0 统计软件进行结果分析,计量数据以均数±标准差(±s)表示,并用t检验分析组间差异;计数数据以百分比(%)表示,并用χ2检验分析组间差异。以P<0.05 为差异有统计学意义。
2 结果
2.1 SJZD降低乙醇诱导GES-1细胞的凋亡和ROS含量
为进一步研究四君子汤保护急性胃黏膜损伤的机制,首先研究了不同浓度四君子汤和不同浓度的无水乙醇对GES-1细胞生长活力的影响(见表1、表2)。根据细胞的生长抑制情况,后续实验选择了最适浓度500 mg·L-1SJZD以及5%的无水乙醇。图1可以看出SJZD治疗组的凋亡水平明显低于模型组,但并达到至正常组水平。表3、表4可以看出,SJZD治疗组对比模型组显著降低了GES-1细胞的凋亡率(P<0.05)以及细胞内ROS含量(P<0.05),SJZD可抑制乙醇诱导下产生的GES-1细胞的凋亡水平和ROS强度。

表1 不同浓度SJZD对GES-1细胞活力的影响(n= 6)

表2 不同浓度无水乙醇下SJZD对GES-1细胞活力的影响(n= 6)
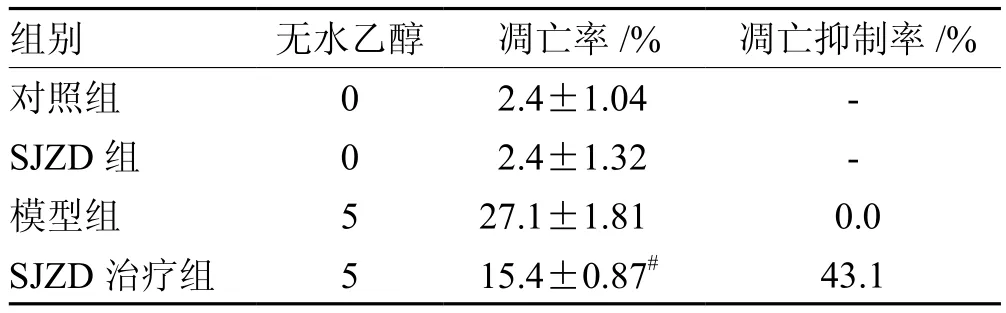
表3 SJZD对5%乙醇诱导GES-1细胞的细胞凋亡率的影响(n= 6)

表4 SJZD对5%乙醇诱导GES-1细胞的ROS的影响(n= 6)
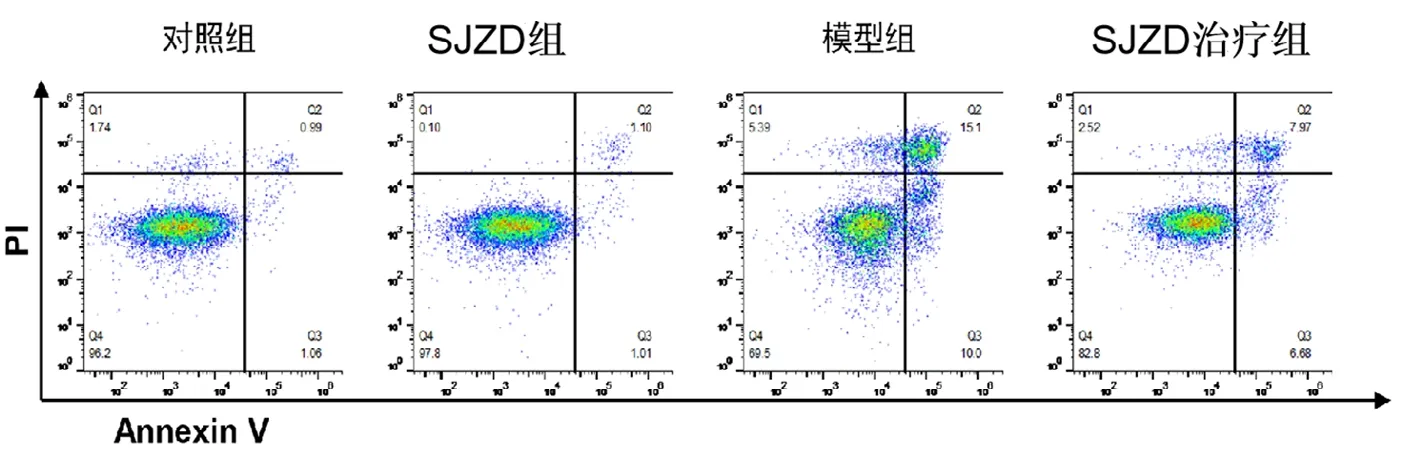
图1 SJZD对5%乙醇诱导GES-1细胞的细胞凋亡率的影响
2.2 SJZD对GES-1细胞中Nrf2、HO-1、NQO1表达量的影响
Nrf2是重要的细胞应激反应基因,是目前已知的抗氧化系统中最重要的基因,其激活可提高细胞抵抗氧化损伤的能力[13]。图2所示,SJZD治疗组的Nrf2、HO-1、NQO1的蛋白表达量对比模型组显著上升(P<0.05),提示四君子汤可激活Nrf2信号通路。如表5所示,SJZD 治疗组细胞中Nrf2及其下游基因HO-1和NQO1的mRNA表达量均较模型组有显著上调(P<0.05),有趣的是我们发现SJZD组中的3组基因的表达亦有所上调。Western Blot与RT-qPCR的结果一致,都表明在SJZD治疗组(5%无水乙醇与500 mg·L-1SZJD的药物培养),激活了Nrf2信号通路,增强了GES-1细胞的抗氧化反应能力,改善了细胞内的抗氧化环境,促进GES-1细胞生存。

表5 SJZD对Nrf2信号通路相关基因mRNA影响(n= 6)
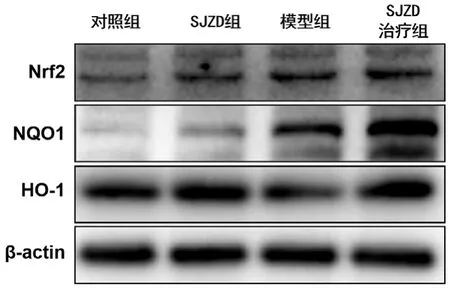
图2 SJZD对Nrf2信号通路相关蛋白影响
2.3 ML385联合实验抑制了SJZD的保护作用
为了验证SJZD对GES-1细胞的保护作用是否依赖于Nrf2,我们用Nrf2选择性抑制剂ML385[14]与SJZD联合处理。结果如下:在5%的无水乙醇作用下,对比SJZD组,SJZD+ML385组的细胞生长活力(表6)明显受到了抑制(P<0.05),细胞凋亡水平(表7、图3)明显上升(P<0.05)和ROS水平(表8)显著增强(P<0.05)。ML385可能通过抑制细胞内氧化应激通路Nrf2及其下游基因表达,从而消除了SJZD对GES-1细胞的保护作用。

图3 ML385抑制SJZD的抗凋亡作用

表6 ML385影响SJZD对无水乙醇损伤GES-1细胞活力的保护作用(n= 6)

表7 ML385抑制SJZD的抗凋亡作用(n= 6)

表8 ML385抑制SJZD的抗ROS作用(n= 6)
3 讨论
GU属于中医“痞满、胃脘痛”范畴,2017年中医消化道溃疡指南专家共识中指出[15],根据其胃黏膜病理特点增加了“胃疡”一名。中医认为GU的发病与饮食、情志、久病、体虚等相关,致使脾胃运化失司,脾胃乃后天之本,脾胃虚弱会影响营养物质吸收,削弱其保护防御作用。SJZD作为补脾胃的第一方,现代研究证实可以发挥促进黏膜恢复[16]、抗炎[17]、抗氧化应激[18]等作用。有研究报道,SJZD可以改变胃黏膜黏蛋白含量、胃黏膜免疫细胞亚群等,从而恢复黏膜屏障功能[19]。王东旭等也报道SJZD可以通过影响多胺防治胃黏膜损伤[20]。
乙醇是诱发GU中较为常见的因素。通过乙醇诱发的溃疡与人胃黏膜损伤非常相似且重复性好[21],已成为研究GU广泛使用的经典模型[22]。其机制是主要通过减弱胃黏膜上皮细胞氧化应激,增加ROS产生,破坏细胞内氧化平衡,诱导细胞凋亡[23],而细胞的持续凋亡也会破坏胃黏膜的完整性,导致其功能的障碍。本研究结果显示,SJZD可以抑制乙醇诱导的GES-1细胞的凋亡和ROS产生,提高了抗氧化标记物Nrf2、HO-1、NQO1的表达,对GES-1细胞起到了保护作用。
在GU的发生研究中,胃黏膜上皮细胞的凋亡对胃溃疡发生和愈合具有重要作用[24-25]。本研究首次报道SJZD可以有效减少乙醇对GES-1细胞的生长抑制,降低乙醇诱导的GES-1细胞内的ROS水平和细胞凋亡率。Nrf2是细胞内主要的应激应答基因,其激活可以促进抗氧化相关基因的转录,增强细胞抗氧化反应能力,从而保护细胞免受损伤。本研究结果显示,乙醇处理后,细胞内Nrf2及其下游靶基因HO-1和NQO1均有较低程度的激活,这可能是细胞对乙醇损伤的适应性反应。SJZD可以在mRNA水平和蛋白水平有效激活Nrf2及其下游靶基因HO-1和NQO1表达,这可能是SJZD保护GES-1细胞免受乙醇损伤的机制。因此,我们又用Nrf2的选择性抑制剂ML385进行研究,结果显示ML385消除了SJZD汤对GES-1细胞的保护效应,表明SJZD对胃黏膜上皮细胞的保护作用依赖于Nrf2的激活。我们的研究结果也支持了之前的假设。
本研究通过四君子汤在动物和细胞实验体外效应机制研究,验证了四君子汤通过激活Nrf2相关的抗氧化通路应答,减轻乙醇诱导的小鼠胃黏膜损伤。
