类风湿关节炎患者血清14-3-3η蛋白水平及临床检测价值的初步研究
2022-01-22王伟远刘丹丹张蓓蔡悦薄娜娜雷洁李会强
王伟远,刘丹丹,张蓓,蔡悦,薄娜娜,雷洁,李会强
(1.天津医科大学医学检验学院,天津 300203;2.天津中医药大学第一附属医院检验科,天津 300193;3.天津中医药大学第一附属医院风湿免疫科,天津 300193)
类风湿关节炎(R A)是临床上常见的自身免疫性疾病,以双侧小关节慢性关节炎为特征,严重滑膜炎可损害关节功能及致残[1]。类风湿因子(RF)和抗环瓜氨酸肽抗体(anti-CCP)是RA诊断和分型的传统血清标志物,风湿科医生根据这些生物标志物,结合关节症状和放射学证据,可以诊断RA并评估疾病的发展进程。然而RA临床表现多样,部分早期症状不典型的患者和(或)血清学阴性的患者常被误诊、漏诊[2-3]。因此,临床迫切需要发现更有价值的生物学标志物,以提高目前RA的诊断和疾病监测水平。有研究发现,14-3-3蛋白是一组高度保守的蛋白家族,由7种亚型(β、γ、ε、η、σ、θ和ζ)组成。Kilani等[4]发现,炎性关节疾病患者的关节液和血清中14-3-3蛋白的η和γ2个亚型显著增高,进一步研究发现,血清14-3-3-η是一种新的特异性较高的RA生物标志物,其参与了RA相关炎症介质表达的上调和关节损伤机制[5]。本研究通过测定血清14-3-3η、RF、D-二聚体(D-Dimer)、红细胞沉降率(ESR)、anti-CCP、CRP水平,分析评估血清14-3-3η水平对RA患者的诊断价值,并探讨该生物标志物与其他实验室指标以及临床指标的关系。
1 对象与方法
1.1 研究对象研究对象均为2020年5月—12月天津中医药大学第一附属医院门诊及住院患者或健康体检者。RA组136例,其中男28例,女108例,诊断符合1987年美国风湿病学会(ACR)及2010年欧洲抗风湿联盟(EULAR)制定的RA分类标准,患者在确诊前均未进行相关对症药物治疗。疾病对照组65例,为非R A关节病变患者(系统性红斑狼疮18例,结缔组织病17例,骨关节病22例,银屑性关节炎4例,强直性脊柱炎4例),其中男12例,女53例。健康对照组36名,为体检健康者,其中男22名,女14名。所有患者均符合相关指南诊断标准[2,6-7],并经风湿免疫科医生确认。所有标本均在患者知情同意条件下获得,并获得伦理委员会批准许可,审批号为TMUHMEC2017008。
1.2 相关实验室指标检测受试者于清晨采集空腹静脉血分别置于真空采血管中,分离胶促凝血于3 500 r/min离心8 min,分离血清,离心半径19 cm,用于14-3-3η、anti-CCP、CRP、RF的检测。枸橼酸钠抗凝血于3 000 r/min离心15 min,离心半径19 cm,分离血浆,用于检测D-Dimer。枸橼酸钠抗凝全血用于ESR检测。RF、CRP检测所用仪器为西门子BNII蛋白分析仪及其配套试剂。采用光激化学发光法检测14-3-3η蛋白,检测仪器为LICA HT光激化学发光分析仪(试剂为国产光激化学发光试剂),采用酶联免疫吸附测定(ELISA)法检测anti-CCP,检测仪器为RAYTO RT-6100酶标分析仪(试剂为深圳亚辉龙试剂盒),根据试剂说明书,14-3-3η蛋白≥0.2 ng/mL为阳性,采用散射免疫比浊法检测RF、CRP,检测仪器为西门子BNII蛋白分析仪及其配套试剂。采用免疫比浊法检测D-Dimer,检测仪器为希森美康CX-5100凝血分析仪及其配套试剂,采用魏氏法(Westergren)检测ESR,检测仪器为亚辉龙VISON-C分析仪。
1.3 统计学处理采用统计学软件SPSS 25.0和GraphPad Prism 8.0对数据进行统计学分析,定量变量用±s或中位数(P25,P75)表示,分类变量用频数和百分比表示。两组间比较采用t检验、Mann-Whitney U检验。分析定量结果指标的相关性采用Spearman秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象临床资料RA组平均年龄(56.2±12.7)岁。疾病对照组平均年龄(61.9±10.5)岁。健康对照组平均年龄(32.4±6.9)岁。各组间年龄、性别差异均无统计学意义(均P>0.05),具有良好的可比性。
2.2 血清14-3-3η蛋白水平RA组血清14-3-3η蛋白水平为0.18(0.07,0.843)ng/mL,以cutoff≥0.2 ng/mL作为阳性区分标准,将RA组分为14-3-3η阴性组和14-3-3η阳性组,14-3-3η阳性组14-3-3η水平为0.86(0.45,2.31)ng/mL,14-3-3η阴性组为0.08(0.04,0.11)ng/mL(U=0.0,P<0.000 1)。在疾病对照组中14-3-3η水平为0.07(0.05,0.09)ng/mL,在健康对照组中为0.02(0.02,0.03)ng/mL。RA组14-3-3η水平显著高于疾病对照组和健康对照组(U=2 272.5、441.5,均P<0.000 1);同时在疾病对照组血清14-3-3η蛋白浓度也显著高于健康对照组(U=237,P<0.000 1),见图1、2。
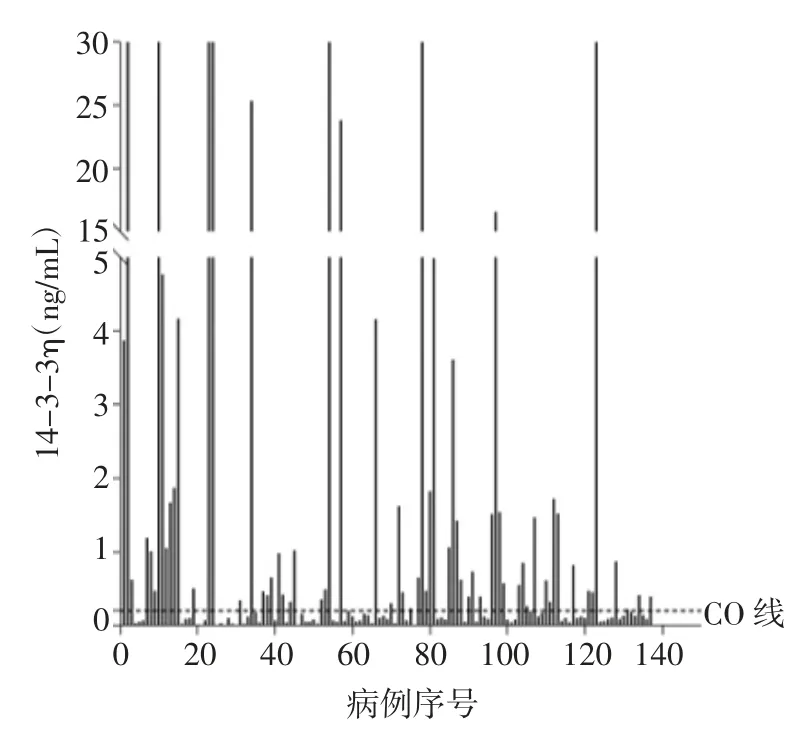
图1 RA患者14-3-3η蛋白表达水平Fig 1 The expression of 14-3-3ηprotein in patients with RA
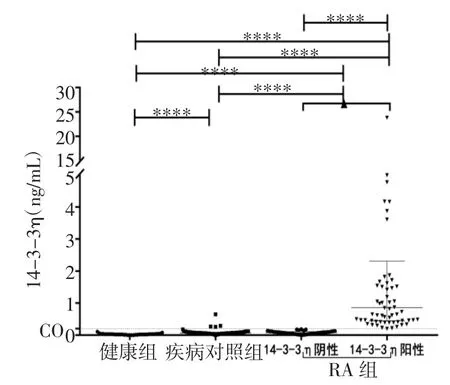
图2 血清14-3-3η蛋白表达水平Fig 2 Expression of serum 14-3-3ηprotein
2.3 RA组14-3-3η水平与临床指标相关性分析Spearman相关分析显示,RA患者14-3-3η阳性组血清14-3-3η水平与RF、DAS28-CRP均呈正相关(均P<0.05),与ESR、D-Dimer均呈负相关(均P<0.05),与其他指标不相关,见表1。

表1 血清14-3-3η蛋白与各项临床指标相关性分析Tab 1 Correlation between serum 14-3-3ηprotein and various clinical indicators
2.4 RA患者14-3-3η阳性组与阴性组相关指标表达差异分析RA患者14-3-3η阳性组RF与anti-CCP的表达均显著高于14-3-3η阴性组(P=0.000、0.006),而其他指标没有差异,见表2。
表2 14-3-3η阳性组与阴性组间各项临床指标比较[±s,M(Q1,Q3)]Tab 2 Comparison of various clinical indicators between 14-3-3ηpositive group and negative group[±s,M(Q1,Q3)]

表2 14-3-3η阳性组与阴性组间各项临床指标比较[±s,M(Q1,Q3)]Tab 2 Comparison of various clinical indicators between 14-3-3ηpositive group and negative group[±s,M(Q1,Q3)]
注:DAS28:28个关节疾病活动评分;TJC:压痛关节数;SJC:肿胀关节数;CRP:C反应蛋白;RF:类风湿因子;ESR:红细胞沉降率;anti-CCP:抗CCP抗体;D-Dimer:D二聚体
指标 14-3-3η阳性组(n=66) 14-3-3η阴性组(n=70) U P DAS28 6.06±1.18 5.82±1.17 1 957.5 0.205 DAS28-CRP 6.13(3.90,5.83) 5.17(4.34,5.84) 1 044.0 0.532病程(月) 96(57,147) 72(8,168) 1 973.5 0.180 Age(岁) 62.45±10.04 61.76±10.88 2 225.5 0.713 TJC(关节数) 13(5,18) 14(4,18) 2 194.5 0.614 SJC(关节数) 12(4,16) 12(3,16.5) 2 293.5 0.943 CRP(mg/L) 13.4(0.0,35.5) 8.1(0.01,41.8) 2 099.0 0.517 RF(IU/mL) 155.0(79.3,394.5) 12.9(0.0.82.7) 758.0 0.000 ESR(mm/h) 56.0(31.0,83.5) 43.0(21.5,77.5) 1 806.5 0.052 anti-CCP(U/mL) 149(55,429) 44(8,195) 528.0 0.006 D-Dimer(mg/L) 1.43(0.62,3.03) 0.88(0.46,1.93) 1 723.0 0.053
3 讨论
研究发现RA患者的血清中存在多种自身抗体[8-9]。虽然anti-CCP和RF已被广泛用于RA的诊断,但已证实RF和anti-CCP阴性的RA患者约占RA患者总数的15%~25%[2,10]。且其在很多其他疾病,如系统性红斑狼疮、干燥综合征、脊柱关节病中也会出现,甚至在老年人中也有一定程度的升高,因此仍有部分患者诊断困难。基于此种现状寻找RA相关指标,提高RA诊断的敏感性、特异性,实现早期诊断、早期治疗成为临床中亟待解决的问题,也是阻止RA病情发展和降低致残率的关键。为此,笔者进一步探讨了血清14-3-3η蛋白与其他生物指标对RA的临床检测价值。
14-3-3蛋白是一组高度保守的蛋白家族,由7种亚型(β、γ、ε、η、σ、θ和ζ)组成,在炎性关节疾病患者的关节液和血清中14-3-3蛋白的η和γ2个亚型增高显著,以η亚型为主,且14-3-3η蛋白水平与基质金属蛋白酶(MMP)-1和MMP-3显著相关,说明14-3-3η很可能参与关节损伤机制[4]。Maksymowych等[5]使用与RA患者血清水平相当浓度的14-3-3η蛋白,发现其可激活关键细胞信号级联反应,促进促炎细胞因子和关节损伤因子的转录。Carrier等[11]报道尽管在基线水平接受了治疗,14-3-3η蛋白水平升高的患者在未来5年内仍然发展出严重的关节损伤,尤其是在老年患者中,提示14-3-3η水平升高为不良的预后标志。在接受重组人白细胞介素(IL)-6受体单克隆抗体(单抗)——托株单抗治疗的RA患者中,14-3-3η的降低与疾病进展的缓解有关,因此可以作为监测托株单抗疗效的生物标志物[12]。此外,14-3-3-η还与RA患者骨质疏松的发生有关,可能是早期RA患者骨质疏松的预测因子[13]。血清和关节滑液中14-3-3η蛋白与已确诊类风湿性关节炎患者的放射学损伤和疾病进展密切相关[14]。Tu等[15]报道血清14-3-3-η水平与中国RA患者疾病风险、活动度和病程增加相关。检测血清14-3-3η水平有助于多发性关节炎患者的早期诊断[11,16]。
本研究中,14-3-3η蛋白的临界值采用试剂说明书参考为0.2 ng/mL。血清14-3-3η蛋白水平在部分RA患者中升高,在RA组与疾病对照组、RA组与健康对照组之间比较发现,14-3-3η蛋白在RA组中表达明显高于健康对照组和疾病对照组,提示血清14-3-3η水平可能是预测RA风险的良好指标,这与之前的文献研究一致[4-5,17],这可能与14-3-3η参与上调与RA炎症进展密切相关的促炎细胞因子水平有关。而且Spearman相关性分析发现,RA患者14-3-3η阳性组14-3-3η的表达水平与RF、DAS28-CRP呈正相关,提示14-3-3η可作为监测RA患者病情活动性的一种新的生物标志物。血清14-3-3η蛋白与ESR、D-Dimer呈负相关,与CRP不相关,这与Tu等[15]研究不一致,可能的原因是RA患者14-3-3η表达水平与疾病活动性的相关性是可变的,如果存在关节病变相关组织损伤,14-3-3-η可能独立于这些指标发挥作用。关节腔内D-Dimer可促进单核细胞IL-1β、IL-6等炎症因子的表达,与关节炎症程度密切相关,早期检测RA患者D-Dimer水平有利于预防高凝状态。血清14-3-3η蛋白与D-Dimer呈负相关,考虑与患者入院前是否接受药物治疗有关,另外考虑住院患者一般病情较重,同时统计的样本量不足也有可能造成一定的影响。本研究中,在RA患者14-3-3η阳性组中,RF与anti-CCP的表达水平也明显高于阴性组,这种一致性可能是由于14-3-3η、RF和anti-CCP都参与了RA炎症相关的IL-1β和IL-6的释放过程[5]。如上所述,14-3-3η能够诱导促炎性细胞因子的释放,引起关节损伤,有可能增加RF的表达,从而增加RA的发病风险。
综上,本研究认为血清14-3-3η蛋白在部分RA患者中高检测水平,与RA中RF、DAS28-CRP等多个实验室指标密切相关,有希望成为预测RA风险以及监测RA进展的良好指标。本研究的不足之处在于样本量较小,后续的研究还需要进一步扩大样本量来评估14-3-3η蛋白对RA的风险预测和诊断能力,以及它们与疾病进展和治疗反应的相关性。同时关于14-3-3η在RA中的具体作用机制也有待深入研究。此外,14-3-3η蛋白与多项指标(包括RF和anti-CCP)的联合检测将可能有助于早期发现RA。
