盐酸右美托咪定对脓毒症急性肺损伤小鼠基质金属蛋白酶7抑制作用研究
2022-01-22齐颖陈兵
齐颖,陈兵
(天津医科大学第二医院ICU,天津 300211)
脓毒症是重症医学科常见病,病死率较高且预后差,临床常见的感染源是肺部感染,此外有腹腔感染及泌尿系统等感染。脓毒症常累及呼吸系统,在机械通气患者中治疗效果欠佳,存在院内感染的高风险,适度的镇静、镇痛可有效缓解患者痛苦及焦虑,该类患者病情进展迅速常合并急性肺损伤(acute lung injury,ALI)甚至急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),即使康复后部分患者也可能出现肺组织纤维化,严重影响生活质量。基质金属蛋白酶(MMP)7是Wnt/β连环蛋白的靶基因产物,在脓毒症致ALI/ARDS的早期激活,它可破坏肺组织的正常结构,在部分病例中引起肺纤维化[1]。右美托咪定是ICU常用的镇静药物,该药对患者呼吸抑制作用弱、无苏醒延迟,恰当应用该药物能减少患者机械通气时间及呼吸机相关性肺炎发生率,该药产生的镇静、镇痛及抗炎作用能减轻肺水肿程度[2]。其治疗机制可能是通过抗氧化应激、改善巨噬细胞聚集从而抑制炎症因子的释放,起到脏器保护的作用。MMP7在肺损伤早期升高,具有一定程度致纤维化的作用,通过研究该酶在急性肺损伤小鼠的表达水平来进行早期肺损伤的诊断[3]。本研究建立脓毒症致小鼠ALI模型,通过光镜和电镜下观察肺组织病理改变及检测不同时间点血清MMP7浓度变化,研究右美托咪定对急性肺损伤小鼠的肺保护作用。
1 材料及方法
1.1 材料实验动物为雄性昆明小鼠,体重20~25g。大肠杆菌脂多糖购自Sigma(血清型055:B5),盐酸右美托咪定注射液(2 ml:0.2 mg)购自扬子江药业集团有限公司,部分试剂由天津医科大学第二医院心脏研究所提供。
1.2 方法
1.2.1 动物分组及模型制备 将96只小鼠随机分为3组,分别为对照组、ALI组、治疗组,每组32只;每组各分为1、3、5、8 h 4个不同的损伤时间点。ALI组及治疗组腹腔注射脂多糖10 mg/kg。对照组注射等剂量生理盐水,治疗组在脂多糖注射结束后半小时经腹腔注射右美托咪定25μg/kg。小鼠在注射脂多糖40 min左右出现嗜睡、寒战、呼吸频率增快、进食及饮水减少,部分小鼠并出现腹泻等表现。光镜下观察病理改变,ALI组肺组织肺泡间隔增厚,血细胞及炎性细胞渗出到肺泡腔内,表示造模成功。
1.2.2 标本收集及处理 到达相应的处理时间点,将小鼠麻醉完全后从内眦取血低温3 000 r/min离心15 min保留上清至-20℃冰箱备用。右肺下叶组织浸泡在10%福尔马林,保存至4℃冰箱,光镜下观察组织病理改变。右肺中上叶进行肺组织匀浆提取蛋白质。左肺组织保存在2.5%戊二醛进行电子染色,在透射电镜下观察肺血管内皮的变化。
1.2.3 Western印迹检测 小鼠肺组织匀浆提取蛋白样本保存于-80℃。提取的蛋白质按照试剂盒进行操作:(1)取20μg/孔蛋白质进行10%SDS-PAGE。(2)配胶上样(上层胶5%,下层胶10%)。电泳(上层胶60 V,下层胶120 V)。(3)切所需部分放入1×转膜缓冲液。将PVDF膜也放入转膜缓冲液。(4)取出PVDF膜做标记后,用5%脱脂牛奶室温封闭2 h。(5)一抗(MMP-7 1:1 000优宁维,β-actin 1:10 000)4℃孵育过夜。(6)1×TBST洗15 min,重复3次。(7)二抗(1:4 000联科)室温孵育2 h。(8)1×TBST洗15 min×3次。(9)暗室显影:压片、曝光、显影、定影。(10)分析结果。
1.2.4 血清MMP-7浓度的测定 采用双抗体一步夹心法酶联免疫吸附试验(ELISA)分别测定损伤1、3、5、8 h血清MMP-7浓度,严格参照试剂盒说明书进行操作。
1.3 统计学处理数据由SPSS21.0及Graphpad prism7、ImageJ软件进行分析及作图。正态分布计量资料以±s表示。组间数据比较采用单因素方差分析,P<0.01为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理改变对照组肺组织结构清晰,肺泡壁无增厚,肺泡腔无液体及血细胞渗出,随着损伤时间的延长,损伤组肺组织的结构逐渐破坏加重,肺泡壁增厚明显,肺泡皱缩,肺泡腔内血细胞渗出,炎性细胞渗出,到损伤5 h时,肺泡的结构几乎塌陷,炎性细胞浸润,甚至形成透明膜。与同时间点损伤组相比较,治疗组肺组织炎症缓解,炎性细胞渗出减少,肺组织病变程度减轻(图1)。
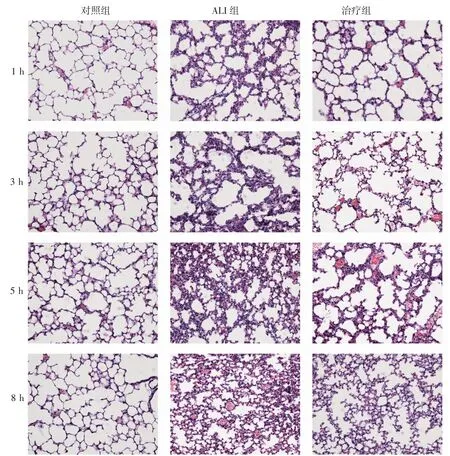
图1 3组小鼠在不同时间点肺组织病理结构的改变Fig 1 Changes of pathological structure of lung tissue in three groups of mice at different time
2.2 不同时间点测定小鼠血清MMP7浓度治疗组血清MMP-7浓度较同时间点ALI组降低(P<0.01)(表1)。

表1 各组不同时间点血清MMP7浓度(pg/mL)Tab 1 Serum MMP7 concentration at different time in each group(pg/mL)
2.3 电镜下观察肺血管内皮细胞的改变电镜下肺损伤3 h时血管内皮损伤的变化,对照组肺组织血管内皮细胞基质内空泡较少,无细胞的肿胀,基膜相对完整(图2A)。ALI组细胞基质内出现空泡,基膜完整性被破坏(图2B)。治疗组内皮基膜的病变程度较损伤组有所减轻(图2C)。
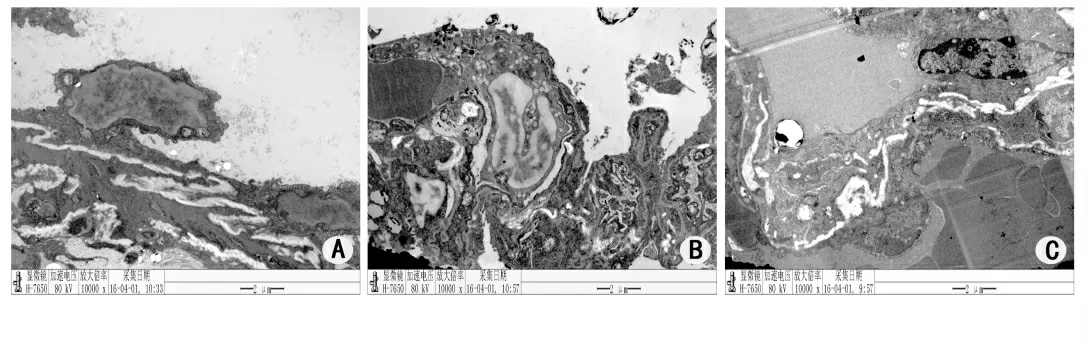
图2 电镜下肺血管内皮细胞的改变(放大倍数10 000×)Fig 2 Changes of pulmonary vascular endothelial cells under electron microscope(magnification power 10 000×)
2.4 Western印迹检测在损伤3 h时,与对照组相比,ALI组MMP-7的表达水平较高,治疗组MMP-7表达下降(P<0.01)(图3)。

图3 Western印迹检测3组MMP-7蛋白的表达Fig 3 The expression of MMP-7 protein in three groups by Western blotting
3 讨论
脓毒症急性肺损伤(ALI/ARDS)是ICU的常见危重病,感染、创伤、缺血再灌注、胃内容物吸入呼吸道均可引起肺损伤的发生,引起脓毒症的感染源具有多样性,临床以肺部感染为主,其次为腹腔感染及泌尿系感染等。出现ARDS时预后极差,并且给患者带来较高的治疗费用[4]。
脓毒症肺损伤发病机制较复杂,通过制备动物模型可再现损伤过程的病理机制,微血管内皮结构及功能的变化在急性肺损伤早期起核心作用,免疫系统会释放大量促炎和抗炎细胞因子,如IL-6、IL-8、IL-1β及TNF-α等因子,循环中高水平的细胞因子可增强对组织器官的损害,内皮屏障破坏后富含蛋白质的液体渗出增加,部分大分子物质也会进入组织间隙和肺泡间隙从而引起肺水肿,有研究表明内皮损伤与中性粒细胞活化有关[5];此外,内皮细胞能产生内皮素-1、血管紧张素-2及前列环素,它们可调节血管舒张及收缩功能,在肺损伤过程中起到重要作用。通过抑制炎症因子释放、免疫调节治疗可产生脏器保护作用[6]。
右美托咪定是ICU常用的镇静剂,临床应用中对患者的呼吸抑制作用较少,因此也常应用于围术期镇静,适当的镇静、镇痛不仅能使患者克服恐惧心理,还能减少呼吸机的使用时间,改善患者预后[7]。右美托咪定作用于蓝斑核,有较高的蛋白结合率,容易穿过血-脑屏障,通过激活中枢神经系统和外周脊髓的α2肾上腺素能受体而产生镇静和镇痛及抗交感作用,可抑制氧化作用及抑制细胞凋亡。研究表明它能一定程度缓解脓毒症肺损伤的炎性反应。其机制可能是通过抑制核因子-κB(NF-κB)活化,减轻TNF-α等炎症因子的释放[8],减轻肺脏炎症渗出的程度,延长小鼠的生存时间。应用右美托咪定的抗炎机制可能是通过Toll样受体4(TLR4)起作用,也有学者研究发现右美托咪定可改善线粒体功能从而抑制神经细胞凋亡[11],可能和改善线粒体通透性相关,该药物能抑制下游炎症细胞因子的产生,对脏器产生保护作用,也能降低心肌缺血的并发症[12]。
MMP是含锌的内肽酶家族。目前已研究出的有23种不同的MMP,这些酶作为无活性的前体形式进行分泌,需要激活才能形成有功能性活性酶[9]。有学者研究发现在健康组织中,MMP活性常较低,在病理情况下如炎症、肺纤维化时该酶会升高。在一项比格犬特发性肺纤维化的实验研究中[10],研究者发现MMP高表达,能破坏细胞间的机制及细胞间的连接,其作用可导致早期的肺纤维化,给临床治疗带来极大的困难,因此预防早期肺脏的纤维化有很必要的作用。通过测定循环中MMP7的表达可早期识别肺损伤并且进行早期干预[13],早期观察到血管内皮损伤,采取恰当的治疗措施改善患者预后。MMPs的过度表达导致肺组织损伤和重塑,如果能抑制MMPs表达则可能作为治疗ALI/ARDS的一种新的潜在方法[14]。右美托咪定能一定程度抑制MMP7的表达,但具体机制尚需进一步的实验证实[15]。
本实验中,治疗组小鼠血清MMP7表达降低,光镜下观察肺组织炎性渗出较对照组减少,电镜观察肺血管内皮细胞损伤程度减轻,表明在脓毒症急性肺损伤早期给以右美托咪定治疗后,能够抑制炎性因子的释放,减轻肺血管内皮损伤,有效抑制肺纤维化进展。
综上所述,右美托咪定降低脓毒症急性肺损伤MMP7表达,抑制炎性因子释放,对血管内皮细胞起保护作用。对于脓毒症急性肺损伤的治疗具有一定指导意义。但右美托咪定抑制MMP7产生的机制尚不明确,动物实验对于临床治疗的指导意义有待后续进一步探讨。
