阪崎肠杆菌单克隆抗体的制备及其免疫检测
2022-01-21向双林曾子安杨开怀付舒翔邓灿平
◎ 向双林,曾子安,杨开怀,禹 梁,李 乐,付舒翔,邓灿平,丁 剑
(1.食品安全监测与预警湖南省重点实验室,湖南 长沙 410111;2.湖南远泰生物技术有限公司,湖南 长沙 410013)
阪崎肠杆菌(Enterobacter sakazakii)又被称为克罗诺杆菌,是一种多分布于婴幼儿食品及冲调谷物制品、能在食品表面形成生物膜的革兰氏阴性致病菌[1-2]。有遗传特异性的坂崎肠杆菌易使患者产生耐药性,引起免疫力低下的婴幼儿及老年人受到侵袭性感染,如婴儿坏死性小肠结肠炎、脑膜炎和尿毒症等[3-4]。因其对干燥和极端温度显著耐受,蟑螂、苍蝇等都是其潜在的污染源,使得来自设备或生产环境的坂崎肠杆菌病原体成为婴幼儿配方奶粉及其他加工食品生产中的安全隐患[4]。2018年湖南省销售的婴幼儿食品中阪崎肠杆菌检出率为3.98%[5]。2012年和2019年天津市婴幼儿食品和冲调谷物制品中阪崎肠杆菌检出率分别为3.20%、39.80%[6]。2018—2019年贵州省销售的婴幼儿奶粉中阪崎肠杆菌的污染率达6.00%[7]。各地婴幼儿食品中均存在不同程度的坂崎肠杆菌污染,因此对阪崎肠杆菌进行检测至关重要。
国家标准、行业标准采用逐步筛选培养的传统生化方法鉴定阪崎肠杆菌,但烦琐的操作影响检测效率且易产生与标准值的偏离[8]。API20E等生化自动化检测系统又受限于数据库从而影响结果准确性[9]。依赖于特异性靶点的普通PCR检测阪崎肠杆菌属的方法提高了检测速度但存在漏检及假阳性问题[10]。用基于抗原-抗体特异性、可逆性的免疫测定法鉴别研究细菌已有50多年,而抗体包被的磁珠有强靶向特异性,能快速富集、分离克罗诺杆菌[11],以靶向性的抗原抗体与敏感的酶促反应来提高检测灵敏性的酶联免疫吸附法可不对食品进行分离提取而直接检测阪崎肠杆菌[12],因此高纯度的单克隆抗体对ELISA检测体系的建立尤为重要。
1 材料与方法
1.1 材料与试剂
8周龄BALB/c小鼠(湖南斯莱克景达实验动物有限公司);阪崎肠杆菌(ATCC);SP2/0小鼠骨髓瘤细胞(美国Promab);引物(生工生物工程(上海)股份有限公司);PCR试剂(日本takara);费氏完全及不完全佐剂,HT、HAT培养基,4%台盼蓝,融合剂PEG,DMEM,DMSO(德国Sigma);TMB(联科生物技术);substrate FBS血清(美国Gibco);mAb亚类检测试剂盒,辣根过氧化物酶标记的羊抗鼠抗IgG(武汉博士德)。
1.2 仪器与设备
纯水仪(美国Millipore);酶标仪,离心机(美国Thermo);超净工作台(苏州安泰空气技术);二氧化碳培养箱(赛默飞世尔科技);恒温培养箱(上海浦东荣丰可续仪器);细胞计数板(上海天光仪器厂);冰箱(中国海尔);PCR仪(瑞士Roche);电泳仪(北京六一);电泳成像系统(美国Bio-rad)。
1.3 实验方法
1.3.1 抗原的制备及鉴定
(1)抗原的制备。阪崎肠杆菌于无菌营养肉汤摇床上 37 ℃ 180 r·min-1振荡培养 24 h 后,3 000 r·min-1离心10 min收集菌体,用平板计数法进行活菌计数。所得菌体用1.5%福尔马林灭活16 h,再用无菌的生理盐水洗涤2次并稀释至1.0×1010CFU·mL-1作为免疫原,于-20 ℃保存备用。
(2)对阪崎肠杆菌进行菌种鉴定。从原始菌种中吸取1 mL菌液接种于10 mL无菌营养肉汤培养基中,36 ℃培养24 h。取1~2 μL菌液稀释100倍,沸水浴20 min后取1 μL煮沸的菌液上清液为模板。根据阪崎肠杆菌(GenBank:AB004746)的16S rRNA基因和外膜蛋白A基因(ompA)序列分别设计两对特异性引物。①16S-F:GGTAGCTAATACCGCA;16S-R:TTAGCTCCGGAAGCC(702 bp)。② 16S-F:GCATGGCTGTCGTCA;16S-R:ATGAATCACAAAGTGG(450 bp)。 ③ ompA-F:GGATTTAACCGTGAACTTTTCC;ompA-R:CGCCAGCGATGTTAGAAGA(469 bp)。④ompA-F:TGAAAGCAATCGACAAGAAG;ompA-R:ACTCATTACCCCTCCTGATG(1 680 bp)。然后进行PCR扩增,实时荧光PCR反应体系包括:2 μL 10×Buffer,1.6 μL dNTP,上下游引物各 0.5 μL,模板 DNA 1 μL,Taq-酶 0.2 μL,补 dd H2O 至 20 μL。设置反应程序为:94 ℃ 5 min;94 ℃ 1 min;55 ℃ 30 s;72 ℃ 1 min;72 ℃ 8 min,35个循环。反应后取5 μL PCR产物进行1%琼脂糖凝胶电泳。
1.3.2 免疫动物及方法
首次免疫取0.25 mL的0.2 CFU·mL-1菌液与等体积的弗氏完全佐剂充分乳化,皮下或肌肉注射法免疫BALB/c小鼠1#、2#、3#、4#和5#号,每只共注射0.5 mL。3周后,取0.25 mL的0.1 CFU·mL-1菌液与等体积的弗氏不完全佐剂充分乳化,注射部位及剂量同上。以2周为周期进行第3次及第4次免疫。4次免疫后10 d进行尾静脉采血。采集的小鼠血清作为待检测血清,免疫前的小鼠血清作为阴性血清用间接ELISA法进行滴度检测。
1.3.3 细胞融合
选择浑圆、透亮、均一、排列整齐且处于对数生长期的小鼠骨髓瘤细胞进行传代培养,为避免细胞返祖使用8-AG定期处理细胞。对3#号已免疫小鼠进行眼球采血并分离血清为阳性血清于-20 ℃保存。将免疫小鼠脊椎脱臼致死后取脾脏于DMEM液中碾磨收集脾细胞。骨髓瘤细胞与脾细胞以1∶3比例1 500 r·min-1混合5 min。用PEG融合,37 ℃温水中摇动混匀。在96孔板中铺入200 μL上述融合细胞并加入含HAT的培养基进行融合细胞的筛选,于37 ℃,5%CO2培养箱中培养。
1.3.4 杂交瘤细胞阳性筛选及克隆化
将制备完成的小鼠饲养细胞铺于96孔细胞培养板中,至100 μL/孔后将要克隆的阳性孔中的杂交瘤细胞轻轻吹散后计数,将细胞用HT培养基稀释至100 μL/孔,每孔中含1个细胞。9 d后待测细胞约铺满33%孔底,用间接ELISA法对细胞上清液进行效价测定。检测后选择抗体效价较高、细胞生长状态好、呈单集落生长的阳性孔进行亚克隆,再次克隆仍选用HT培养基进行筛选,一次克隆且阳性率达到100%即认为是稳定分泌抗体的单克隆细胞。每次克隆的原孔中的细胞全部转移至24孔板内培养并冻存,将经过有限稀释法3次亚克隆且阳性率达到100%的杂交瘤细胞转移入6孔细胞培养板中培养。
1.3.5 单克隆抗体的制备及纯化
选取8周龄的雌性BALB/c小鼠,每只腹腔注射弗氏不完全佐剂0.5 mL,7~10 d后每只小鼠腹腔注射杂交瘤细胞5×105个。15 d后待小鼠腹部明显鼓胀时收集腹水以4 000 r·min-1离心10 min,取上清液。用辛酸-饱和硫酸铵法进行纯化后,使用间接酶联免疫吸附试验检测单克隆抗体效价,用紫外吸收法测定抗体浓度,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)检测抗体纯度。用Sigma公司生产的抗体亚型检测试剂盒鉴定抗体亚型,用高碘酸钠方法对抗体进行辣根过氧化物酶(Horseradish Peroxidase,HRP)标记,作为检测抗体。
1.3.6 建立双抗夹心ELISA方法
采用棋盘滴定法测定捕捉抗体与检测抗体稀释度。用阪崎肠杆菌单抗抗体2A2作为包被抗体(使用 50 mmol·L-1的 Na2CO3-NaHCO3)包被浓度分别为10.000 00 μg·mL-1、5.000 00 μg·mL-1、2.500 00 μg·mL-1、1.250 00 μg·mL-1、0.625 00 μg·mL-1、0.312 50 μg·mL-1及0.156 25 μg·mL-1,以从高到低的稀释度横向加入酶标板中(100 μL/孔)37 ℃下孵育2 h。用PBS(1×)3次洗涤包被好的酶标板,再向每孔加入200 μL含有1% BSA的PBS封闭液,于37 ℃下封闭1 h后甩干,每孔分别加入100 μL 2.0×105CFU·mL-1的菌液,以等体积PBS作为空白对照,均37 ℃孵育30 min后用PBS洗涤3次。用PBS将HRP标记的阪崎肠杆菌单抗6A6作为酶标二抗,稀释浓度与包被抗体一致,每孔纵向加入100 μL稀释液,最后两孔分别加入阴性对照与空白对照,于37 ℃孵育1 h后用PBS洗涤4次。每孔再加入100 μL TMB底物显色液后避光孵育10 min。完成后每孔加入 50 μL 2 mol·L-1的 H2SO4终止显色反应,用酶标仪进行OD450值检测。将纯化的4株阳性效价高的单克隆抗体分别包被酶标板上,采用双抗夹心法两两配对检测阪崎肠杆菌,同时选择阳性、阴性显色差异最大的配对。
1.3.7 双抗夹心ELISA方法对阪崎肠杆菌特异性的鉴定
利用建立双抗夹心ELISA方法对阪崎肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌和大肠杆菌O157:H7等多种细菌进行检测。
2 结果与分析
2.1 PCR法鉴定阪崎肠杆菌
如图1所示,样品在目标位置附近都有明显亮带,阴性对照(Escherichia coli)及空白对照均无条带,PCR扩增无污染,该菌液为阪崎肠杆菌。
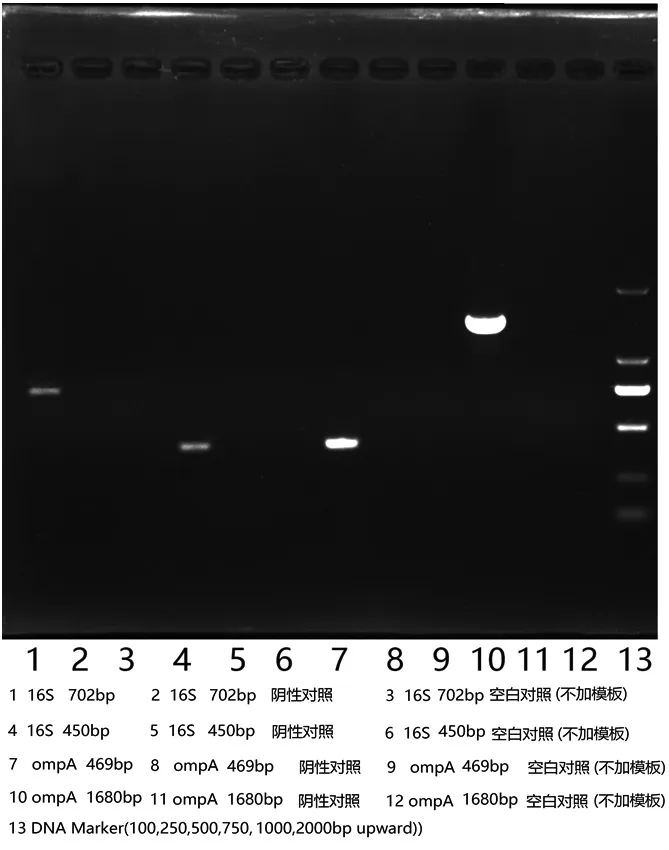
图1 琼脂糖凝胶电泳鉴定阪崎肠杆菌图
2.2 免疫后小鼠血清的抗体滴度
用2.0×105CFU·mL-1阪崎肠杆菌包被酶标板,将 1#、2#、3#、4#、5#小鼠血清以 1:∶ 103,1 ∶ 104,1∶105倍比稀释,以免疫前小鼠血清为阴性对照,利用间接ELISA法检测血清抗体效价,以待检孔OD450值/阴性对照孔OD450值(P/N值)≥2的最大稀释度为血清抗体效价。经过4次免疫后的BALB/c小鼠产生的阪崎肠杆菌抗体滴度结果如图2所示,其中3#老鼠免疫效果最佳。
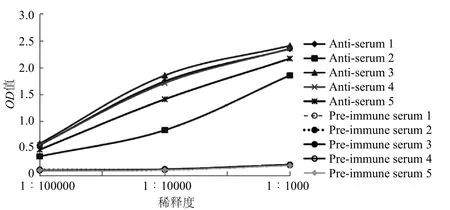
图2 免疫后BALB/c小鼠血清的抗体滴度图
2.3 细胞融合
如图3所示,第2 d显微镜下观察到融合的杂交瘤细胞无污染且培养的细胞量足。第5 d观察到融合的杂交瘤细胞呈葡萄串状集落生长,圆而透亮。第9 d形成稳定的细胞群,此时取其上清液进行抗体检测。
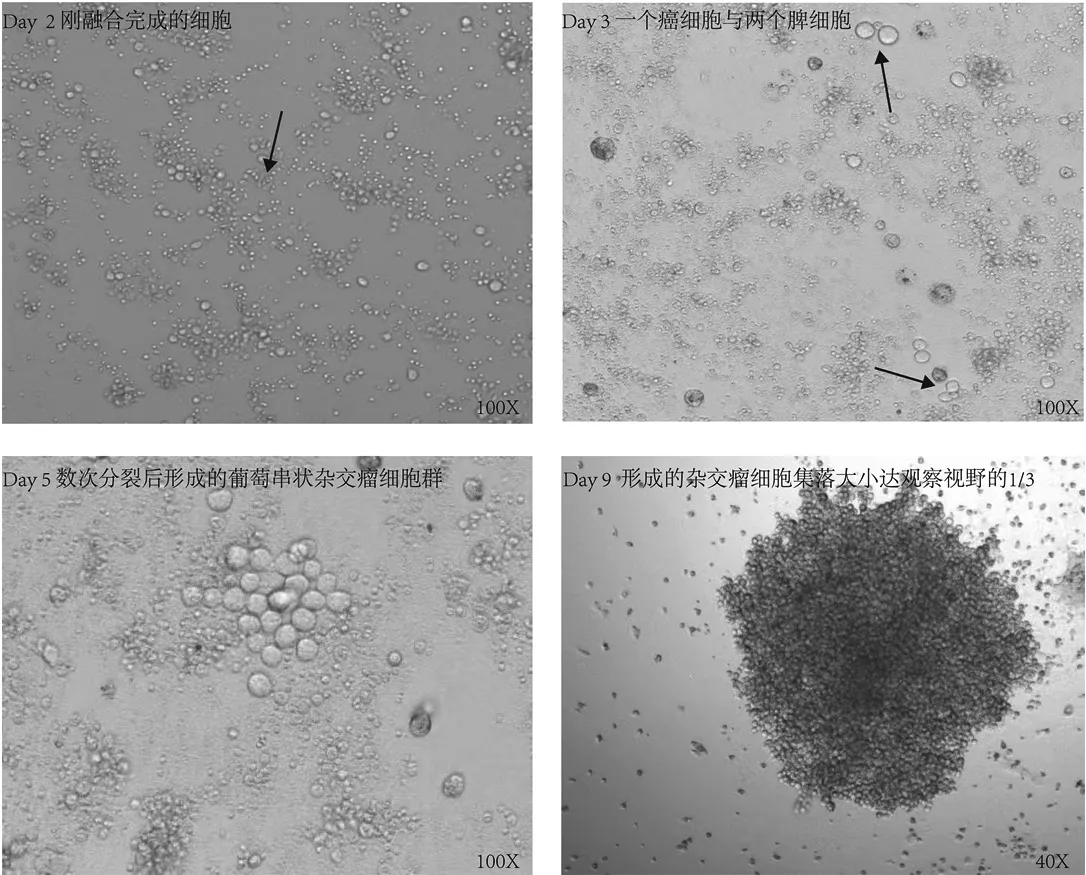
图3 杂交瘤细胞集落图
2.4 杂交瘤细胞的筛选及克隆
经过阳性克隆筛选以及3次克隆后获得了4株分泌抗阪崎肠杆菌单抗的杂交瘤细胞株,根据其所在培养孔的坐标将其分别命名为2A2、4A9、5A3、6A6。
2.5 单克隆抗体的纯化及抗体效价鉴定
将筛选后得到的4株杂交瘤细胞分别注射入5 d前注射过费氏不完全佐剂的BALB/c小鼠腹腔,小鼠产生了3~5 mL腹水,用间接ELISA方法测定腹水中的抗体效价均大于1.0×105。而纯化后单克隆抗体的SDS-PAGE图中一条50 kDa大小的重链带和一条25 kDa大小的轻链带清晰可见,所得抗体具有94%以上的高纯度,详见表1。
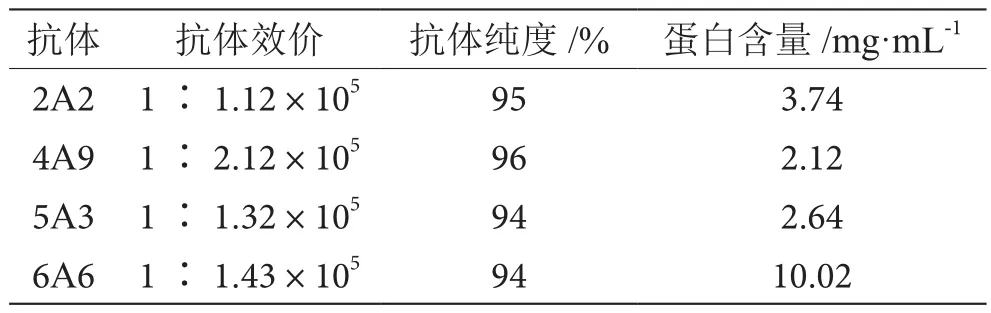
表1 抗体效价表
2.6 建立双抗夹心ELISA体系
将4株细胞株两两配对,根据OD450值及P/N值选择6A6作为酶标二抗,2A2作为包被抗体,经鉴定2抗体均为IgG型且其L链均为K链,进行的棋盘滴定结果如表2所示。该体系捕捉抗体的最佳包被质量浓度为2.5 μg·mL-1;HRP标记的检测抗体的最佳稀释质量浓度为1.25 μg·mL-1,成功建立一种检测食源性阪崎肠杆菌的双抗夹心ELISA体系。
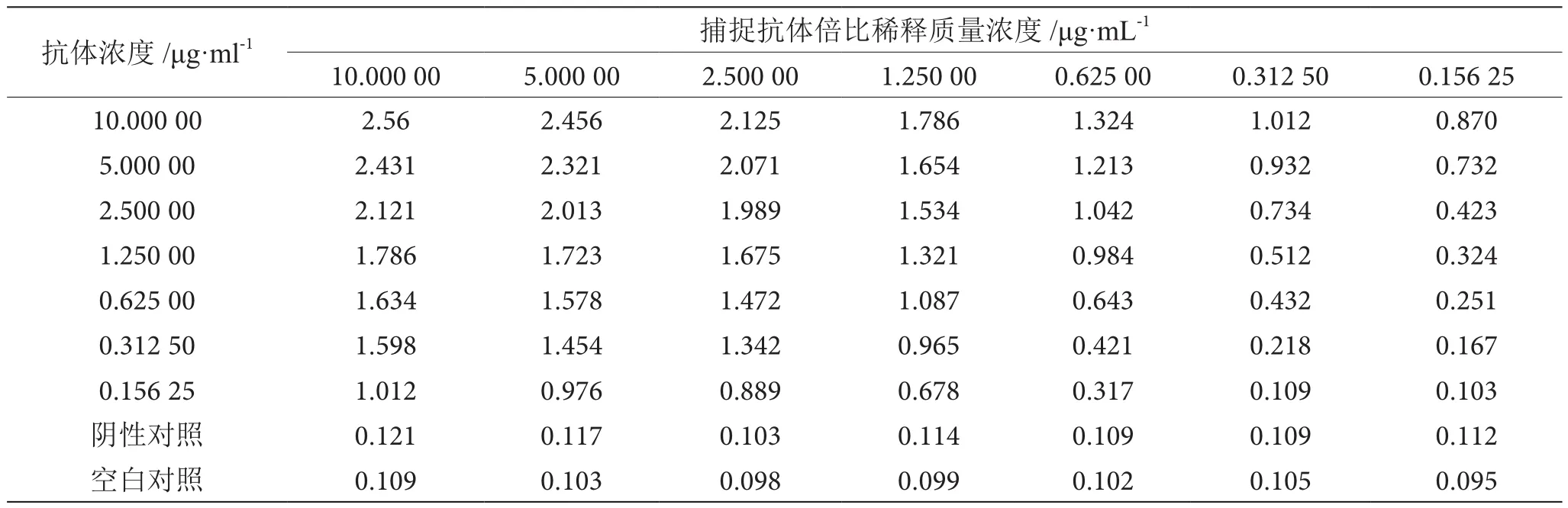
表2 棋盘滴定法鉴定结果表
2.7 双抗夹心ELISA方法的特异性
利用建立的双抗夹心ELISA方法对阪崎肠杆菌与其他菌种进行特异性试验,有效检测阪崎肠杆菌的双抗夹心ELISA法对其他多种常见食源性致病菌无交叉反应性,见表3。
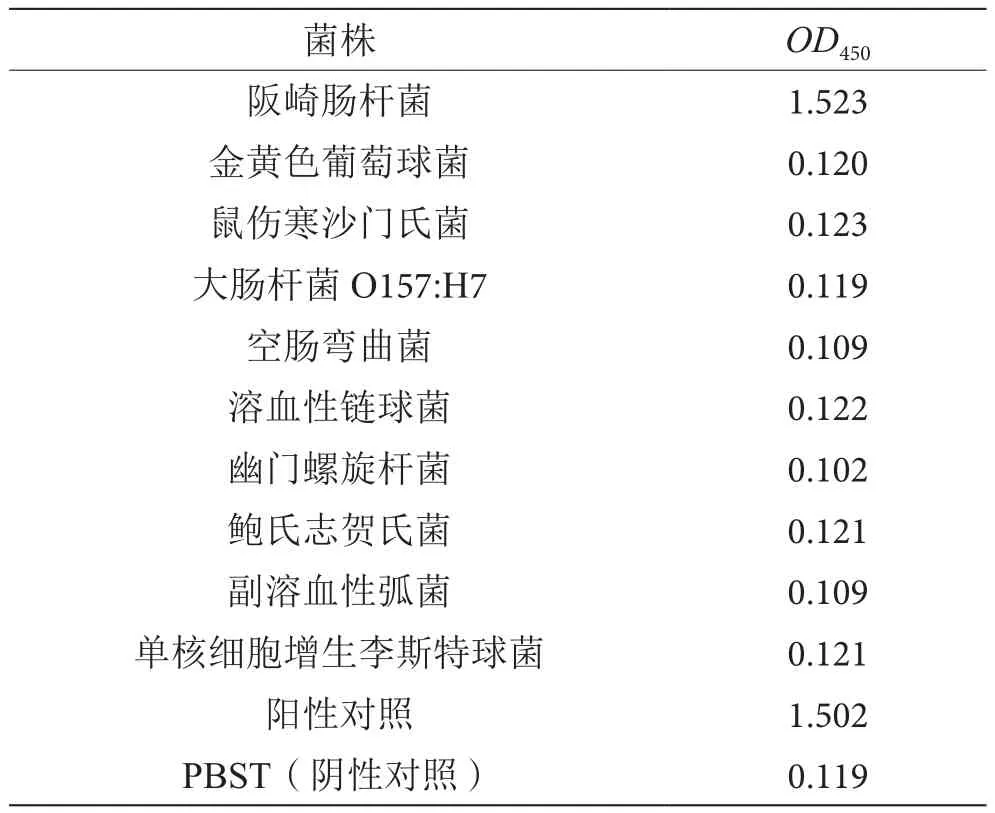
表3 夹心ELISA法与其他病原菌的交叉反应试验表
2.8 双抗夹心ELISA体系标准曲线
如图4所示,将阪崎肠杆菌菌液按1.0×107CFU·mL-1、2.0×106CFU·mL-1、4.0×105CFU·mL-1、1.0×105CFU·mL-1、2.0×104CFU·mL-1、4.0×103CFU·mL-1、1×103CFU·mL-1和4.0×102CFU·mL-1逐级递减稀释,用此双抗夹心ELISA体系检测并建立标准曲线:其对数回归方程为y=0.357 8x-0.291,R2=0.999。当抗原浓度低于1.0×103CFU·mL-1时,线性拟合不佳,因此建立的双抗夹心ELISA对阪崎肠杆菌纯培养菌液的检出限为1.0×103CFU·mL-1。

图4 建立的双抗夹心ELISA体系标准曲线图
3 讨论与结论
阪崎肠杆菌的检测是保障食品安全的重点,免疫检测在检测阪崎肠杆菌领域有广泛应用。翟绪昭[13]等建立间接竞争ELISA体系对阪崎克罗诺杆菌的检测灵敏度达到106CFU·mL-1。SONG等根据兔抗坂崎肠杆菌IgG抗体建立的间接酶联法对纯培养的坂崎肠杆菌的检测范围为5.6×103~2.1×105CFU·mL-1,且缩短检测时间至36 h,但其体系与108CFU·mL-1的粉末佛朗哥氏菌存在轻微交叉反应[14]。石曼等研究的双抗夹心ELISA体系可对克罗诺杆菌属穆汀斯克罗诺杆菌特异性检测,经17 h增菌低至0.1 CFU·g-1,接种样品亦可检出[15]。PARK等[16]制备兔源IgG抗体为检测抗体,鸡源IgY抗体为捕获抗体形成检测坂崎肠杆菌的双抗夹心ELISA体系的检测限为2.0×104CFU·mL-1,高于丁铭[17]使用融合蛋白建立的单克隆抗体形成的双抗夹心ELISA方法的检测限。多项实验表明使用阪崎肠杆菌单克隆抗体建立的双抗体夹心酶联免疫法在纯培养条件下检测限大多能达到104CFU·mL-1[18-20]。本实验用成本低、技术成熟、重现性高的杂交瘤技术制备高纯度的单克隆抗体6A6、2A2,并建立具有良好敏感性的双抗夹心ELISA检测方法,其检测范围可达到103CFU·mL-1,对开发诊断试剂盒和其他快速、省时、易于检测阪崎肠杆菌的工具有重要意义。
