左归丸含药血清对大鼠海马神经元和胶质细胞氧糖剥夺损伤的保护作用及机制研究
2022-01-21刘家峰
刘家峰,舒 庆,张 颖
(1.西安市第九医院中医康复科,陕西 西安 710054;2.西安市第九医院药剂科,陕西 西安 710054; 3.西安市第九医院神经内科,陕西 西安 710054)
有研究[1]显示左归丸能够产生类雌激素作用,通过雌激素受体α(ERα)和雌激素受体β(ERβ)对脑缺血再灌注损伤起到保护作用。脑缺血再灌注损伤是由于脑组织长时间缺血、缺氧,再灌注后血氧水平恢复,活性氧短时间生成激增,诱导细胞产生一系列的损伤反应,进而诱导神经细胞凋亡,产生神经功能缺陷[2-4]。左归丸对大鼠脑缺血的保护作用已经有所报道[5],但是目前尚无其直接针对离体细胞水平的研究。因此,本研究通过制备左归丸含药血清、原代培养神经元胶质混合细胞以及细胞氧糖剥夺处理[6],在细胞水平研究左归丸含药血清对细胞氧糖剥夺损伤的作用及机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:健康SPF级SD雄性大鼠,出生后1~3 d,体重200 g左右,购自西安交通大学动物实验中心。动物生产许可证号:SYXK(陕)2020-005。
1.1.2 主要试剂:左归丸(Z11020735),购自北京同仁堂股份有限公司;0.3 g/L戊巴比妥钠(H31020240),购自上海新亚药业有限公司;相关一抗购自美国Abcam公司,二抗购自上海易利生物科技有限公司;ER非特异性拮抗剂ICI182780,购自美国Sigma公司;DMEM/F12培养基,购自赛默飞世尔科技中国有限公司。
1.2 实验方法
1.2.1 含药血清制备:按照成人临床日用剂量与体重折算系数比计算出相当于中剂量的左归丸大鼠用药量为2.1 g/(kg·d)。左归丸加双蒸水(ddH2O)配制成含左归丸0.2 g/ml的混悬液,每次灌胃时按灌服中药量1 ml/200 g大鼠体重进行稀释,每天药量按固定时间分2次灌胃,每次间隔4 h,连续给药3 d。第3天采血前大鼠禁食12 h,采血后分离血清,56 ℃灭活30 min,220 nm滤膜过滤除菌,-20 ℃保存备用。
1.2.2 大鼠海马神经元胶质细胞混合细胞原代培养:健康新生SD大鼠用75%酒精消毒,迅速断头。取脑组织,分离组织并置于无菌培养皿中。培养皿中含有预先冷却的磷酸盐缓冲液(PBS)用于细胞培养。对于获得的大脑皮层,小心地去除脑膜和血管膜。将分离的大脑皮层移入含有胰蛋白酶(终浓度0.125%)消化液的小瓶中,在37 ℃下切割并消化10 min。当组织变成半透明时,加入等体积DMEM/F12培养基停止消化。然后用滴管轻轻吹过,并用200目尼龙滤网过滤。将过滤后获得的细胞悬液以150 g离心8 min,丢弃上清液,将细胞重新悬浮在DMEM/F12完全培养基中,并将细胞密度调节至5×105/cm2,然后将其接种到预涂有聚赖氨酸的培养瓶中。将细胞在37 ℃、5% CO2条件下中培养。24 h后更换完整培养基,然后每2~3 d更换1次液体。
1.2.3 细胞分组及氧糖剥夺处理:将原代培养的大鼠海马神经元胶质混合细胞随机分为对照组、模型组、含药血清组和抑制剂组。对照组细胞不做特别处理。模型组细胞给予氧糖剥夺,方案为换用无糖DMEM培养基并将细胞置于缺氧箱中,通入含95%氮气和5% CO2混合气体,缺血、缺氧2 h后更换正常培养基。含药血清组细胞除给予氧糖剥夺外,培养基中加入左归丸含药血清1 ml。抑制剂组细胞除给予氧糖剥夺、左归丸含药血清外,还另外给予ER非特异性拮抗剂ICI182780进行干预。
1.2.4 CCK-8实验:将对数期的贴壁细胞通过胰酶进行消化,使细胞脱落。待大部分细胞脱落后,加入2倍体积的培养基终止消化。瓶中液体全部转移至离心管,以1000 r/min离心5 min,弃上清,用1 ml含血清培养基重悬,用细胞计数仪进行计数。根据计数结果稀释细胞,使细胞浓度为1×106/ml。将稀释好的细胞种于96孔板,每孔加100 μl稀释好的细胞悬液。接种24 h、待细胞贴壁良好后,吸出培养基,对照组加入不含药物培养基,其他三组加对应的含药培养基,继续孵育12 h。再次吸出培养基,各孔加入含CCK-8的培养基,CCK-8占培养基体积约1/10。孵育1 h,待颜色变为橙色后用酶标仪在450 nm波长下检测。
1.2.5 酶联免疫吸附(ELISA)实验:收集细胞培养液样本,采用ELISA法检测氧化应激和炎症因子谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)表达水平。首先,在实验前确定酶标板孔数(包括空白对照孔,每个标准品和样品重复3个孔)。向孔中加入100 μl预稀释浓度梯度标准品或待测样品。同时,在空白对照孔中加入100 μl样品稀释剂。加入样品后盖上酶标板,置于37 ℃恒温箱中90 min,反应后除去酶标板中液体,依次加入预先制备的生物素化抗细胞因子抗体工作液,每孔100 μl,在37 ℃下孵育60 min。反应完成后用0.01 mmol/L PBS洗涤混合物3次,每次浸泡1 min。预先制备的ABC工作液(包括HRP-链霉亲和素)按100 μl/孔依次加入,置于37 ℃恒温箱中30 min,反应后用0.01 mmol/L PBS洗涤5次,每次浸泡1~2 min。加入TMB显色液,置于37 °C培养箱中15 min。以每孔100 μl加入TMB终止液,并在450 nm处测定吸光度值。对照孔吸光度值减去各浓度标准样品和待测样品的吸光度值后,对标准样品数据进行线性拟合,得到标准曲线,用标准曲线计算各样品中细胞因子的浓度。
1.2.6 Western blot实验:对TNF-α、IL-1β、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关x蛋白(Bax)、半胱氨酸蛋白酶-3(Caspase-3)及磷脂酰肌醇激酶(PI3K)/蛋白激酶B(AKT)通路相关蛋白表达水平进行检测。收集细胞后转入1.5 ml离心管中,加入1 ml裂解液,置于冰上裂解30 min。裂解后在4 ℃、12000 r/min条件下离心15 min,取上清置于另一个干净的EP管中,紫外分光光度计测量蛋白浓度。5×蛋白上样缓冲液与蛋白按照1∶4的比例混匀,95 ℃条件下进行蛋白灭活5 min。聚丙烯酰胺(SDS-PAGE)凝胶电泳:分离胶为10%十二烷基硫酸钠-聚丙烯酰胺凝胶,按50 μg蛋白总量上样。首先用80 V低压条件跑胶至样品到压缩胶与分离胶交界处,随后改用100 V恒压条件,直到能够分离各个目的条带。转膜条件:用湿转法,恒流250 mA转膜90 min。转膜完成后,将NC膜放于TBST所配制的5%脱脂牛奶中,进行蛋白封闭1 h。封闭之后用1%牛奶配置的一抗于4 ℃条件孵育过夜。次日,NC膜用TBST清洗3次,每次10 min,随后用1%牛奶配制的二抗室温孵育1 h。再用TBST洗涤3次,每次10 min。用ECL显影定影液孵育NC膜1 min,将NC膜条带放入显影器进行显影。
2 结 果
2.1 各组细胞存活率比较 见图1。与对照组相比,模型组细胞在氧糖剥夺后细胞存活率显著降低(P<0.05)。与模型组相比,含药血清组细胞存活率显著增加(P<0.05)。ER拮抗剂ICI182780干预后,左归丸含药血清的作用被显著减弱(P<0.05)。抑制剂组与模型组细胞存活率比较差异无统计学意义(P>0.05)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.2 各组细胞GSH-Px、MDA、IL-1β、TNF-α表达水平比较 见表1。与对照组相比,模型组细胞在氧糖剥夺后GSH-Px水平显著减少,MDA、IL-1β、TNF-α水平出现显著升高(均P<0.05)。与模型组相比,含药血清组细胞GSH-Px水平显著增加,MDA、IL-1β、TNF-α水平出现明显下降(均P<0.05)。ER拮抗剂ICI182780干预后,左归丸含药血清的作用被显著减弱(P<0.05)。抑制剂组与模型组细胞GSH-Px、MDA、IL-1β、TNF-α水平比较差异无统计学意义(均P>0.05)。
表1 各组细胞GSH-Px、MDA、IL-1β、TNF-α表达水平比较
2.3 各组细胞TNF-α、IL-1β蛋白表达水平比较 见图2。与对照组相比,模型组细胞在氧糖剥夺后TNF-α、IL-1β蛋白表达水平显著上升(均P<0.05)。与模型组相比,含药血清组细胞TNF-α、IL-1β蛋白表达水平则出现显著下降(均P<0.05)。ER拮抗剂ICI182780干预后,左归丸含药血清的作用被显著减弱(均P<0.05)。抑制剂组与模型组细胞TNF-α、IL-1β蛋白表达水平比较差异无统计学意义(均P>0.05)。
2.4 各组细胞Bcl-2、Bax、Caspase-3蛋白表达水平比较 见图3。与对照组相比,模型组细胞在氧糖剥夺后Bcl-2蛋白表达水平显著减少,Bax和Caspase-3蛋白表达水平出现显著升高(均P<0.05)。与模型组相比,含药血清组Bcl-2蛋白表达水平显著上调,Bax和Caspase-3蛋白表达水平出现显著下调(均P<0.05)。ER拮抗剂ICI182780干预后,左归丸含药血清的作用被显著减弱(P<0.05)。抑制剂组与模型组Bcl-2、Bax和Caspase-3蛋白表达水平比较差异无统计学意义(均P>0.05)。
2.5 各组细胞PI3K/AKT信号通路相关蛋白表达水平比较 见图4。与对照组相比,模型组细胞在氧糖剥夺后PI3K/AKT信号通路p-PI3K、p-AKT蛋白表达水平显著下降(均P<0.05)。与模型组相比,含药血清组细胞p-PI3K、p-AKT蛋白表达水平显著上升(均P<0.05)。ER拮抗剂ICI182780干预后,左归丸含药血清的作用被显著减弱(均P<0.05)。抑制剂组与模型组细胞p-PI3K、p-AKT蛋白表达水平比较差异无统计学意义(均P>0.05)。

左图:为蛋白电泳图;右图:与对照组比较,*P<0.05;与模型组比较,#P<0.05

左图:蛋白电泳图;右图:与对照组比较,*P<0.05;与模型组比较,#P<0.05
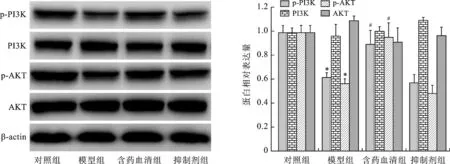
左图:蛋白电泳图;右图:与对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨 论
缺血性脑损伤是危害人类健康的主要疾病之一,致死、致残率极高,目前治疗手段有限,特别是针对卒中后的神经功能恢复一直没有有效的治疗策略或药物。中药左归丸是传统补肾名方[7],有研究发现其能够产生类雌激素作用,对脑缺血再灌注损伤产生保护作用。我们前期研究也发现左归丸可以通过ERs/PI3K/AKT信号通路对大鼠脑缺血再灌注损伤起到保护作用,但是目前尚没有在细胞水平研究证实左归丸对缺血损伤的保护作用。
缺血性脑损伤发生后,由于缺血、缺氧,导致脑细胞特别是神经元损伤,诱导细胞凋亡,从而直接影响神经功能缺陷[8-9]。因此,减少神经细胞损伤是减轻脑缺血再灌注损伤的重要策略。海马组织是中枢神经系统的重要组成部分,与多种神经功能活动相关,也是对缺血、缺氧敏感的区域,因此本研究选择原代培养大鼠海马神经元胶质细胞混合细胞进行研究[10-12]。为了使中药药效与中药成分的研究能协调一致,我们首先制备了左归丸含药血清。本研究实验结果显示,氧糖剥夺导致原代培养的神经细胞存活率显著降低,左归丸含药血清可以显著地保护氧糖剥夺造成的神经细胞凋亡。凋亡相关蛋白Bcl-2、Bax和Caspase-3的检测结果也与CCK-8实验结果一致,氧糖剥夺后Bcl-2蛋白表达下降,Bax和Caspase-3蛋白表达增加,左归丸含药血清干预后Bcl-2蛋白表达增加,Bax和Caspase-3蛋白表达减少。本研究结果首次从细胞水平证实左归丸对缺血性脑损伤能够起到保护作用。
研究[13-16]证实,炎症、氧化应激、细胞凋亡和兴奋性毒性等机制参与了脑缺血再灌注损伤过程。我们前期在整体动物上的研究也证实左归丸的抗脑缺血作用与其对氧化应激、炎症的调控作用相关。因此,本研究在细胞水平也检测了细胞中氧化应激标记物GSH-Px、MDA和炎症因子TNF-α、IL-1β的水平,以及TNF-α、IL-1β蛋白表达水平。从结果可以看到,氧糖剥夺可致细胞中GSH-Px水平显著下降,MDA、TNF-α、IL-1β水平上升,TNF-α、IL-1β蛋白表达水平也出现显著上调,因此左归丸含药血清干预可以有效地减弱氧糖剥夺造成的氧化应激和炎性反应。
先前已经有多篇研究提示左归丸具有雌激素样作用,我们在动物水平的研究中也发现其对缺血性脑损伤的保护作用由ERs/PI3K/AKT信号通路介导。ERs/PI3K/AKT信号通路在既往研究[17-20]中也被证实参与对缺血性脑损伤的调控。本研究中,模型组细胞p-PI3K、p-AKT蛋白表达水平显著下降,含药血清组细胞p-PI3K、p-AKT蛋白表达水平显著上升,ER拮抗剂ICI182780干预可以显著减弱左归丸含药血清在氧糖剥夺过程中对PI3K/AKT通路的调节作用。
综上所述,左归丸含药血清对大鼠海马神经元和胶质细胞氧糖剥夺损伤具有保护作用,其机制与调控氧化应激、炎性反应及PI3K/AKT通路有关。
