核壳结构树状大分子的设计及其生物医学应用
2022-01-21汪大圆沈明武史向阳
宋 聪,汪大圆,沈明武,史向阳
(东华大学 化学化工与生物工程学院, 上海 201620)
1 前言
树状大分子,特别是被人们誉为“人工蛋白”的聚酰胺-胺[poly(amidoamine),PAMAM]树状大分子,自20世纪80年代面世以来,其理化性质和生物医学应用得到了广泛的探索和蓬勃的发展[1]。树状大分子是一类具有单分散特性以及高度分支三维结构的纳米尺度的合成大分子[2],因其分子结构犹如树枝状而得名。与传统的线性聚合物相比,树状大分子具有稳定的结构、丰富的内部空腔、优异的水溶性以及易功能化和非免疫原性等特点[3]。在被功能化分子修饰或用于药物包封后,树状大分子已成为纳米医学领域的最佳选择之一,被广泛应用于生物成像[4-5]、基因/药物治疗[6-10]、联合治疗[11-12]以及诊疗一体化[13-15]等。
随着研究的不断深入,研究者们已陆续揭示出单代树状大分子在纳米医学领域存在的一些局限性。一般来说,低代树状大分子(如第3代(G3)PAMAM 树状大分子)虽然合成简单,成本较低,但有限的载药能力和较低的基因转染效率在一定程度上限制了其在纳米医学中的应用[16-17],而高代树状大分子(超过第5代)虽然拥有更大的分子尺寸、更好的基因转染效率[17-19]、更强的渗透性[20-22]以及更高的载药量[10],但合成步骤繁琐,纯化困难,成本昂贵,纳米医学应用也受到一定的限制。此外,单代树状大分子的尺寸较小,如G8 PAMAM的尺寸仍小于10 nm,而常应用于癌症医学领域的G5 PAMAM树状大分子尺寸只有5.4 nm,限制了其基于实体瘤的高通透性和滞留效应的被动靶向功能。另外,除以胱胺为核的PAMAM树状大分子具有氧化还原响应特性外[14],单代树状大分子几乎不显示对外场的刺激响应性,从而限制了它们在与肿瘤微环境反应性递送有关的生物医学应用。更重要的是,高代树状大分子的载药量也会因其内部空腔的体积有限而无法与胶束、凝胶、脂质体等制剂的载药量相比[23]。因此,要想使树状大分子更好地应用于生物医学,研究者们必须独辟蹊径以克服这些局限性。
为了克服单代树状大分子的应用局限,使用两个或多个树状大分子作为反应模块,通过不同类型的相互作用或驱动力构建结构稳定的超结构树状大分子纳米体系(superstructured dendrimeric nanoconstructs, SDNs),以代替单代树状大分子,是可行途径之一[23]。与高代树状大分子的合成相比,SDNs具有结构精确且可控的特性,且更容易制备。SDNs通常可根据产品结构或合成策略被分为5类,分别是核壳结构树状大分子(core-shell tecto dendrimers, CSTDs)[24-26]、“哑铃型”树状大分子[27-29]、树状大分子纳米团簇[30-31]、树状大分子纳米凝胶[32-33]以及基于树状大分子的杂化纳米团簇[34-35]。其中,通过简单方法合成的以相对高代树状大分子为核、低代树状大分子为壳的CSTDs不仅具有与高代树状大分子相似的优异特性,如丰富的末端官能团、疏水的内部结构、高水溶性等,还能够克服单代树状大分子的应用局限。本文基于这一领域的大量文献,对CSTDs的合成策略及其纳米医学应用做综合评述,其中,为清晰起见,表1列出了基于各类树状大分子合成的CSTDs及其相关生物医学应用。同时,结合纳米技术的发展现状,分析了CSTDs在生物医学应用中的挑战和未来前景。

表1 CSTDs的合成策略及其生物医学应用总结Table 1 Summary of the synthesis and applications of CSTDs
2 CSTDs的合成
以树状大分子为反应模块合成CSTDs的方法主要有两种,一是高代树状大分子和低代树状大分子末端基团之间发生化学反应,原位产生共价键而合成CSTDs;另一种是分别在高、低代树状大分子表面修饰主、客体分子,进而利用主客体识别的方法进行超分子组装,合成CSTDs。
2.1 共价键合成法
合成步骤繁琐、纯化难度高是高代树状大分子合成过程中难以克服的困境。为解决这些问题,Tomalia研究组率先通过原位共价键法合成并命名了CSTDs[36-37]。该方法主要是将带有氨基(-NH2)末端的PAMAM树状大分子和过量的带有羧基(-COOH)末端的PAMAM树状大分子混合在氯化锂(LiCl)水溶液中,破坏两种树状大分子之间的强静电相互作用,然后加入1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)以活化羧基基团,从而通过偶联反应原位形成酰胺键,得到以氨基端树状大分子为核、以羧基端树状大分子为壳的CSTDs(图1a)[24, 38]。值得注意的是,如果反应过程中不添加LiCl,将有可能因为核壳组分之间的强电荷作用得到质量分布广泛、不均一的核壳聚集体。因此,为了获得单分散的产物,树状大分子核、壳组分多在室温下与适量LiCl(约0.5 wt.%)水溶液中混合进行核-壳反应形成CSTDs。在这种合成方法中,研究者们得到的是具有饱和壳组分的CSTDs,其结构尺寸及理化性能均可与更高代的树状大分子相媲美[37]。以形成的G5/G3 CSTDs为例[24],每个核组分G5.NH2周围平均被10个G3.COOH壳组分所包围,而且通过原子力显微镜(AFM)成像、梯度聚丙烯酰胺凝胶电泳、尺寸排阻色谱等实验结果表明,单个G5/G3 CSTDs的尺寸和分子量大小介于G7 PAMAM与G8 PAMAM树状大分子之间。更重要的是,G5/G3 CSTDs是由一步法合成的,方法简单且产率高达90%,壳层组分饱和度高达75%~83%;而如果通过传统的发散法由G5 PAMAM树状大分子反应生成G8 PAMAM树状大分子,则至少需要6个反应步骤。此外,Schilrreff等人[39]也利用同样的共价键法进行了饱和壳型G5/G2.5 CSTDs的合成。研究结果表明,每个核组分G5.NH2周围被9~10个G2.5.COOH壳组分所包围,壳层组分饱和度达60%-67%,而且获得的G5/G2.5 CSTDs 的水动力尺寸接近G6.5 树状大分子。
除利用共价键方法合成饱和壳型CSTDs外,Tomalia研究组在2000年还报道合成了以氨基封端的PAMAM树状大分子为核、以亲电性甲基酯封端的PAMAM树状大分子为壳的部分壳填充型CSTDs[36]。通常,部分壳填充型CSTDs是由过量的壳组分树状大分子与少量的核组分树状大分子在密封管中混合,并于40 ℃条件下加热25 d直接发生共价反应后所得(图1b)。与饱和壳型CSTDs的合成相比,部分壳填充型CSTDs在合成时直接在核和壳之间形成随机共价键,直到所有可接触的核组分表面空间被填满。由于核、壳组分之间共价结合是随机的、无序的,所以核组分的表面区域始终无法被壳组分树状大分子完全填充。与理论上的壳组分饱和度计算值相比,实际上每个CSTDs壳层组分饱和度为40%~66%。近年来,Studzian等人[40]也利用同样的一步法进行了部分壳填充型G5/G2.5 CSTDs的合成。为了能够方便应用于生物医学,部分壳填充型G5/G2.5 CSTDs的酯表面被tris(2-aminoethyl) amine (TREN)修饰而生成了G5/G3-(TREN) CSTDs。
一般来说,通过原位共价键法合成的CSTDs具有一定的缺陷。比如,由于聚集和沉淀相关技术问题的存在,饱和壳型CSTDs必须在LiCl存在的条件下才能合成,而且在相同的反应条件下,如果使用以羧基封端的PAMAM树状大分子为核,以过量的氨基封端树状大分子为壳,则无法获得饱和壳型CSTDs[37];而部分壳填充型CSTDs的合成过程反应性较差,很难得到有序控制[36]。在过去的20年里,尽管研究人员试图控制CSTDs的合成稳定性并努力将其应用于生物医学领域,但研究似乎停滞不前。在纳米材料飞速发展的今天,越来越多的实验证据显示,表面具有氨基基团的纳米材料(特别是树状大分子)更能广泛应用于纳米医学,特别是癌症诊疗领域。
2.2 超分子主客体识别合成法
近年来,超分子主客体系统被陆续开发,为氨基封端CSTDs的合成及其生物医学应用带来了巨大的变革[41]。有研究表明, β-环糊精(β-cyclodextrin, β-CD)和金刚烷(adamantane, Ad)之间强烈的超分子主客体识别作用已被广泛用于构建超分子自组装纳米体系,而且构建的β-CD/Ad超分子系统自身具有非免疫原性和良好的生物相容性[41-43]。基于此,我们课题组利用β-CD和Ad之间的主客体识别作用自组装合成了氨基封端的CSTDs[25-26, 44]。如图2所示,首先分别合成Ad修饰的G3.NH2(G3-Ad)和β-CD修饰的G5.NH2(G5-CD),然后通过β-CD和Ad之间的超分子识别作用,合成了以G5为核、G3为壳的CSTDs。与共价键法合成的饱和型CSTDs相比,主客体识别法合成的CSTDs中每个核组分G5-CD周围最多可被12个G3-Ad壳组分所包围,在二维核磁共振氢谱(2D NOESY)的3.5~4.0 ppm和1.5~1.7 ppm处能明显观察出相关质子交叉信号,说明了β-CD和Ad基团之间存在强主-客体相互作用。同时,AFM成像也确定了G5-CD/Ad-G3 CSTDs具有单分散性良好的球型形态,测得的高度约为9 nm左右,高于单独的G3-Ad(3 nm)和 G5-CD (5 nm),这也从侧面说明了CSTDs已通过超分子主-客体组装成功合成。

图1 饱和壳型CSTDs(a)和部分壳填充型CSTDs(b)的合成[16]Fig 1 Synthesis of the saturated shell CSTDs(a) and partial shell-filled CSTDs(b)[16]
虽然β-CD/Ad超分子系统成功构建出的氨基封端CSTDs已经能够更好地应用于生物医学领域,但是β-CD/Ad超分子系统不具有响应性特征,难以利用肿瘤微环境(如肿瘤微环境多呈弱酸性)对癌症进行更好的诊断或治疗。为进一步扩大CSTDs的应用范畴,本课题组选用β-CD/苯并咪唑(BM)超分子系统构建了CSTDs[45]。该超分子主客体系统除具有高效的主客体识别作用外,还具有pH响应性,即在pH=7.4的生理条件下,BM可通过主客体识别作用进入β-CD的空腔,合成BM/β-CD主客体纳米体系;而在pH<6的微酸性条件下,BM由于质子化会从β-CD的空腔中脱离。因此,根据β-CD/BM的优势,合成的G5-CD/BM-G3 CSTDs载药后,会在酸性条件下分解CSTDs为单独的树状大分子,进而加速药物的释放,从而有望利用肿瘤弱酸环境增强癌症治疗效果。
3 CSTDs的生物医学应用
CSTDs作为一种既能保持树状大分子优良特性又能克服树状大分子合成和应用局限的纳米材料,近年来被越来越多地应用于生物医学研究,特别是癌症诊疗领域,包括生物学成像[46-47]、化疗[45, 48]、基因递送[25, 49]及联合治疗[50]等。
3.1 生物学成像
生物学成像是在分子或细胞水平上观测生物过程的关键。基于纳米平台的生物成像已成为肿瘤或疾病诊断不可或缺的技术之一[51]。CSTDs经过荧光染料或其他成像试剂修饰后,可用于不同目的的生物学成像[44, 46]。例如,共价键法合成的G5/G2.5 CSTDs 可用异硫氰酸荧光素(FITC)染料进行荧光标记,从而可通过荧光显微镜观察FITC-G5/G2.5 CSTDs被各种胶质细胞吞噬的能力和时间依赖性变化[47]。通过体外荧光成像结果分析,胶质细胞对FITC-G5/G2.5 CSTDs的摄取在6 h后达到了最高,而胶质细胞对用FITC标记的G6.5树状大分子的吞噬则在1 h就达到了摄取瓶颈,说明与单代树状大分子相比,G5/G2.5 CSTDs能够促进细胞对材料的摄取。此外,Studzian等人[40]研究了哺乳动物细胞对G5/G3-(TREN) CSTDs的摄取,研究结果表明,G5/G3-(TREN) CSTDs易于进入细胞,并表现出独特的无毒阳离子特性和强烈的非传统固有荧光发射特性,适用于直接生物成像。
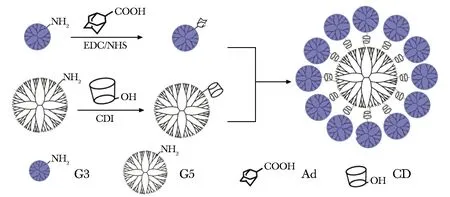
图2 G5-CD/Ad-G3 CSTDs的合成[44]Fig 2 Synthesis of G5-CD/Ad-G3 CSTDs[44]
除荧光成像外,氨基封端的CSTDs经修饰后也可以用于其他方面的生物学成像。有研究表明,更高分子量的高代树状大分子负载的钆(Gd)螯合物纵向弛豫率(r1)和磁共振(magnetic resonance, MR)成像灵敏度更高[51-53]。基于此,我们课题组设计了螯合钆离子的 CSTDs 纳米平台,并探索了其基于尺寸或分子量的因素下在肿瘤微环境中的通透性及改善肿瘤MR成像的能力[44]。首先,合成G5.NH2-CD/Ad-G3.NH2CSTDs,并在此基础上与四氮杂环十二烷四乙酸 (DOTA)-Gd(Ⅲ)螯合剂共轭并进一步乙酰化,得到产物CSTD.NHAc-DOTA(Gd)复合物。同时,利用相同方法合成G5.NHAc-DOTA(Gd)复合物。研究结果表明,与 G5.NHAc-DOTA(Gd)复合物相比,CSTD.NHAc-DOTA(Gd)复合物具有更高分子量和体积,因而具有更长的旋转相关时间,测得r1为7.34 mM-1s-1,是G5.NHAc-DOTA(Gd)弛豫率(4.92 mM-1s-1)的1.5 倍,也是临床钆剂Magnevist弛豫率(4.56 mM-1s-1)的1.6倍。更重要的是,CSTD.NHAc-DOTA(Gd)复合物在体外3D细胞球荧光成像实验中呈现出比G5.NHAc-DOTA(Gd) 复合物更好的渗透性(EPR效应)。在体内MR成像实验中,CSTD.NHAc-DOTA(Gd)复合物也显示出更好的肿瘤MR成像能力(图3),也就是说,与G5.NHAc-DOTA(Gd) 复合物相比,开发的CSTD.NHAc-DOTA(Gd)复合物拥有肿瘤EPR和弛豫率双重增强的T1加权MR成像能力。
此外,CSTDs经过功能化修饰后,不仅具有抗蛋白吸附功能,还可以用于靶向肿瘤的双模态成像[26, 54]。例如,先在G5-CD内部包裹金纳米颗粒,然后利用CD/Ad的主客体识别作用构建包裹金纳米颗粒的核-壳结构树状大分子(Au CSTDs)。以Au CSTDs为纳米平台,在其氨基表面依次修饰RGD肽、Gd螯合剂(DTPA-Gd)以及两性离子1,3-丙磺酸内酯(1,3-PS),得到多功能RGD-Gd@Au CSTD-PS纳米探针。研究表明,该探针不仅具有抗蛋白吸附性能,还具有特异性靶向乳腺癌细胞(表面αvβ3整合素过表达)的能力,并且可作为CT/MR双模态成像造影剂应用于乳腺癌肿瘤模型的双模态成像,达到肿瘤精准诊断的目的[54]。

图3 在4T1皮下瘤模型中瘤周注射CSTD.NHAc-DOTA(Gd)(a)或G5.NHAc-DOTA(Gd)(b)前后不同时间点的体内MR成像图和信噪比(SNR)统计图(c)。白色箭头指向肿瘤部位;注射的材料均溶解在PBS中,[Gd]=5 mmol/L,用量100 μL/每只[44]
3.2 化疗
延长血液循环时间,减少对正常组织的毒副作用,提高抗癌药物的治疗效果,是开发药物递送系统的初衷,也是化疗的关键[10]。与单代树状大分子相比,CSTDs因具有更大的内部空腔结构、分子尺寸以及更丰富的表面基团而显示出更高的载药效率和巨大的药物递送应用潜力。早在2012年,Schilrreff等人[39]发现共价键法合成的G5/G2.5 CSTDs对黑色素瘤细胞有选择性的细胞毒性,却在体外不会损害健康的角质形成细胞。为了增强肿瘤细胞杀伤效果,他们进一步将6个甲氨蝶呤(MTX)药物分子和31个唑来膦酸(ZOL)分子分别装载在G5.NH2的疏水空腔内部,然后再通过共价键法连接G2.5.COOH壳层[48]。合成的CSTDs载药体系对癌细胞杀伤效果明显高于单独药物或单独CSTDs,而且在一定的MTX浓度下(如50 μmol/L),合成的CSTDs载药体系可以在不损伤角质形成细胞的前提下显著抑制Sk-Mel-28细胞的生长。
在基于主客体自组装合成的CSTDs应用于药物输送和癌症化疗方面,我们发现具有pH 响应性的乙酰基G5.NHAc-CD/BM-G3.NHAc CSTDs 可用于抗癌药物阿霉素(DOX)的递送。在这项研究中[51],每个G5.NHAc-CD/BM-G3.NHAc CSTD平均可负载9.2个DOX分子,载药效率达82.76%;更重要的是,所形成的CSTD/DOX复合物可被癌细胞吞噬并在酸性条件下解离形成单代树状大分子,从而达到酸响应条件下DOX快速释放的目的。我们还通过 3D 细胞球实验体外评估了CSTDs/DOX复合物的药物渗透能力和肿瘤治疗效果。与pH不敏感的CSTD/DOX(即 G5.NHAc-CD/Ad-G3.NHAc/DOX)复合物相比,pH敏感的CSTD/DOX复合物表现出相对较强的肿瘤渗透能力(图4a~b)和肿瘤生长抑制能力(图4c~d)。
3.3 基因递送和联合治疗
带正电荷的树状大分子常通过静电压缩作用与核酸形成复合物,从而实现高效的基因递送。因此,氨基封端的CSTDs也可被用作基因递送载体。例如,Chen等[25]将G5-CD/Ad-G3 CSTDs作为纳米载体通过静电压缩作用递送质粒DNA(pDNA)。结果表明,所构建的G5-CD/Ad-G3 CSTDs对编码荧光素酶(luciferase,Luc)质粒DNA(pDNA)的转染效率分别是单独G3-Ad和G5-CD转染效率的170倍和20倍,原因可能是由于分子体积的增大和电荷/质量比的降低,使得pDNA能够被有效地压缩以增强基因递送。在最近的一项研究中,Wang等[49]构建了具有不同刚性内核的两种氨基封端的CSTDs,以探索分子刚性对基因递送效率的影响。在这项研究中,一方面以具有刚性分子骨架、表面为醛基的含磷第2.5代(P-G2.5)树状大分子为核,以表面为氨基的G3 PAMAM树状大分子为壳,通过化学键合法形成P-G2.5/G3 CSTDs;另一方面以Ad修饰的G3(G3-Ad)为壳和β-CD修饰的G3 (G3-CD)为核,通过超分子主客体自组装合成具有柔性内核的G3-CD/Ad-G3 CSTDs。这两种CSTDs表面基团均为氨基,可以用来压缩质粒DNA (pDNA) 形成载体/基因复合物。研究结果表明,具有刚性内核的P-G2.5/G3 CSTDs显示出更好的基因压缩能力和更强的细胞摄取。更重要的是,P-G2.5/G3 CSTDs对编码增强型绿色荧光蛋白(EGFP)和Luc pDNA 的转染效率分别是G3-CD/Ad-G3 CSTDs转染效率的1.7倍和4.1倍。

图4 用G5.NHAc-CD/BM-G3.NHAc/DOX、G5.NHAc-CD/Ad-G3.NHAc/DOX 或 free DOX孵育HeLa 3D细胞球不同时间后的细胞球荧光成像图(a)及其荧光强度分布统计图(b),其中,比例尺为100 μm;用PBS、G5.NHAc-CD/BM-G3.NHAc/DOX、G5.NHAc-CD/Ad-G3.NHAc/DOX或 free DOX孵育HeLa 3D细胞球不同时间后的细胞球治疗图(c)及其直径变化统计图(d),其中,比例尺为100 μm[51]
CSTDs也被用于功能性基因和抗癌药物的胞内共传递,即将CSTDs作为载体,物理包裹抗癌药物DOX,并通过静电压缩miR-21抑制剂(miR-21i),用于体外三阴性乳腺癌细胞(MDA-MB-231)的化疗/基因治疗的联合治疗[50]。在这项研究中,首先对G5-CD/Ad-G3 CSTDs在MDA-MB-231细胞中的功能性基因转染能力进行了探索。结果显示,当氮磷比为10时,CSTDs转染miR-21i的效果最佳,而且G5-CD/Ad-G3/miR-21i复合物(N/P=10)能够显著抑制癌细胞的迁移(图5a~b),显著调节相关靶基因、凋亡基因的表达(图5c~d)。如果在G5-CD/Ad-G3 CSTDs中负载了DOX,然后在N/P=10的条件下进行miR-21i的压缩,即可实现基因和药物的共递送,得到了比仅负载药物的CSTDs/DOX复合物更好的体外癌细胞杀伤效果。
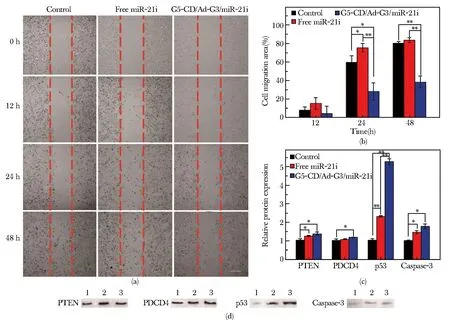
图5 用CSTDs/miR-21i复合物转染MDA-MB-231 细胞0、12、24 和 48 h后的刮伤愈合试验图(a)和迁移区域统计图(b);用PBS、miR-21i或 CSTDs/miR-21i转染细胞后蛋白质定量分析图(c)及其印迹图(d)。1代表对照组;2代表miR-21i组;3代表CSTDs/miR-21i 复合物组[50]
4 结论
CSTDs主要是通过共价键形成和超分子自组装这两种方式合成。与单代的树状大分子相比,CSTDs不但拥有更高的分子量和更大的内部空腔,电荷/质量比降低,而且还可实现环境响应性,对于探索或扩大CSTDs的生物医学应用具有重要意义。近年来,基于CSTDs的纳米平台已被应用于生物医学领域,特别是荧光成像、MR成像、双模态成像以及基因递送、化疗或是化疗/基因治疗的联合治疗等。虽然CSTDs的合成和生物医学应用已初见成效,但仍有待更多的研究。一方面,应开发更多反应类型或组装策略以合成多样的CSTDs;另一方面,可基于CSTDs自身性质,结合不同的治疗/成像元素,扩展CSTDs在纳米医学领域的应用。总之,CSTDs的合成方法及其在分子成像、靶向药物传递、肿瘤诊疗或其他疾病诊疗方面的应用研究极具广阔的应用前景,是一个值得探索的开放式研究领域。
