山奈酚的优化提取及生化性质
2022-01-21王璐瑶付学奇赵婉竹郝婧玮王新颖纪秋研
张 蕾, 王璐瑶, 付学奇, 赵婉竹, 郝婧玮, 王新颖, 纪秋研
(1. 牡丹江师范学院 生命科学与技术学院, 黑龙江 牡丹江157011; 2. 吉林大学 生命科学学院, 长春130012; 3. 新疆医科大学 公共卫生学院, 乌鲁木齐830017)
山奈酚是一种广泛存在于多种植物中的多醇羟基黄酮类化合物[1]. 研究表明, 山奈酚具有抗癌、 抗氧化、 抗炎症反应等多种药理学活性[2-5]. 与大多数类黄酮一样, 山奈酚通常以多种糖苷形式存在, 而不是以游离苷元的形式存在. 只有以苷元形式存在的黄酮才能直接进入血液, 发挥多种生理作用, 糖苷经酸水解后形成苷元可显著提高山奈酚的提取率[6]. 酸水解是一种有机分子被水分解的化学反应, 酸作为催化剂将糖苷水解成苷元[7-8], 可将以结合苷形式存在的山奈酚解离. 本文通过酸水解方法将共轭键结合的山奈酚解离, 从而提高山奈酚的提取率. 但酸浓度太高山奈酚的提取率反而降低, 可能是由于较高的酸浓度下黄酮类化合物易发生降解所致[9].
研究表明, 植物活性成分的抗氧化作用可能与黄酮含量相关[10-11]. 自然界中富含黄酮类化合物的食物有益于人体健康, 其中抗氧化作用较显著[1]. 山奈酚是一种以黄酮为母核的化合物, 其抗氧化功能可能与分子结构中两大抗氧化药效基团酚羟基相关, 并与其羟基可提供电子的能力有关[12]. 超氧阴离子(·O2-) 自由基是需氧细胞线粒体内电子转移而产生的一种自由基, 在生物体内可长时间攻击靶向目标, 对细胞有较强的氧化毒性, 与人体衰老及癌症等疾病的发生有关. 1,1-二苯基-2-三硝基苯肼(DPPH·)自由基是一种在N—N键上含有不对称价电子的氮族自由基, 是用天然多糖抗氧化成分研究抗氧化活性的一种常用评价方法[13-14]. 山奈酚具有一定的抗氧化作用, 可清除·O2-自由基[15]、 DPPH·自由基和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基等[16-17]. 王锐等[18]采用综合碘量法和DPPH法研究表明, 山奈酚的乙酸乙酯提取物和正丁醇提取物具有良好的抗氧化活性, 山奈酚可通过抑制CAT、 GSH-Px和谷胱甘肽-S-转移酶等抗氧化酶的表达降低由酒精和多不饱和脂肪酸导致小鼠肝组织的氧化应激反应[19]. Rajendran等[15]对小鼠体内抗氧化酶进行测定的结果表明, 山奈酚对抗氧化酶的含量具有调节作用. 本文通过响应面方法(RSM)优化提取辣木籽中山奈酚的提取条件, 并研究其清除·O2-自由基和DPPH·自由基的效果, 为山奈酚药用价值的开发利用提供理论基础.
1 材料与方法
1.1 材料和仪器
山奈酚标准品购自上海源叶公司; 乙醇、 盐酸、 硫酸购自国药化学试剂有限公司; 色谱甲醇购自美国默克公司. 高效液相色谱仪(Waters 2695型, 美国Waters公司); 紫外可见分光光度计(L3S型, 上海仪电分析仪器有限公司).
1.2 色谱条件
用甲醇(溶剂A,φ=55%)和体积分数为0.2%的磷酸(溶剂B,φ=45%)作为流动相进行高效液相色谱分析. 流速为1.0 mL/min, 柱温为35 ℃, 进样量为20 μL, 检测波长为370 nm. 所得校准曲线公式为y=66 924x-20 981(R2=0.999 9).
1.3 游离态和结合态山奈酚的提取
将干燥的辣木籽1 105 g粉碎后, 分次放入1 L圆底烧瓶中, 加入体积分数为60%的甲醇回流, 按固液比(m(固)∶V(液))=1∶7进行提取, 60 ℃水浴中回流1 h, 反复提取2次, 合并提取液经旋转蒸发后得辣木籽浸膏, 并称质量.
1.4 响应面法优化超声辅助提取方法
分别采用不同硫酸或盐酸浓度(0,1×10-3,5×10-3,0.01,0.05,0.1,0.2,0.4,0.8 mmol/L)、 固液比(1∶5,1∶10,1∶50,1∶100,1∶200)和提取时间(5,10,20,30,40,50,60 min)进行单因素实验. 以山奈酚的提取率为衡量指标, 确定响应面的实验条件.
利用Box-Behnken数据处理软件, 采用RSM方法分析优化条件间的交互作用[20]. 基于单因素实验结果, 将提取温度设定为60 ℃, 选择盐酸浓度、 提取时间和固液比3个影响因素, 考察山奈酚的提取率, 对其提取条件进行优化.
1.5 抗氧化效果
1.5.1 ·O2-自由基清除法
根据文献[21-22]对邻苯三酚自氧化速率进行测定及不同浓度山奈酚(10,50,100,200,500 μmol/L)和维生素C(Vc, 5 mmol/L)对·O2-自由基进行测定, 并计算清除率.
1.5.2 DPPH·自由基清除法
采用DPPH·自由基测定方法[21-22], 分别计算浓度为10,50,100,200,500 μmol/L的山奈酚溶液及Vc(5 mmol/L)对DPPH·自由基的清除率.
2 结果与讨论
2.1 山奈酚提取单因素实验
不同条件下各单因素对山奈酚提取率的影响如图1所示.
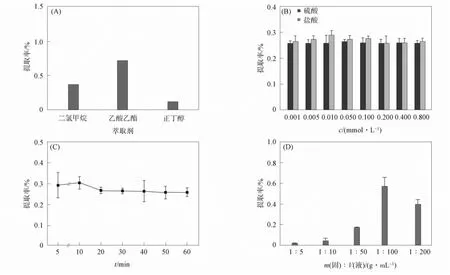
图1 单因素实验结果Fig.1 Single factor experimental results
2.1.1 不同萃取剂和盐酸浓度对山奈酚提取率的影响
由图1(A)可见, 当萃取溶剂为乙酸乙酯,V(乙酸乙酯)∶V(甲醇)=1∶1, 温度为60 ℃时, 提取效果最佳. 由图1(B)可见: 当盐酸浓度为5×10-3~0.05 mol/L时, 山奈酚提取率较高; 当硫酸浓度较高时, 山奈酚提取率显著降低; 不同浓度盐酸溶液中山奈酚的提取率均高于在硫酸溶液中的提取率. 因此, 确定盐酸最佳浓度为0.01 mmol/L.
2.1.2 提取时间对山奈酚提取率的影响
选择提取时间分别为5,10,20,30,40,50,60 min, 结果如图1(C)所示. 由图1(C)可见: 当提取时间小于5 min时, 山奈酚的提取率较低, 可能是因为未给溶剂提供足够的时间渗透到辣木籽中所致; 当提取时间大于20 min时, 提取率呈下降趋势. 因此, 确定最佳提取时间为10 min.
2.1.3 固液比对山奈酚提取率的影响
原料与溶剂的比例是决定萃取效率的一个关键因素. 较大的溶剂体积可提高萃取效率, 但体积过大会导致萃取过程复杂. 由图1(D)可见, 当固液比为1∶50~1∶100时, 山奈酚的提取率显著提高, 这可能是因为当固液比小于1∶50时, 提取物的黏度过大, 阻碍了山奈酚的有效提取. 因此, 确定最佳固液比为1∶100.
2.2 响应面法优化结果
以盐酸浓度、 固液比和提取时间为3个变量因素, 山奈酚提取率为实验指标, 进行如表1所示的随机化实验. 共进行17次实验, 5次重复(运行3,4,8,12,17次)用于估计纯误差平方和.

表1 Box-Behnken设计
回归方程的可信度分析列于表2. 由表2可见, 预测的R2=0.170 4, 与调整后的R2=0.790 6相符, 精度比为7.294. 两个响应的回归系数显著性检验结果列于表3. 由表3可见, 模型具有较高的F值和较低的P值, 表明该值由噪声导致的概率仅为0.01%. 由于任何小于0.050 0的F值均为显著的, 大于0.1则为不显著, 因此, 模型中的A,B,C,AB,AC,BC,A2,B2,C2是显著的. 得到的回归方程为
提取率=(1.1+6.8×10-2A+2.6×10-2B+9.8×10-2C-5.4×10-2AB-
4.3×10-2AC+0.05BC-0.23A2-0.29B2-2.9×10-2C2)%,
(1)
其中A为盐酸浓度, B为提取时间, C为固液比.

表2 回归方程的可信度分析
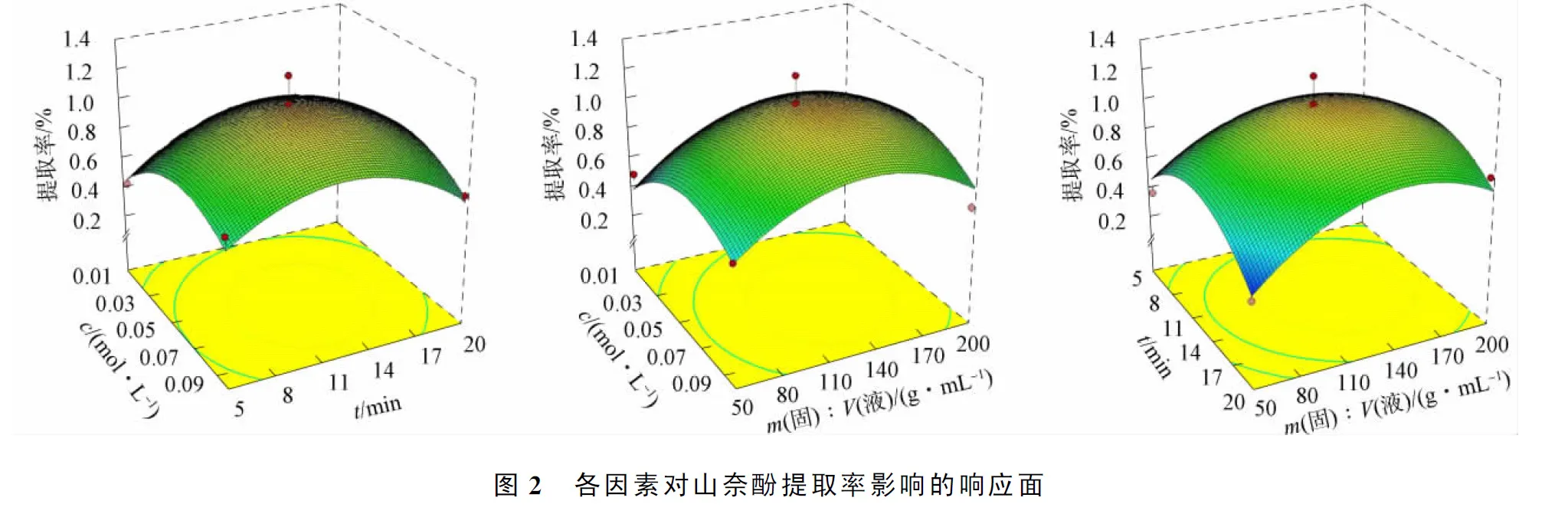
三维响应面是回归方程的图形表现, 可预测检验变量和响应值与各变量水平间的相互作用关系[23-24]. 图2为响应值对应各影响因素对山奈酚提取率的影响. 基于Desigh-Expert软件分析, 预测最佳提取工艺为: 盐酸浓度6.1×10-2mmol/L, 提取时间12.87 min, 固液比1∶137.46, 提取率可达1.11%.
2.3 山奈酚对·O2-自由基和DPPH·自由基的清除能力
在碱性条件下, 邻苯三酚可通过发生自氧化链式反应释放超氧阴离子, 同时超氧阴离子进一步加速邻苯三酚发生氧化反应, 生成一系列中间产物. 通过在反应体系中加入抗氧化物质以降低邻苯三酚自氧化速率, 达到清除产生的超氧阴离子的作用, 抑制中间产物生成, 使反应溶液的吸光度减小[21]. 不同浓度的山奈酚提取物对·O2-自由基的清除率如图3所示. 由图3可见: 10 μmol/L山奈酚对·O2-自由基的清除率为4.8%, 200 μmol/L山奈酚对·O2-自由基的清除率为26.1%, 且具有剂量依赖性; 阳性对照Vc的清除能力最强为58.3%, 可见低浓度的山奈酚对·O2-自由基的清除率较低.
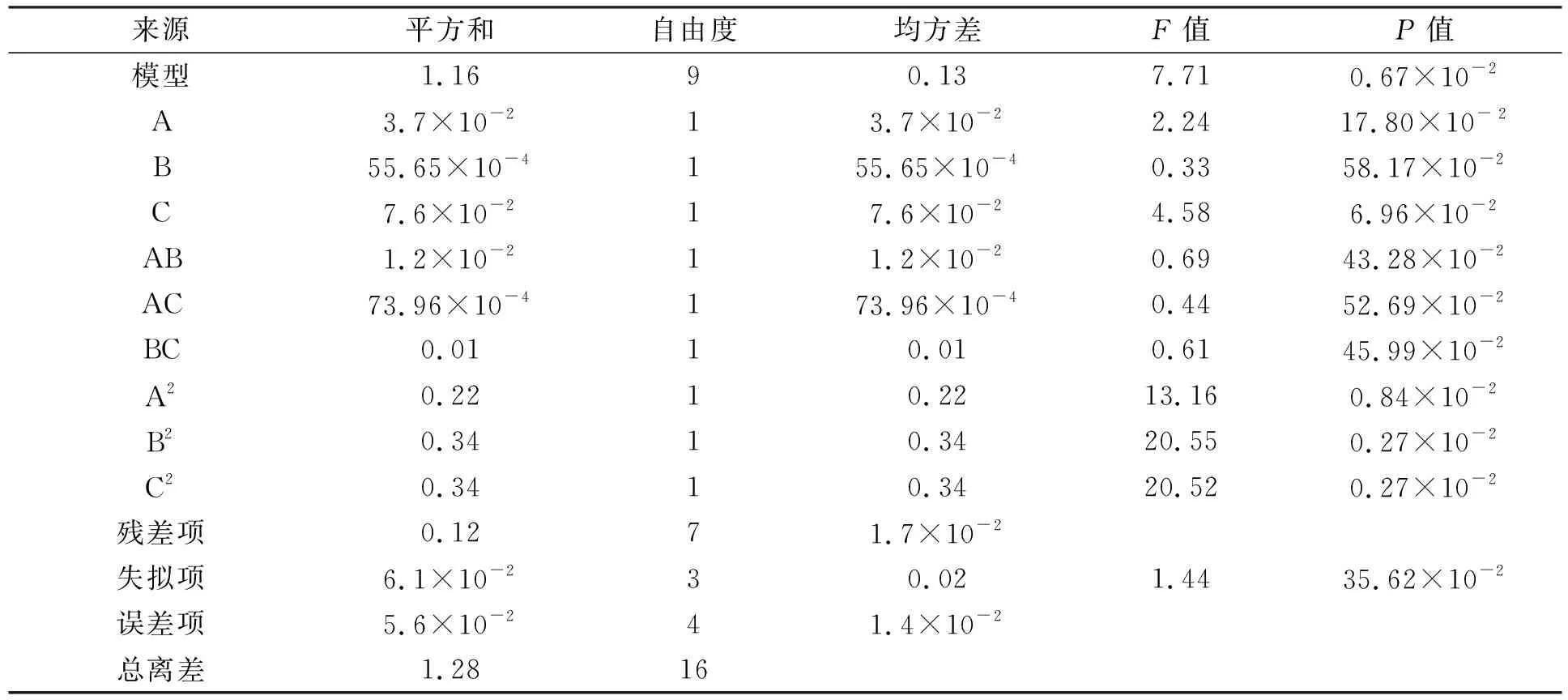
表3 回归系数显著性检验
山奈酚对DPPH·自由基的清除是通过待测物质给出的氢原子与DPPH·自由基结合, 从而改变溶液的吸光度. 不同浓度的山奈酚对DPPH·自由基的清除率如图4所示. 由图4可见, 10 μmol/L山奈酚对DPPH·自由基的清除率为38.8%, 且随着山奈酚浓度的提高, 其对DPPH·自由基清除率也升高.

综上所述, 本文通过双相酸水解法优化了山奈酚的提取条件, 通过单因素实验考察酸浓度、 提取时间和固液比对山奈酚提取率的影响, 并利用响应面Box-Behnken实验得到山奈酚提取的最佳工艺条件为: 盐酸浓度6.1×10-2mmol/L, 提取时间12.87 min, 固液比1∶137.46, 该条件下山奈酚的提取率可达1.11%. 本文中山奈酚对·O2-自由基和DPPH·自由基均有一定的清除作用, 且呈剂量依赖, 其中对DPPH·自由基的清除能力较强, 10 μmol/L 的山奈酚对DPPH·自由基清除率为38.8%.
