饲料中添加鸡肠粉对鲤抗氧化及部分免疫酶活力的影响
2022-01-20彭祖想严林卫力博翟浩杰高欣王伟任同军韩雨哲
彭祖想 严林 卫力博 翟浩杰 高欣 王伟 任同军 韩雨哲

摘 要:为研究饲料中添加鸡肠粉对鲤(Cyprinus carpio)抗氧化能力和部分免疫酶活力的影响,配制了4组等氮等脂饲料和1组鸡肠粉含量为100%的饲料,标记为D1、D2、D3、D4、D5。鸡肠粉添加量分别为0%(D1)、5%(D2)、10%(D3)、15%(D4)和100%(D5)。选取初始体重约为57 g的鲤150尾,随机分为5组,进行为期8周的养殖试验。结果表明:饲料中添加鸡肠粉能够提高鲤肝脏总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)和过氧化氢酶(CAT)活力,且呈现先增加后降低趋势。D3、D4、D5组T-AOC和CAT活性显著高于D1和D2组(P<0.05);D2、D3、D4、D5组T-SOD活力显著高于D1组(P<0.05);D2、D3和D4组丙二醛(MDA)含量显著低于D1和D5组(P<0.05)。随着饲料中鸡肠粉添加水平的升高,鲤肝脏酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和溶菌酶(LZM)活力呈现先升高后下降的趋势。D3、D4和D5组ACP活力显著高于D1、D2组(P<0.05),D3和D4组AKP活力显著高于D1、D2和D5组(P<0.05);D4组LZM活力显著高于D1、D2组(P<0.05),鲤肝脏ACP、AKP和LZM活力均在D4组达到峰值。研究表明,饲料中添加鸡肠粉能够提高鲤肝脏抗氧化能力和部分免疫酶活力,添加量为15%时效果最好。
关键词:鸡肠粉;鲤(Cyprinus carpio);抗氧化能力;免疫酶活力
家禽副产品粉(poultry by-product meal,PBM)是家禽屠宰之后的下脚料,经冲洗、蒸煮、干燥、提炼油脂和粉碎等工序后得到的粉状产品,在营养组成上与鱼粉相似且价格低廉,与植物性蛋白源相比不含抗营养因子,因此被认作是一种优质的动物蛋白[1]。家禽副产品粉粗蛋白含量为58%~65%,粗脂肪含量在12%~15%之间,其质量通常取决于原料质量和加工工艺[2]。已有研究表明,家禽副产品粉可作为鱼类日粮中蛋白质来源并能不同程度地替代鱼粉,如黄颡鱼(Pelteobagrus fulvidraco)[3]、草鱼(Ctenopharyngodon idella)[4]、鲇(Clarias batrachus)[5]、驼背鲈(Cromileptes altivelis)[6]、点带石斑鱼(Epinephelus coioides)[7]、银鲫(Carassius auratus gibelio)[8]等。雞肠粉是家禽副产品粉的一种,是以新鲜鸡肠为原料,经冲洗、蒸煮、喷雾干燥和粉碎等工序加工而成的新型优质饲料蛋白源。优质的鸡肠粉粗蛋白和粗脂肪含量与鱼粉接近,部分氨基酸含量甚至高于鱼粉,从营养成分及氨基酸组成分析,鸡肠粉是一种很有潜力的优质动物蛋白源[4],但目前国内尚未有关于鸡肠粉应用于鱼类的相关报道。
本试验基于鲤营养研究基础,探究饲料中添加鸡肠粉对鲤抗氧化及部分免疫酶活力的影响,以期为鸡肠粉在淡水鱼饲料中的应用提供理论依据。
1 材料方法
1.1 试验设计和管理
养殖试验在大连海洋大学辽宁省北方鱼类应用生物学及增养殖重点实验室循环水池内进行,试验所用鲤购于辽宁省丹东市景波养殖场。选取当年繁殖的初始体重为57 g左右的鲤200尾,于4.3 m×1.5 m×1.2 m的水泥池中暂养一周以适应试验环境,暂养期间投喂对照组饲料。暂养后选取体重大小相近、活力较好、体表无伤的鲤150尾,随机分为5组,每组3个平行,每个平行10尾,置于15个规格为1.3 m×0.8 m×0.7 m的聚乙烯网箱中。以曝气24 h以上的自来水作为试验用水,采用空气压缩泵和气石进行24 h 充气。每日08:00和16:00表观饱食投喂两次,每日吸底1次、换水1次,换水量约为1/2。试验期间水温(26.0±1.0)℃,溶氧为(6.0±0.5)mg/L,pH值为7.2±0.5,养殖周期为8周。
1.2 试验饲料
鸡肠粉由辽宁省鞍山裕丰饲料有限公司提供,含粗蛋白65.47%、粗脂肪14.80%。试验饲料原料购自于大连贝西商贸有限公司。试验饲料配方见表1,以鱼粉、鸡肠粉、豆粕等为主要蛋白源,以豆油为主要脂肪源,配制4组等氮等脂饲料和1组鸡肠粉含量为100%的饲料,分别标记为D1、D2、D3、D4、D5。鸡肠粉添加量分别为0%(D1)、5%(D2)、10%(D3)、15%(D4)和100%(D5),饲料原料过80目筛,混合均匀后经制粒机制成2 mm的颗粒饲料,放入42 ℃烘箱中,烘干至水分含量为10%,放入自封袋中于-20 ℃冰箱中保存。
1.3 样品采集及指标测定
取样前,试验鱼停食 24 h,使用50 mg/L的MS-222溶液麻醉,于冰上进行无菌解剖。每个平行6尾鱼全部取肝脏同组混样装管,样品于-80 ℃保存待测。肝脏样品注入质量体积比1∶9的生理盐水,经4 ℃、4 000 r/min、10 min高速离心后,取上清液,用于测定肝脏抗氧化指标和部分免疫酶活力的测定。
总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活力、丙二醛(MDA)含量、肝脏酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和溶菌酶活力(LZM)均采用南京建成生物工程研究所试剂盒进行测定。
1.4 数据处理
试验数据用平均值±标准误(mean ± standard error,SE)表示,采用GraphPad Prism 软件作图,采用 SPSS 25.0 软件(IBM,USA)进行单因素方差分析(one-way ANOVA),并用 Duncan’s 进行多重比较来分析各处理组间的显著性,设置P<0.05 为差异显著。
2 结果
2.1 饲料中添加鸡肠粉对鲤肝脏抗氧化指标的影响
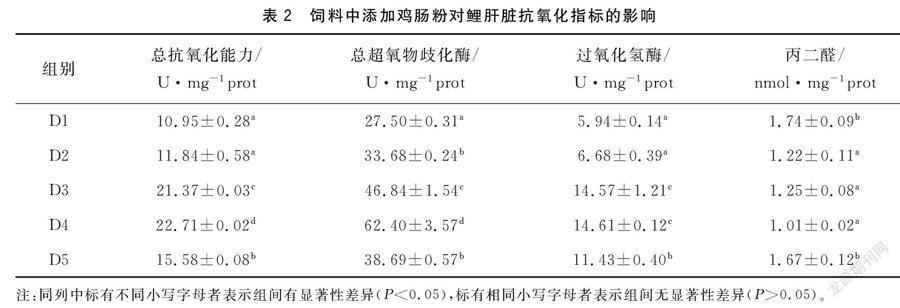
由表2可知饲料中添加鸡肠粉能够提高鲤肝脏T-AOC、T-SOD和CAT活性,且呈现先增加后降低趋势。D3、D4、D5组T-AOC和CAT活性显著高于D1和D2组(P<0.05);D2、D3、D4、D5组T-SOD活力显著高于D1组(P<0.05);D2、D3和D4组MDA含量显著低于D1和D5组(P<0.05)。
2.2 饲料中添加鸡肠粉对鲤肝脏免疫酶活力的影响
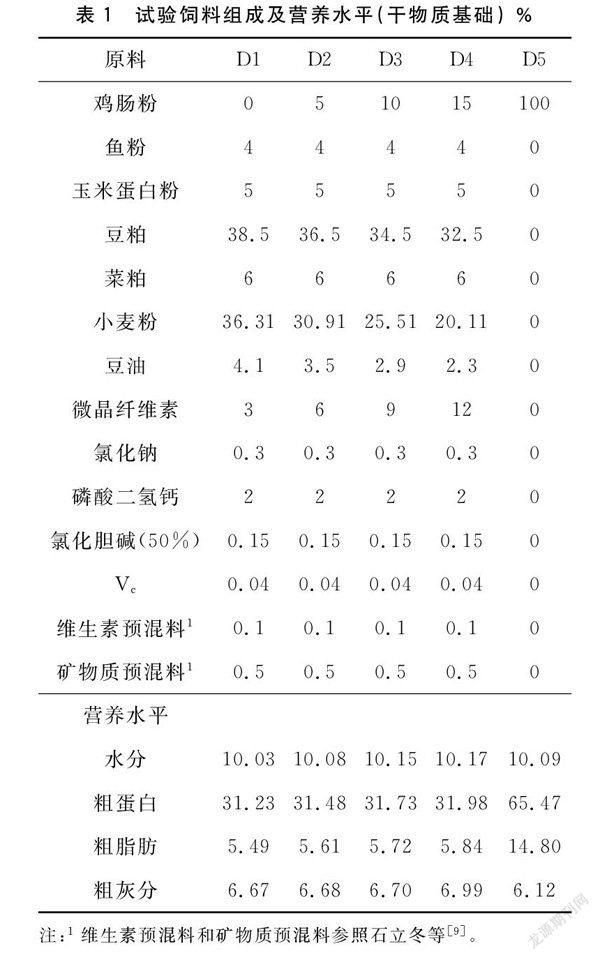
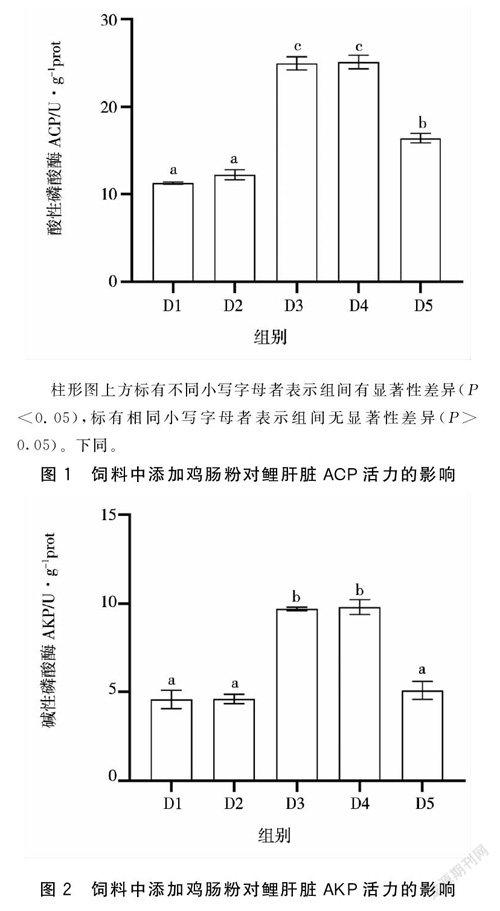
饲料中鸡肠粉添加水平对鲤肝脏ACP、AKP和LZM活力有显著影响(P<0.05),随着饲料中鸡肠粉添加水平的升高,鲤肝脏ACP、AKP和LZM活力呈现先升高后下降的趋势。D3、D4和D5组ACP活力显著高于D1和D2组(P<0.05),D3和D4组AKP活力显著高于D1、D2和D5组(P<0.05),D4组LZM活力显著高于D1、D2组(P<0.05),鲤肝脏ACP、AKP和LZM活力均在D4组达到峰值。见图1—图3。
柱形图上方标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05)。下同。图1 饲料中添加鸡肠粉对鲤肝脏ACP活力的影响
3 讨论与结论
3.1 饲料中鸡肠粉添加水平对鲤肝脏抗氧化指标的影响
抗氧化系统在生物体内普遍存在,是机体防御超氧基损伤的主要防御性系统[10]。机体在正常代谢时会产生大量的氧化自由基,这些自由基会对机体产生损伤,诱发多种慢性疾病,但抗氧化酶防御系统能够清除这些自由基。抗氧化酶防御系统主要包括SOD、CAT和GSH等,机体组织损伤程度就是自由基与抗氧化保护防御平衡的结果[11]。总抗氧化能力是用于评价动物机体抗氧化系统功能的综合性指标,SOD和CAT是衡量机体抗氧化能力的重要指标,MDA是脂质过氧化作用的分解产物,可以间接反映细胞损伤程度[12]。目前有关家禽副产品粉对水产动物抗氧化性能的影响主要集中在饲料蛋白源替代方面,贾倩[13]研究结果表明,随着禽肉骨粉替代鱼粉比例增加,大菱鲆(Scophthalmus maximus)肝脏SOD活力和CAT活力均呈上升趋势,在替代比例为50%时达到峰值,与对照组差异显著。Siddik等[14]在尖吻鲈(Lates calcarifer)基础日粮中添加发酵后的PBM和鱼蛋白水解物混合物,发现可以显著提高尖吻鲈谷胱甘肽过氧化物酶活力。但PBM替代魚粉对水产动物抗氧化性的研究结果并不一致,黄庆文等[15]发现,不同比例的PBM替代鱼粉对草鱼T-SOD活力、MDA水平和T-AOC无显著影响。易新文等[16]发现,随着PBM替代鱼粉比例的增加,卵形鲳鲹(Trachinotus ovatus)肝脏中SOD和CAT活力呈下降趋势,卵形鲳鲹的抗氧化能力降低。罗嘉翔等[3]研究表明,饲料中适量的鸡肉粉替代鱼粉能够提高黄颡鱼的抗氧化酶活力,但过高的替代比例会导致机体脂肪氧化。本试验研究结果表明,饲料中添加鸡肠粉能够提高鲤肝脏T-AOC、T-SOD和CAT活力,降低MDA含量,在饲料中鸡肠粉添加水平为15%时(D4组),鲤肝脏T-AOC、T-SOD和CAT活力最高且均显著高于对照组(P<0.05),MDA含量最低且显著低于对照组(P<0.05)。在鸡肠粉添加水平为100%(D5组)时鲤肝脏T-AOC、T-SOD和CAT活力也均显著高于对照组(P<0.05),但显著低于D4组。这表明饲料中添加5%~15%和100%鸡肠粉均能够提高鲤肝脏抗氧化能力,但以添加量为15%时效果最好。研究表明优质的PBM赖氨酸含量较高[17],适宜的赖氨酸水平能够提高水产动物的抗氧化性,而过高则会抑制[18],这很有可能就是鲤肝脏T-AOC、T-SOD和CAT活力先增加后降低的原因。
3.2 饲料中鸡肠粉添加水平对鲤肝脏免疫酶活力的影响
鱼类的非特异性免疫系统在鱼类抵抗病原入侵时发挥着极其重要的作用,AKP、ACP和LZM就是其中重要的抗菌蛋白,其活力是反映机体非特异性免疫力的重要指标[19]。Dawood等[20]发现在饲料添加5%、10%和15%经发酵后的PBM能够显著提高鲤LZM活力;同样的在尼罗罗非鱼(Oreochromis niloticus)日粮中添加10%和20%的经发酵后的PBM也能够显著提高鱼体LZM活力和血清中lgM水平[21]。本试验研究结果表明饲料中鸡肠粉添加水平对鲤肝脏ACP、AKP和LZM活力有显著影响,随着饲料中鸡肠粉添加水平的升高,鲤肝脏ACP、AKP和LZM活力呈现先升高后下降的趋势。有研究发现适量的赖氨酸能够增强水产动物免疫力,过高则会抑制[22]。以上结果很可能也是由于赖氨酸的缘故,随着鸡肠粉添加量的增加,饲料中赖氨酸含量逐渐增加,增强了鲤肝脏免疫酶活力;鸡肠粉添加量为100%时赖氨酸含量过高,反而起到了抑制作用。本试验中D3、D4和D5组ACP活力显著高于D1和D2组,D3和D4组AKP活力显著高于D1、D2和D5组,D4组LZM活力显著高于D1、D2组,鲤肝脏ACP、AKP和LZM活力均在鸡肠粉添加量为15%(D4组)时达到峰值,说明饲料中添加鸡肠粉可以增强鲤非特异性免疫能力,且15%的添加量效果最好。
本试验结果表明,饲料中添加鸡肠粉能够提高鲤肝脏抗氧化能力和部分免疫酶活力,最适添加量为15%。
参考文献:
[1] THOMPSON K R, METTS L S, MUZINIC L A, et al. Use of turkey meal as a replacement for menhaden fish meal in practical diets for sunshine bass grown in cages[J]. North American Journal of Aquaculture, 2007, 69(4): 351-359.
[2] HILL J C, ALAM M S,WATANABE W O, et al. Replacement of menhaden fish meal by poultry by‐product meal in the diet of juvenile red porgy, Pagrus pagrus[J]. North American Journal of Aquaculture, 2019, 81(1): 81-93.
[3] 罗嘉翔,黄文文,袁野,等.鸡肉粉替代鱼粉对黄颡鱼幼鱼生长性能、饲料利用、消化酶活性及抗氧化能力的影响[J].动物营养学报, 2017, 29(11):3970-3979.
[4] TABINDA A B, BUTT A.Replacement of fish meal with poultry by-product meal (chicken intestine) as a protein source in grass carp fry diet[J]. Pakistan Journal of Zoology, 2012, 44(5): 1373-1381.
[5] GIRI S S, SAHOO S K, MOHANTY S N. Replacement of by-catch fishmeal with dried chicken viscera meal in extruded feeds: effect on growth, nutrient utilisation and carcass composition of catfish Clarias batrachus (Linn.) fingerlings[J]. Aquaculture international, 2010, 18(4): 539-544.
[6] SHAPAWI R, NG W K, MUSTAFA S. Replacement of fish meal with poultry by-product meal in diets formulated for the humpback grouper, Cromileptes altivelis[J].Aquaculture, 2007, 273(1): 118-126.
[7] 付闰吉,纪文秀,王岩,等.利用畜禽加工副产品替代点带石斑鱼饲料中的鱼粉[J].浙江大学学报:农业与生命科学版, 2011, 37(6): 663-669.
[8] YANG Y,XIE S,CUI Y, et al.Partial and total replacement of fishmeal with poultry by-product meal in diets for gibel carp,Carassius auratus gibelio Bloch[J].Aquaculture research, 2006, 37(1): 40-48.
[9] 石立冬,卫力博,翟浩杰,等.不同蛋白源饲料中添加限制性氨基酸对红鲫Carassius auratus生长、消化及免疫能力的影响[J].水产学杂志, 2021, 34(2):56-64.
[10] 唐雪莲,付京花,李志华,等.紫锥菊提取物对彭泽鲫生长和抗氧化反应的影响[J].饲料工业,2012, 33(14): 21-22.
[11] MACHLIN L J,BENDICH A.Free radical tissue damage: protective role of antioxidant nutrients[J].The FASEB journal, 1987, 1(6): 441-445.
[12] LIN C C,LIANG J H.Effect of antioxidants on the oxidative stability of chicken breast meat in a dispersion system[J].Journal of Food Science, 2002, 67(2): 530-533.
[13] 贾倩.禽肉骨粉和玉米蛋白粉替代鱼粉对大菱鲆生长、生物学参数和肠道健康的影响[D].济南:山东大学, 2020.
[14] SIDDIK M A B, CHAKLADER M R, FOYSAL M J, et al.Influence of fish protein hydrolysate produced from industrial residues on antioxidant activity, cytokine expression and gut microbial communities in juvenile barramundi Lates calcarifer[J].Fish & shellfish immunology,2020,97: 465-473.
[15] 黃文庆,黄燕华,米海峰,等.3种动物蛋白质源替代鱼粉对草鱼生长性能、肌肉营养成分、消化酶活性、血清生化和抗氧化指标的影响[J].动物营养学报,2019,31(5):2187-2200.
[16] 易新文, 陈瑞爱, 徐家华.鸡肉粉替代鱼粉对卵形鲳鲹生长、饲料利用和抗氧化力的影响[J].中国海洋大学学报:自然科学版, 2019, 49(12):17-24.
[17] DOZIER W A III,DALE N M,DOVE C R.Nutrient compostion of feed-grade and pet-food-grade poultry by-product meal[J].Journal of applied poultry research,2003,12(4): 526-530.
[18] 李雪吟.赖氨酸对草鱼肠道免疫和结构屏障作用及其机制研究[D].雅安:四川农业大学, 2017.
[19] 何伟聪,董晓慧,谭北平,等.益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响[J].动物营养学报, 2015, 27(12):3821-3830.
[20] DAWOOD M A O, MAGOUZ F I, ESSA M, et al.Impact of yeast fermented poultry by-product meal on growth, digestive enzyme activities, intestinal morphometry and immune response traits of common carp (Cyprinus carpio)[J]. Annals of Animal Science, 2020, 20(3): 939-959.
[21] DAWOOD M A O,MAGOUZ F I,MANSOUR M,et al.Evaluation of yeast fermented poultry by-product meal in Nile tilapia (Oreochromis niloticus) feed: Effects on growth performance, digestive enzymes activity, innate immunity, and antioxidant capacity[J]. Frontiers in veterinary science, 2020, 6: 516.
[22] 李小军.饲料赖氨酸和蛋氨酸对虎龙杂交斑幼鱼生长、饲料利用、肠道形态学和免疫的影响[D].海口:海南大学, 2019.
Effect of dietary chicken intestine meal on antioxidative capability and immune enzyme activities of Cyprinus carpio
PENG Zuxiang1,YAN Lin1,WEI Libo1,ZHAI Haojie1,GAO Xin1,WANG Wei1,2,REN Tongjun1,HAN Yuzhe1,2
(1. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China;
2. Key Laboratory of Fish Applied Biology and Aquaculture in North China, Dalian Ocean University, Dalian 116023, China)
Abstract:An 8-week feeding trial was conducted to evaluate the effects of dietary chicken intestine meal on antioxidative capability and immune enzyme activities of the common carp Cyprinus carpio. Four groups of iso-nitrogenous and iso-fat feeds and one group of feeds with 100% chicken intestinal meal were prepared, labeled D1, D2, D3, D4 and D5, respectively. Chicken intestinal meal within these groups was added at 0%, 5%, 10%, 15% and 100%, respectively. A total of 150 Cyprinus carpio with an initial body weight of 57 g were randomly divided into 5 groups. The results showed that T-AOC, T-SOD and CAT activities of the carp liver increased when chicken intestinal meal was added to the diet, with a trend of increase first and then decrease. The addition of chicken intestinal meal to the diet could increase the T-AOC, T-SOD and CAT activities of the carp liver, and showed a trend of increase first and then decrease.The T-AOC and CAT activities were significantly higher in group D3, D4 and D5 than in group D1 and D2 (P<0.05) ,while T-SOD activities was significantly higher in group D2, D3, D4 and D5 than in group D1 (P<0.05) .The MDA contents of group D2, D3 and D4 were significantly lower than those of group D1 and D5 (P<0.05).The ACP, AKP and LZM activities of the carp liver showed a tendency of increase first and then decrease with the increase of chicken intestinal meal in the diet.The ACP activities of group D3, D4 and D5 were significantly higher than those of group D1 and D2 (P<0.05). AKP activities of group D3 and D4 were significantly higher than those of group D1, D2 and D5(P<0.05). LZM activities were significantly higher in group D4 than in group D1 and D2(P<0.05). The ACP, AKP and LZM activities of the carp liver all reached the peak in group D4. It was shown that the addition of chicken intestinal meal to the diet could improve the antioxidant capacity and some immune enzyme activity of the carp liver, and the best effect was achieved at the addition level of 15%.
Key words:chicken intestinal meal;Cyprinus carpio; antioxidative capability; immune enzyme activities
(收稿日期:2021-08-20;修回日期:2021-10-14)
基金項目:大连市青年科技之星(2019RQ137);大连海洋大学“蔚蓝英才”人才计划项目。
作者简介:彭祖想(1997-),男,在读研究生,研究方向:水产动物营养与饲料学。E-mail: 2503422561@qq.com。
通信作者:韩雨哲(1984-),男,副教授,硕士生导师,研究方向:水产动物营养与饲料学。E-mail: hanyuzhe @dlou.edu.cn。
