新烟碱类杀虫剂吡虫啉和啶虫脒对人神经母细胞瘤SK-N-SH细胞的毒性作用
2022-01-20黄钰婷李敬尧张琪王丹周群芳卢晓霞
黄钰婷,李敬尧,张琪,王丹,周群芳,卢晓霞,*
1. 地表过程分析与模拟教育部重点实验室,北京大学城市与环境学院,北京 100871 2. 中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室,北京 100085
新烟碱类杀虫剂(neonicotinoid insecticide)是一类具有优越杀虫活性的杀虫剂。1985年,德国拜耳公司(Bayer)成功开发出第一种商用新烟碱类杀虫剂吡虫啉(imidacloprid, C9H10ClN5O2)[1]。此后,不断有新的新烟碱类杀虫剂被开发出来,广泛用于农业、景观以及动物身上害虫的防治。目前,新烟碱类杀虫剂是全球杀虫剂中体量最大的品种,全球销售额约为34亿美元,约占全球杀虫剂销售额的20%,其代表产品吡虫啉、噻虫嗪和啶虫脒等凭借其低毒、高效、广谱的特点,在农产品种植领域拥有极大的市场份额。其中,吡虫啉2014年的全球销售额已超过11亿美元,啶虫脒(acetamiprid, C10H11ClN4,1996年由日本曹达株式会社开发出并实现商业化)2014年的全球销售额接近3亿美元[2]。
随着新烟碱类杀虫剂的大量使用,其在环境中的残留对生态安全、粮食安全以及人类健康的潜在影响也引起了学术界的广泛关注。已有研究表明,土壤[3]、水[4]、蔬菜水果[5]、甚至牛奶[6]等物质中都有不同程度的新烟碱类杀虫剂的检出。吕正标[7]测定了中国杭州市自来水样品中新烟碱类杀虫剂的残留情况,发现检出率最高的为吡虫啉(87%),其次为啶虫脒(83%)和噻虫胺(54%),平均残留浓度最高的为啶虫脒(5.8 ng·L-1),其次为吡虫啉(4.0 ng·L-1)和烯啶虫胺(2.5 ng·L-1)。谭颖等[8]研究了中国北京市当地市场蔬菜水果样品中各种新烟碱类杀虫剂的残留情况,发现吡虫啉和啶虫脒的检出率均达100%,浓度均值分别为0.73~1.11 μg·kg-1和1.07~1.55 μg·kg-1。Wang等[9]对中国山东某农村及周边城市的295份人体尿液样本(农村235份,城市60份)中的吡虫啉进行了检测,结果显示农村和城市样本中吡虫啉检出率分别为100%和95%,残留浓度中位数分别为0.16 μg·L-1和0.15 μg·L-1。Chen等[10]检测了中国无锡市120份成人血清样品中的9种新烟碱类杀虫剂的浓度,结果显示吡虫啉检出率为28.3%,噻虫胺为16.7%,噻虫啉为14.2%,啶虫脒为12.5%,浓度范围为32.0~427 pg·mL-1。
新烟碱类杀虫剂是烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor, nAChR)的激动剂,对昆虫有很好的选择性[11]。nAChR通过结合突触前膜释放的神经递质乙酰胆碱(acetylcholine, ACh)发生膜电位去极化,增强对Na+、K+和Ca2+的通透性,从而使信号在细胞之间传递。突触间的乙酰胆碱酯酶可以降解ACh,使神经元恢复到极化状态。新烟碱类杀虫剂如吡虫啉和啶虫脒也可与nAChR结合引起信号传递,但他们不能被乙酰胆碱酯酶降解,使得nAChR不停地受到刺激,冲动传导无法中断,从而扰乱昆虫正常的神经活动,最后导致死亡[12]。
近几年来,一些研究表明吡虫啉和啶虫脒对哺乳动物甚至人类的神经发育有一定的毒性效应。在流行病学研究中,Yang等[13]发现孕妇住处吡虫啉的使用量与胎儿无脑畸形有正相关关系。Keil等[14]发现407个出生前暴露过吡虫啉的儿童得自闭症的概率稍高于262个未暴露的儿童。在体内实验研究中,Bal等[15]发现暴露于浓度>10 mmol·L-1的吡虫啉不到1 min即可损害具有烟碱型乙酰胆碱受体(nAChRs)的小鼠耳蜗核星状细胞的膜特性,如膜电位的显著去极化。在体外实验中,Kimura-Kuroda等[16]以新生大鼠小脑神经元为对象,发现在表达了nAChRsα3、α4、α7亚基mRNA的小脑神经元中,浓度>1 μmol·L-1的吡虫啉和啶虫脒与烟碱一样可引起明显的兴奋性Ca2+内流。
目前关于吡虫啉和啶虫脒等新烟碱类杀虫剂对人的神经毒性效应与机制仍知之甚少。本文以人神经母细胞瘤SK-N-SH细胞为模型,采用体外细胞实验,研究不同浓度吡虫啉和啶虫脒暴露对细胞活力、细胞形态、nAChRsα7亚基的mRNA和蛋白表达、乙酰胆碱酯酶活性以及氧化应激的影响,为这2种杀虫剂的健康风险评价提供依据。
1 材料与方法(Materials and methods)
1.1 细胞和试剂
本实验采用的人神经母细胞瘤SK-N-SH细胞购自中国医学科学院基础医学研究所国家实验细胞资源共享服务平台。吡虫啉(纯度99.82%)和啶虫脒(纯度99.45%)购自美国百灵威科技有限公司,并溶解于经0.22 μm滤膜过滤的二甲基亚砜(DMSO)备用。吡虫啉和啶虫脒的分子结构与理化性质如表1所示。细胞培养过程中使用的DMEM高糖培养基、磷酸盐缓冲液(PBS,不含钙、镁、酚红)购自美国HyClone公司,胎牛血清、双抗混合液(10 000 Units·mL-1青霉素及10 000 μg·mL-1链霉素)以及0.25%胰蛋白酶(含EDTA)购自美国Gibco公司。
1.2 细胞暴露实验
SK-N-SH细胞培养于含10%胎牛血清、1%双抗的DMEM高糖培养基中,于37 ℃、5% CO2条件下培养24 h,选取对数生长期细胞进行实验。
在细胞活力测试中,将对数生长期的SK-N-SH细胞按照5×105个·mL-1的密度,在96孔板中每孔均匀铺200 μL,置于培养箱(37 ℃、5% CO2)内,贴壁生长24 h,之后弃去旧培养基,用PBS缓冲液清洗细胞一次,然后每孔加入200 μL加药培养基在培养箱内暴露24 h。吡虫啉和啶虫咪的暴露浓度分别设置了7个水平(0.6、1.2、1.5、2.0、2.5、3.0和3.5 mmol·L-1)和11个水平(0.1、0.2、0.4、0.6、0.8、1.0、2.0、4.0、6.0、8.0和10.0 mmol·L-1),同时设置了一个溶剂对照(0.1% DMSO)。每组设置5个平行。
在细胞形态、nAChRsα7亚基的mRNA和蛋白表达、乙酰胆碱酯酶活性和氧化应激测试中,将对数生长期的SK-N-SH细胞按照5×105个·mL-1的密度,在六孔板中每孔均匀铺3 mL,置于培养箱(37 ℃、5% CO2)内,贴壁生长24 h,之后弃去旧培养基,用PBS缓冲液清洗细胞一次,然后每孔加入3 mL加药培养基在培养箱内暴露24 h。吡虫啉和啶虫咪的暴露浓度分别设置了3个水平(0.01、0.1和1.0 mmol·L-1),同时设置了一个溶剂对照(0.1% DMSO)。每组设置3个平行。暴露浓度的设置基于细胞活力实验,并参考相关文献[18-19]。
1.3 细胞指标测定
1.3.1 细胞活力测定
细胞活力测定使用Alamar Blue检测试剂盒(美国Thermo Fisher Scientific公司)。细胞暴露完成后,弃去100 μL培养基,然后每孔加入10 μL Alamar Blue检测试剂,在培养箱(37 ℃、5% CO2)内避光孵育4~6 h,待培养基的颜色由靛青蓝开始变成粉红色时,测定每孔在530 nm激发光激发条件下激发出的590 nm发射光的强度,此光强值与每孔中的活性细胞数成正比。根据暴露组与溶剂对照组中细胞活力的比值与1的差值,计算细胞相对抑制率。
1.3.2 细胞形态观察
在倒置光学显微镜(重庆澳浦光电技术有限公司)下观察细胞形态,显微镜放大倍数为目镜16×物镜40。
1.3.3 nAchRα7亚基mRNA表达的测定
使用实时荧光定量PCR仪(美国ABI 7500 Fast)测定细胞中nAchRα7亚基mRNA表达水平。细胞暴露完成后,弃去培养基。每孔加入1 mL Trizol(美国Thermo Fisher Scientific公司),冰上裂解5 min。将每孔中吹打均匀的液体加入的1.5 mL离心管(A管)中,加入200 μL氯仿进行萃取,盖紧盖子。剧烈晃动15 s,充分混匀后室温静置5 min。离心机在4 ℃、12 000 r·min-1条件下离心15 min。离心后将收集上层无色液体至1.5 mL干净离心管(B管),加入500 μL异丙醇,轻轻颠倒混匀,室温孵育10 min。离心机在4 ℃、12 000 r·min-1条件下离心15 min。弃上清,每管加入1 mL用DEPC水(中国北京诚业科技有限公司)配制的75%乙醇充分洗涤RNA沉淀。离心机在4 ℃、7 500 r·min-1条件下离心10 min。重复洗涤操作一次。弃去B管上清,适度晾干,然后加入20 μL无酶水,轻弹混匀,测浓度。根据Go ScriptTMReverse Transcription System试剂盒(美国Promrga公司)的说明,将RNA反转录为cDNA。定量PCR实验前于70 ℃在15 min内去除反转录酶。实验中用到的基因的引物均由生工生物工程(上海)股份有限公司合成,序列如表2所示,内参基因为β-Actin基因。按照扩增试剂盒SYBR Green Supermix(中国北京诚业科技有限公司)的要求配制20 μL反应混合液,实时荧光定量PCR反应程序为:95 ℃预热30 s,循环数为40,每个循环中95 ℃反应15 s,60 ℃反应1 min。使用2-△△CT的计算方法计算qPCR中实验组相对对照组的mRNA表达量倍数,以对照组为1进行标准化。
1.3.4 nAchRα7亚基蛋白表达的测定
采用Weston Blot法测定nAchRα7亚基蛋白表达水平。细胞暴露完成后,弃去培养基,用预冷的PBS清洗2次(置于冰上操作)。向每孔中加入100 μL细胞裂解液,并用干净的细胞刮刀将贴壁细胞刮下。收集裂解液中的细胞至2 mL离心管中,在冰上裂解1 h。裂解完毕后,14 000 r·min-1离心15 min(4 ℃),收集上清液于另一离心管中,弃去沉淀,使用BCA法测定上清液的蛋白质浓度。上样缓冲液与样品按1∶3体积比混合于600 μL离心管中,95 ℃加热15 min使蛋白质变性。在12孔预制胶中每孔上样18 μL进行电泳,电泳电压恒压100 V,时间为70 min。电泳结束后,将胶取下,恒流270 mA转PVDF膜60 min,得到的PVDF膜先用含5%脱脂奶粉的TBST溶液进行封闭1 h,然后用一抗(抗nAchRα7,美国Abcam公司)孵育膜过夜。孵育完毕后,用TBST洗膜3次,然后用二抗(山羊抗兔IgG H&L(Alexa Fluor® 488),美国Abcam公司)孵育80 min。孵育完毕后,用TBST洗膜3次。将PVDF膜放在一张保鲜膜上。使用ECL(美国Thermo Fisher公司)显影后,用ImageJ软件进行灰度分析,根据计算结果与蛋白质浓度之比,获得目标蛋白人nAchRα7亚基的相对表达量。β-actin蛋白作为上样参考。将曝光过一次的膜用TBST清洗3次,然后使用膜再生液处理,洗掉膜上结合的一抗。重新用含5%脱脂奶粉的TBST溶液封闭膜1 h,重新孵育β-actin的一抗过夜。之后步骤同nAchRα7的处理。

表2 RT-qPCR使用的引物序列Table 2 Primer sequences used in RT-qPCR
1.3.5 乙酰胆碱酯酶活性测定
采用人乙酰胆碱酯酶(AChE)酶联免疫分析试剂盒(上海研谨生物科技有限公司),利用双抗体夹心法测定样品中的AChE活性。细胞暴露完成后,弃去培养基,用PBS缓冲液轻轻冲洗细胞2次。用0.05%胰蛋白酶将细胞从六孔板上消化并收集到2 mL离心管中,2 000 r·min-1离心20 min(4 ℃),弃去上清液,用PBS清洗沉淀2次,2 000 r·min-1离心20 min(4 ℃),弃去上清液,用PBS重悬细胞,至细胞浓度达到1×106个·mL-1。在液氮中反复冻融收集到的细胞3次,2 000 r·min-1离心20 min(4 ℃),收集上清液并使用BCA法测定其中的蛋白质浓度(PierceTMBCA Protein Assay Kit试剂盒,美国Thermo Fisher公司)。在96孔板微孔中包被固定好人AChE抗体,加入样品并在37 ℃下孵育30 min,使样品中的AChE与固定的抗体结合。用洗涤液洗涤微孔5次,再加入有辣根过氧化物酶(HRP)标记的AChE抗体,37 ℃孵育30 min,使新加入的抗体包被在AChE上,形成抗体-抗原-酶标复合体。用洗涤液洗涤微孔5次,依次加入底物过氧化脲与3,3’,5,5’-四甲基联苯胺(TMB)。HRP催化过氧化脲与TMB反应,生成蓝色产物。蓝色产物在酸环境下转变为黄色,通过测定其在450 nm波长的吸光度,与标准样品比对,定量检测加入样品中AChE的活性浓度。计算结果与蛋白浓度之比,可得AChE在细胞中相对活性浓度。
1.3.6 细胞氧化应激测定
还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的比值常作为指示生物体内氧化应激的指标[22]。本实验中采用细胞内GSSG/GSH的变化表征氧化应激。利用总谷胱甘肽试剂盒(中国碧云天公司)测定细胞内谷胱甘肽含量。细胞暴露完成后,弃去培养基,用PBS洗涤细胞一次,离心收集细胞,弃去上清。加入细胞沉淀体积3倍量的蛋白去除试剂,利用液氮和37 ℃水浴对样品进行2次快速的冻融,4 ℃或冰浴放置5 min,10 000 r·min-1离心10 min(4 ℃),然后取一部分上清液用于总谷胱甘肽(GSSG+GSH)的测定,另一部分加入GSH清除试剂,用于测定细胞内GSSG含量。向两部分样品中分别加入蛋白去除试剂和总谷胱甘肽检测工作液,在25 ℃下孵育5 min,再加入0.5 mg·mL-1NADPH混匀,立即测定其在412 nm下的吸光度。总谷胱甘肽含量与氧化型谷胱甘肽含量相减,即得到还原性谷胱甘肽含量。
1.3.7 转录组分析
将0.1 mmol·L-1吡虫啉暴露组和溶剂对照组的细胞用0.05%胰蛋白酶(含EDTA)从培养皿上消化下来,用PBS缓冲液洗净,每组设置3个平行,交付上海生工生物工程股份有限公司用Illumina Hiseq 2500进行全RNA测序分析。在高通量测序的结果中筛选出吡虫啉暴露组和溶剂对照组基因表达量差异显著的基因,在相关生物信息学数据库当中查询其功能,并归纳出表达变化基因的功能。
1.4 数据处理
使用统计软件SPSS Statistics 20.0对数据进行分析,采用T检验方法检验结果显著性,显著性水平设为0.05。
2 结果(Results)
2.1 吡虫啉和啶虫咪暴露对SK-N-SH细胞活力的影响
SK-N-SH细胞在不同浓度吡虫啉和啶虫咪培养液中暴露24 h后的细胞活力和细胞活力抑制率如图1所示。与对照组相比,吡虫啉的10%抑制浓度(IC10)约为1.5 mmol·L-1。当吡虫啉浓度<1.2 mmol·L-1时,细胞活力没有受到显著影响(P>0.05);当吡虫啉浓度≥1.5 mmol·L-1时,细胞活力显著降低(P<0.05),且有明显的剂量-效应关系(P<0.05)。由于吡虫啉的溶解度有限,无法观察到吡虫啉的50%抑制浓度(IC50)值。与对照组相比,啶虫脒的IC10约为2.0 mmol·L-1,IC50约为10.6 mmol·L-1。当啶虫脒浓度<1 mmol·L-1,细胞活力没有受到显著影响(P>0.05);当啶虫脒浓度≥1 mmol·L-1时,细胞活力显著降低(P<0.05),且有明显的剂量-效应关系(P<0.05)。由于通常情况下人体内新烟碱类杀虫剂的暴露剂量较低[8,23],根据细胞活力实验结果,设定了3个梯度的低浓度水平(0.01、0.1和1 mmol·L-1)进行后续暴露实验。在倒置光学显微镜下观察,与溶剂对照相比,0.01~1 mmol·L-1吡虫啉/啶虫脒暴露下的细胞形态无明显变化。不同浓度吡虫啉暴露下的细胞形态如图2所示。

图1 不同浓度吡虫啉(a)和啶虫脒(b)对细胞活力的影响注:DMSO表示二甲基亚砜溶剂对照(0.1% DMSO),*表示P<0.05,**表示P<0.01,***表示P<0.001,与溶剂对照比较。Fig. 1 Effects of imidacloprid (a) and acetamiprid (b) at different concentrations on cell viabilityNote: DMSO stands for dimethyl sulfoxide solvent control (0.1% DMSO); *represents P<0.05, **represents P<0.01, ***represents P<0.001, as compared to the solvent control.

图2 溶剂对照和3种浓度吡虫啉暴露下的细胞形态(20×20)注:(a) 溶剂对照;(b) 0.01 mmol·L-1吡虫啉;(c) 0.1 mmol·L-1吡虫啉;(d) 1 mmol·L-1吡虫啉。Fig. 2 Cell morphology in solvent control and in groups exposed to different concentrations of imidacloprid (20×20)Note: (a) solvent control; (b) 0.01 mmol·L-1 imidacloprid; (c) 0.1 mmol·L-1 imidacloprid; (d) 1 mmol·L-1 imidacloprid.
2.2 吡虫啉和啶虫咪暴露对SK-N-SH细胞nAchR α7亚基mRNA和蛋白表达的影响
SK-N-SH细胞在溶剂对照和3个浓度(0.01、0.1和1 mmol·L-1)吡虫啉和啶虫咪培养液中暴露24 h后nAchRα7亚基mRNA表达水平的变化如图3所示。与溶剂对照组相比,1 mmol·L-1的2种杀虫剂暴露组中nAchRα7亚基的mRNA表达均显著上升(P<0.05)。
SK-N-SH细胞在溶剂对照和3个浓度(0.01、0.1和1 mmol·L-1)吡虫啉和啶虫咪培养液中暴露24 h后nAchRα7亚基蛋白表达的比较如图4和图5所示。与溶剂对照组相比,1 mmol·L-1的2种杀虫剂暴露组中nAchRα7亚基的蛋白表达均显著上升(P<0.01)。这个结果与mRNA的结果一致。
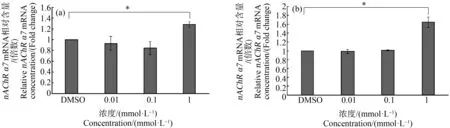
图3 不同浓度吡虫啉(a)和啶虫脒(b)对细胞内nAChR α7亚基mRNA含量的影响注:*表示P<0.05,与溶剂对照相比。Fig. 3 Effects of imidacloprid (a) and acetamiprid (b) at different concentrations on the content of nAChR α7 subunit mRNA in cellsNote: *represents P<0.05, compared with the solvent control.
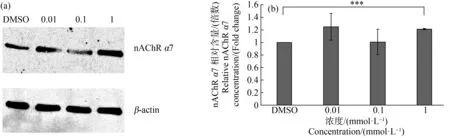
图4 不同浓度吡虫啉组细胞内nAChR α7亚基凝胶电泳蛋白质条带图(a)和含量(b)注:***表示P<0.001,与溶剂对照相比。Fig. 4 Protein band diagram (a) and content (b) of nAChR α7 subunit gel electrophoresis in cells under exposure to different concentrations of imidaclopridNote: ***represents P<0.001, compared with the solvent control.
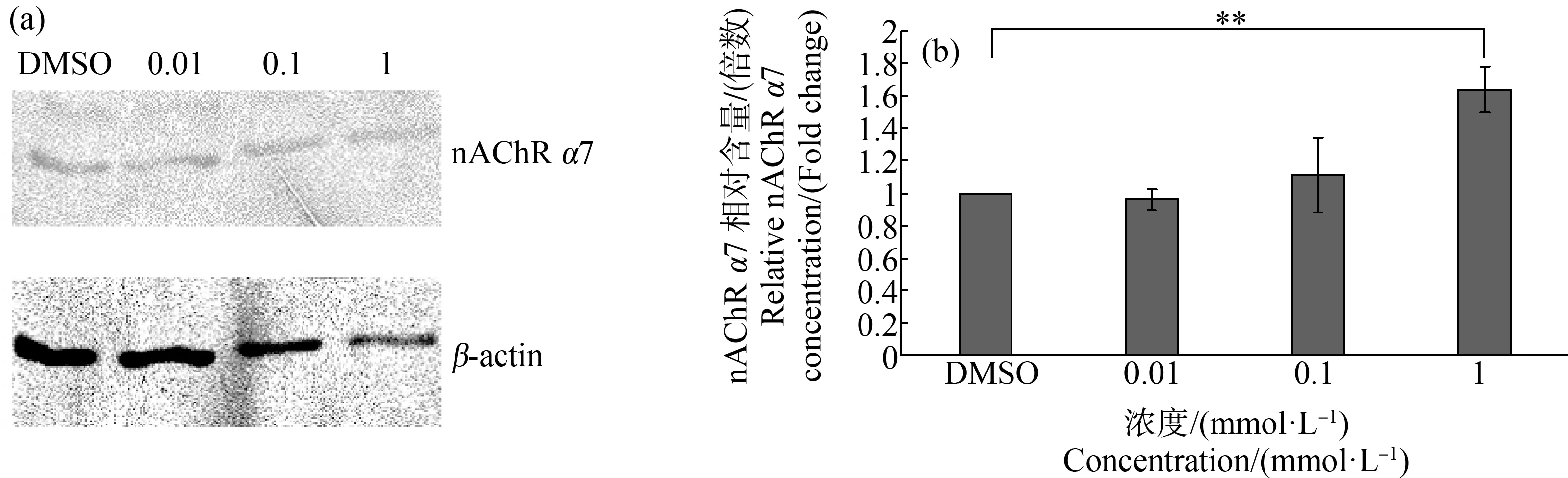
图5 不同浓度啶虫脒组细胞内nAChR α7亚基凝胶电泳蛋白质条带图(a)和含量(b)注:**表示P<0.01,与溶剂对照相比。Fig. 5 Protein band diagram (a) and content (b) of nAChR α7 subunit gel electrophoresis in cells under exposure to different concentrations of acetamipridNote: **represents P<0.01, compared with the solvent control.
2.3 吡虫啉和啶虫咪暴露对SK-N-SH细胞乙酰胆碱酯酶活性的影响
SK-N-SH细胞在溶剂对照和3个浓度(0.01、0.1和1 mmol·L-1)吡虫啉和啶虫咪培养液中暴露24 h后AChE活性的比较如图6所示。与溶剂对照组相比,0.1 mmol·L-1和1 mmol·L-1吡虫啉暴露组中AChE活性显著降低(P<0.01),0.01 mmol·L-1吡虫啉暴露组中AChE活性也降低,但没有统计学上的显著性差异(P>0.05),3个浓度啶虫脒暴露组中AChE活性无明显变化(P>0.05)。
2.4 吡虫啉和啶虫咪暴露对SK-N-SH细胞氧化应激的影响
SK-N-SH细胞在溶剂对照和3个浓度(0.01、0.1和1 mmol·L-1)吡虫啉和啶虫咪培养液中暴露24 h后GSSG/GSH的比较如图7所示。与溶剂对照组相比,1 mmol·L-1吡虫啉暴露组中GSSG/GSH显著上升(P<0.05),0.01 mmol·L-1和0.1 mmol·L-1吡虫啉暴露组中GSSG/GSH有明显上升,但没有统计学上的显著性差异(P>0.05),3个浓度啶虫脒暴露组中GSSG/GSH也有上升,但没有统计学上的显著性差异(P>0.05)。
2.5 吡虫啉暴露对SK-N-SH细胞转录组的影响
以上研究结果显示,在相同暴露条件下,吡虫啉对细胞的影响大于啶虫脒。为进一步揭示吡虫啉的影响,取0.1 mmol·L-1吡虫啉暴露组和溶剂对照组进行了转录组测序,并与已有的数据库比对,确定表达变化基因的功能。与对照组相比,0.1 mmol·L-1吡虫啉暴露组出现了很多有显著表达差异的基因,其中一些主要富集在神经退行性疾病如亨廷顿病、帕金森病和阿尔兹海默病等相关通路,如图8所示。

图6 不同浓度吡虫啉(a)和啶虫脒(b)对细胞内乙酰胆碱酯酶(AChE)相对活性的影响注:**表示P<0.01,与溶剂对照相比。Fig. 6 Effects of imidacloprid (a) and acetamiprid (b) at different concentrations on the relative activity of acetylcholinesterase (AChE) in cellsNote: **represents P<0.01, compared with the solvent control.

图7 不同浓度吡虫啉(a)和啶虫脒(b)对细胞内氧化型谷胱甘肽/还原型谷胱甘肽(GSSG/GSH)的影响注:*表示P<0.05,与溶剂对照相比。Fig. 7 Effects of imidacloprid (a) and acetamiprid (b) at different concentrations on intracellular oxidized glutathione/reduced glutathione (GSSG/GSH)Note: *represents P<0.05, compared with the solvent control.
3 讨论(Discussion)
吡虫啉和啶虫咪都属于第一代新烟碱类杀虫剂(氯代烟碱型),但部分结构不同。吡虫啉属于N-硝基胍类,而啶虫咪属于氰基脒类,这使得两者与nAChR的结合能力不同,因而毒性也不同。在细胞活力测试中,吡虫啉和啶虫咪对SK-N-SH细胞的IC10分别约为1.5 mmol·L-1和2.0 mmol·L-1(暴露24 h),这表明吡虫啉对SK-N-SH细胞活力的抑制大于啶虫咪。新烟碱类杀虫剂的主要作用靶点为nAChR,即杀虫剂中的药效基团与nAChRs的氨基酸残基相互作用[17]。在脊椎动物中,目前已经识别出17种不同的nAChRs亚基(α1~α10、β1~β4、γ、δ、ε),除α8外,其余亚基在人类中都存在,这些亚基的多种组合方式构成了nAChRs功能的多样性[24-25]。nAChRα7是中枢神经系统中分布最多的一种nAChRs亚型,与大脑的学习、记忆以及感觉门控等认知功能有关。nAChRs通过结合突触前膜释放的神经递质乙酰胆碱,对Na+、K+和Ca2+的通透性增强[12],从而使电信号在细胞之间传递。突触间的AChE可以降解乙酰胆碱,终止乙酰胆碱对突触后膜的兴奋作用,维持正常的神经传导活动。此外,AChE还参与细胞的发育和成熟,能促进神经元发育和神经再生。本研究中,暴露于1 mmol·L-1的吡虫啉或啶虫咪24 h均使SK-N-SH细胞内nAchRα7亚基的蛋白表达显著上升,这可能是吡虫啉和啶虫咪与nAchRα7结合后细胞为应对乙酰胆碱结合位点减少而产生的一种补偿机制。0.01 mmol·L-1和0.1 mmol·L-1的吡虫啉或啶虫咪与nAchRα7亚基的结合较少,因而对nAchRα7亚基的蛋白表达影响不明显。0.1 mmol·L-1和1 mmol·L-1吡虫啉对SK-N-SH细胞内AChE活性有显著的抑制效应,这与有机磷的作用类似[26],表明吡虫啉可能会与AChE结合,抑制其活性,或通过其他方式抑制AchE活性。3个浓度(0.01、0.1和1 mmol·L-1)啶虫咪对AchE活性均无影响,表明啶虫咪与AChE不会结合。吡虫啉和啶虫咪对AChE活性影响的不一致,与2种杀虫剂的药效基团不同有关。

图8 与溶剂对照相比,0.1 mmol·L-1吡虫啉暴露组显著差异基因富集通路Fig. 8 Compared with solvent control, enrichment pathways of significantly different genes in 0.1 mmol·L-1 imidacloprid exposure group
氧化还原态平衡是机体内环境稳定的基本内涵之一,它可以影响到基因的转录、细胞信号的转导、酶和生物大分子的活性、细胞和器官的功能,以及细胞的增殖、分化、凋亡、坏死等许多生理、病理生理过程。因此,监测细胞的氧化-还原态非常重要[27]。GSH和GSSG是体内的一个氧化还原对,可较好地反映人体内氧化还原状态。本研究中,不同浓度的吡虫啉或啶虫咪均使GSSG/GSH上升,但只有1 mmol·L-1的吡虫啉使GSSG/GSH显著上升,其余不显著。
在转录组水平上,0.1 mmol·L-1吡虫啉暴露可引起上千个基因表达发生变化,包括与神经退行性疾病(亨廷顿舞蹈病、帕金森病和阿尔茨海默病)有关的基因和与酒精性脂肪性肝病及氧化磷酸化有关的基因,这些基因之间联系十分紧密。除此之外,与泛素蛋白、剪接体、核糖体、RNA转移有关的基因表达也出现显著变化,但是这些基因之间联系不密切。转录组结果可为下一步研究指明方向。
综上所述,吡虫啉和啶虫脒作为nAChRs的激动剂,可与乙酰胆碱竞争结合位点。结合了吡虫啉或啶虫脒的nAChRs,无法行使其正常功能。细胞为了对抗这种因乙酰胆碱受体效价下降所造成的功能下降,一方面提高nAChRs亚基的表达量以增加未结合杀虫剂的nAChRs的量,另一方面降低AChE的活性(在吡虫啉暴露中发现),提高乙酰胆碱与nAChRs结合的概率。吡虫啉和啶虫脒与nAChRs结合后,氧化应激增强,尤其是吡虫啉。在本研究中,除细胞活力外,其余各指标未观察到明显的剂量-效应关系,可能与2种杀虫剂复杂的致毒机制有关。
