儿童异基因造血干细胞移植后急性肾损伤临床分析
2022-01-20聂应明卢文婕祁闪闪
聂应明 刘 婧 戚 畅 王 卓 陈 智 杨 李 卢文婕 唐 威 祁闪闪 熊 昊
华中科技大学同济医学院附属武汉儿童医院 1.血液肿瘤科,2.心血管内科,3.肾脏内科(湖北武汉 430016)
随着异基因造血干细胞移植(allogeneic hema topoietic stem cell transplantation,allo-HSCT)技术的飞速进展,某些难治性恶性血液病、恶性肿瘤及先天性遗传代谢性疾病、免疫缺陷性疾病有了治愈的希望,但随之而来的挑战是日益增多的移植相关并发症对移植患儿长期生存质量的影响。其中移植后肾脏损害是严重影响移植预后的因素之一,严重时可导致患儿死亡[1]。目前研究认为,无论是何种类型的造血干细胞移植,急性肾损伤(acute kidney injury,AKI)与全因死亡率和非复发死亡率相关,而需要急性透析患儿的病死率更可高达80%以上。导致AKI的因素可能包括脓毒症、肾毒性药物、骨髓输注综合征、肝窦间隙阻塞综合征(sinusoidal obstruction syndrome,SOS)、血栓性微血管病(thrombotic microangiopathy,TMA)、感染以及移植物抗宿主病(graft versus host disease,GVHD)[2-3]。儿童allo-HSCT后AKI 的临床资料研究相对较少,由于巨大的内在差异,来自成人研究的数据不能直接外推到儿童人群。本研究拟总结患儿接受allo-HSCT 后发生AKI的临床特性,并进行相关危险因素分析,以期早期诊断并减少患儿allo-HSCT并发AKI的风险,改善移植患儿长期生存质量。
1 对象与方法
1.1 研究对象
收集2016年8月至2020年3月武汉儿童医院血液肿瘤科接受allo-HSCT 治疗患儿的临床资料。研究对象纳入标准:①年龄<18岁;②行allo-HSCT并随访1年以上。排除标准:①资料不完整或失访者;②allo-HSCT 中途退出者;③家长不同意参与此项目者。儿童AKI采用急性透析质量倡议工作组提出的pRIFLE标准[4]进行评估,pRIFLE标准根据肌酐清除率(Ccr)、尿量将AKI 分为风险期、损伤期、衰竭期、肾功能丧失和终末期肾病(表1)。根据血肌酐(Cr)、Ccr平将患儿分为AKI组和非AKI组。

表1 儿童AKI的pRIFLE诊断标准[4]
本研究获得医院伦理委员会批准。
1.2 方法
1.2.1 临床资料收集 记录患儿原发疾病,供者与受者HLA位点相合程度,移植方式,预处理方案,移植后100 d 移植相关并发症包括急性移植物抗宿主病(acute graft versus host disease,aGVHD)、SOS、出血性膀胱炎、巨细胞病毒感染、EB 病毒感染、TMA等,移植前后血Cr水平、Ccr以及移植后1年的总体生存(overall survival,OS)情况。
1.2.2 预处理方案 白消安(busulfan,BU)联合环磷酰胺(cyclophosphamide,CY)为基础的经典清髓预处理方案,其他常用预处理药物包括氟达拉滨(fludarabine,FLU)、依托泊苷(etoposide,VP16)、司莫司汀(semustine,CCNU)、兔抗人胸腺细胞球蛋白(anti-human thymocyte globulin,ATG)。各化疗药物的用法用量:BU 12.8 mg/(kg·d),-7 d~-4 d;CY 120 mg/(kg·d),-3 d~-2 d;ATG 4.5 mg/(kg·d),-2 d~-1d;VP16 200 mg/(m2·d),-5 d~-4d;CCNU 250 mg/(m2·d),-5 d;FLU 40 mg/(m2·d),-6 d~-4 d。
1.2.3 造血干细胞动员、采集 供者皮下注射粒细胞集落刺激因子(每日10 μg/kg)动员,第5~6天通过血细胞分离机(德国费森尤斯)采集外周血造血干细胞,目标为CD34+细胞(5~8)×106/kg,单个核细胞(8~10)×107/kg。
1.2.4 急性移植物抗宿主病(acute graft versus host disease,aGVHD)预防 采用环孢素A(cyclosporine A,CsA)+吗替麦考酚酯(mycophenolate mofetil,MMF)+甲氨蝶呤(methotrexate,MTX)经典三联GVHD 预防方案。预处理开始时予CsA 1.5 mg/(kg·d)持续静脉滴注,造血干细胞输注6 h 后调整为3 mg/(kg·d),当患儿粒细胞植入,胃肠功能恢复后改为口服,维持CsA 谷浓度150~250 ng/mL;移植前1 天开始口服MMF 30 mg/(kg·d),移植后30天如无aGVHD 即可减停;移植后第1 天甲氨蝶呤15 mg/m2,第3、6天10 mg/m2静滴。
1.2.5 植入证据检测 移植后中性粒细胞绝对值连续3天超过0.5×109/L者第1天为粒细胞植入时间,血小板连续7 天超过20×109/L 的第1 天为血小板植入时间。以嵌合体短串联重复序列(short tandemrepeat,STR)检测作为植入证据的判断指标。
1.2.6 allo-HSCT 后发生AKI 患儿的治疗 发生AKI后治疗以对症治疗为主,大部分预后良好。治疗措施包括严格控制体液电解质平衡,调整肾毒性药物的使用(如停用环孢素A、他克莫司,改用糖皮质激素预防GVHD等),积极处理HSCT相关并发症如SOS、GVHD、脓毒症等。
1.3 统计学分析
采用SPSS 20.0 统计软件进行数据分析。符合正态分布的计量资料以四分位数表示,多组间比较采用单因素方差分析;非正态分布计量资料以中位数(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。将P<0.1 的变量纳入多因素logistic 回归分析allo-HSCT 后发生AKI 的危险因素。生存分析采用Kaplan-Meier曲线及Log-Rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
共147 例allo-HSCT 患儿纳入本研究,其中男85 例、女62 例,接受移植时中位年龄5.5 岁(0.7月~16 岁)。原发病包括再生障碍性贫血46 例(重型及极重型)、急性淋巴细胞白血病15 例、急性髓系白血病38 例、急性混合细胞白血病2 例、噬血细胞综合征5 例、幼年型粒单核细胞白血病4 例、骨髓增生异常综合征9 例、先天性中性粒细胞缺乏症2 例、重型β 地中海贫血9 例、范可尼贫血3 例、高IgM 血症1 例、肾上腺脑白质营养不良2 例、黏多糖贮积症4 例、湿疹血小板减少伴免疫缺陷(Wiskott-Aldrich,WAS)综合征2例、X连锁淋巴增值性疾病3例、异染性脑白质营养不良1例、先天性血小板减少1例。
移植方式均为allo-HSCT,其中亲缘供者106例,无关供者41 例;全相合供者45 例,不全合供者102例。粒细胞植入中位时间为12.5(10.0~15.0)d。血小板植入中位时间15.3(13.0~19.0)d。
2.2 allo-HSCT后并发症发生情况
147例患儿中并发aGVHD 78例、SOS 26例、出血性膀胱炎30例、脓毒症97例、巨细胞病毒血症65例、EB 病毒血症50 例;其中49 例发生1 种并发症,42例合并2种并发症,56例合并≥3种并发症。
2.3 allo-HSCT后AKI发生危险因素分析
147 例移植患儿移植预处理前Cr 及Ccr 均在正常范围。101例(68.7%)患儿发生AKI,中位时间为24.0(-5.0~91.0)d。与非AKI组相比,AKI组移植后Cr较高,Ccr较低,aGVHD、SOS发生率较高,差异均有统计学意义(P<0.05)。见表2。二元logistic回归分析显示,移植后aGVHD、SOS是AKI发生的独立危险因素(P<0.05)。见表3。
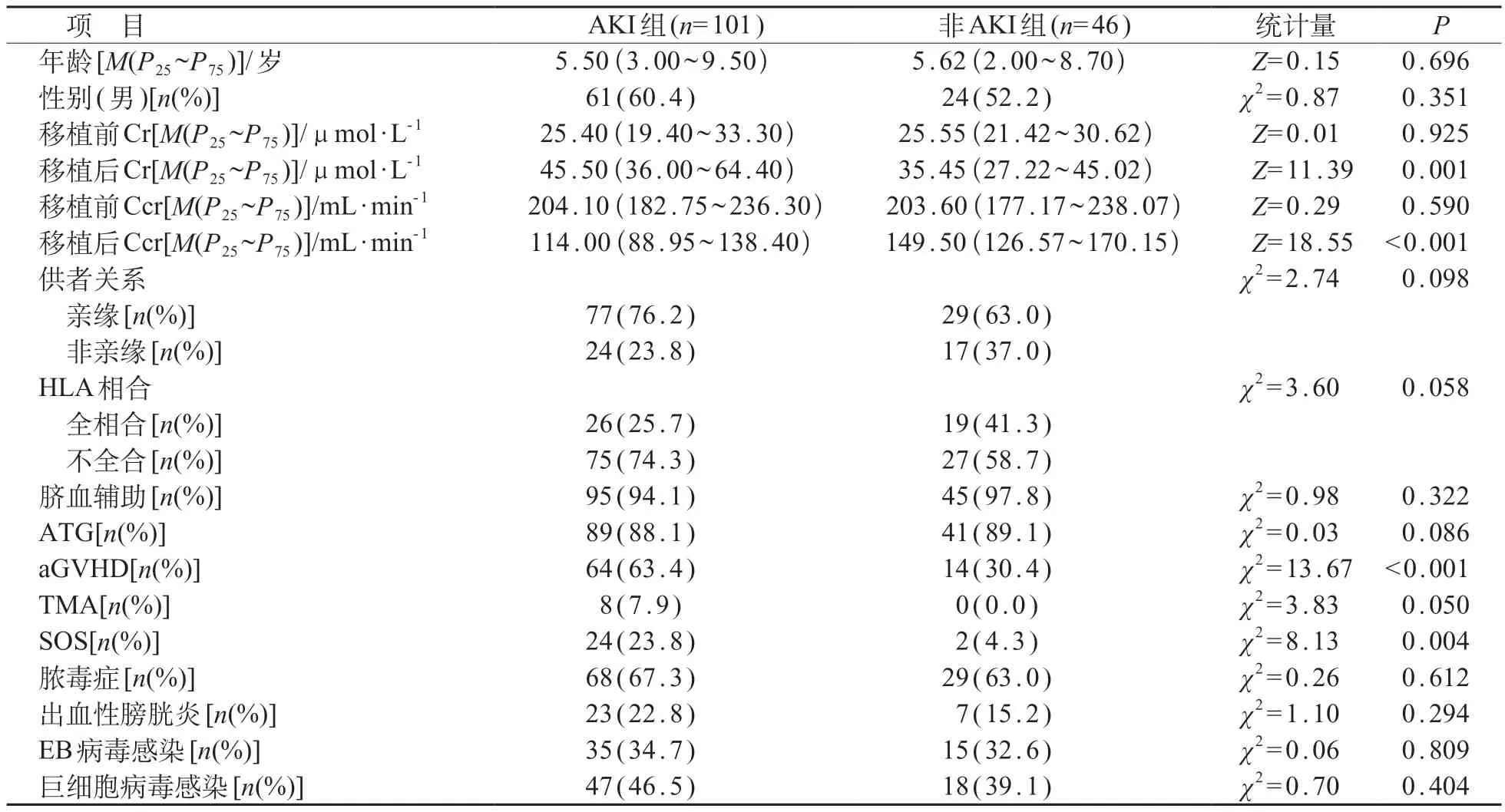
表2 allo-HSCT后AKI与非AKI组指标比较

表3 allo-HSCT后AKI危险因素的多因素logistic回归分析
2.4 AKI不同分期Cr及Ccr比较
按pRIFLE 诊断标准将发生AKI 的101 例患儿分为风险期组54例、肾损伤期组31例以及肾衰竭期组16 例,肾功能丧失和终末期肾病组均为0 例。不同分期之间患儿Cr及Ccr水平差异均有统计学意义(P<0.05);肾衰竭期组Cr水平较高,Ccr水平较低。见表4。
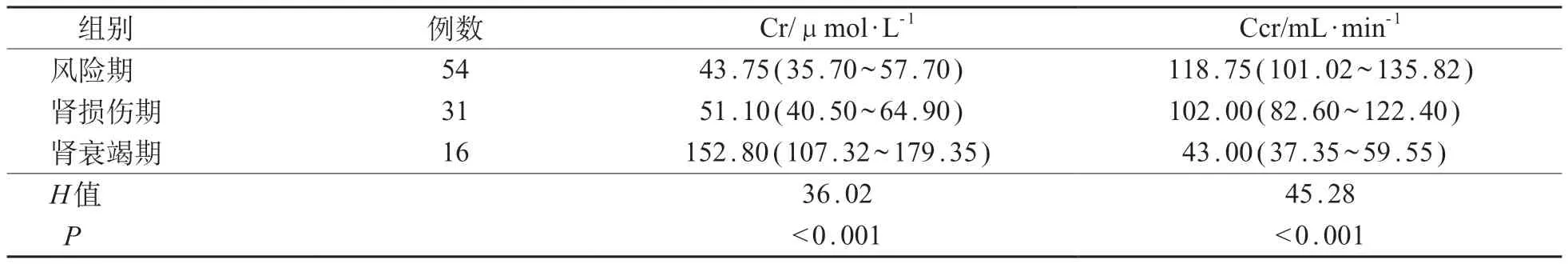
表4 三组AKI患儿Cr及Ccr比较[M(P25~P75)]
2.5 AKI不同分期治疗后预后
风险期组51例经治疗后Cr恢复正常,2例进展至肾损伤期,1例死于脓毒症;肾损伤期组22例随访Cr 恢复正常,4 例进展至肾衰竭期,5 例死亡;肾衰竭期组2例Cr恢复,4例Cr无改善,10例死亡。
2.6 allo-HSCT 后发生AKI 患儿预后及死亡原因分析
纳入研究的147 例患儿中移植1 年随访期间死亡18例(12.2%)。AKI组死亡16例(风险期组1例,肾损伤期组5例,肾衰竭期组10例),占总死亡人数88.9%,其中8例死于感染,3例死于GVHD所致的多器官衰竭,3例死于原发病复发,2例死于SOS;非AKI 组死亡2 例,其中1 例死于感染,1 例死原发病复发。
Kaplan-Meier生存曲线提示无AKI组1年OS为(95.70±2.97)%,AKI组1年OS为(84.00±3.86)%,Log-Rank 检验提示两组间1 年OS 差异有统计学意义(χ2=4.134,P=0.042)。见图1。

图1 AKI 组与非AKI 组患儿的累积生存曲线
3 讨论
随着HSCT 技术的迅速发展,临床适应症不断增多,越来越多先前常规治疗无法治疗/治愈的儿童恶性血液病及一些先天性遗传代谢/免疫缺陷病获得长期生存的希望。然而allo-HSCT 后的并发症依然是影响患儿长期生存的难题。HSCT 术后AKI 发生率为10%~73%,约4.8%的患儿需要肾脏替代治疗[5-6]。AKI导致肾脏损害的病理类型包括膜性肾病、微小病变、局灶性节段性肾小球硬化,亦可见急性肾小管损伤、间质纤维化、小动脉硬化等表现[7]。本研究显示,147例患儿中allo-HSCT后发生AKI 有101例(68%),中位时间为24(-5~91)d,与国内外成人allo-HSCT报道一致[8-9]。一项对1 057例接受HSCT的儿童患者进行的回顾性研究发现,移植后100 天内AKI发生率为68.2%,发生AKI的中位时间为14天,其中AKIⅠ期22.0%、AKI Ⅱ期41.4%、AKI Ⅲ期36.6%[9],提示儿童发生AKI概率更高,发生时间更早。
本研究中,147例患儿中共发生SOS 26例;AKI组中24例发生SOS,非AKI组仅2例。几乎所有SOS患儿都会发生一定程度的AKI,AKI 的表现方式与肝肾综合征类似,50%以上患儿发展为严重的AKI,需要持续肾脏替代治疗[10-11]。其发生机制可能是因肝小静脉、肝窦的纤维化及狭窄导致门脉高压而引起肾脏血流灌注不足,造成肾小管损伤,导致肾前性AKI发生[12-13]。GVHD可引起多种细胞因子的释放、血管内皮细胞损伤及免疫损伤而导致AKI发生,同时预防及治疗GVHD使用的肾毒性药物(如钙调磷酸酶抑制剂、甲氨蝶呤、糖皮质激素等)可进一步损伤肾小管[14-15]。严重肠道GVHD 常伴有循环血容量不足,也可引起肾前性AKI 的发生。相关研究在小鼠急性GVHD模型中发现,肾小管上皮细胞中α-Klotho mRNA 水平下降,同时伴有α-Klotho 蛋白合成减少,提示αKlotho蛋白参与了GVHD诱导的肾脏损伤,为治疗AKI提供了新的思路[16]。目前,临床上AKI 的治疗仅以对症治疗为主,主要为减少肾毒性药物的使用,保证有效循环容量,同时积极治疗GVHD、SOS及感染等并发症。
相关研究发现单倍体HSCT 后AKI 患儿的2年OS 为72.8%,而且OS 随AKI 的严重程度而降低,AKI Ⅰ期 75.8%,AKI Ⅱ期58.7%,AKI Ⅲ期44.6%[17]。另有研究发现移植后AKI 显著增加了5 年非复发死亡率,同时显著增加了慢性肾病的风险[18]。本组147 例allo-HSCT 患儿随访1 年死亡18例(12.2%),其中AKI组16例(风险期1例,肾损伤期5例,肾衰竭期10例)。无AKI组1年OS为95%,AKI 组为84%,log-rank 检验提示AKI 与移植患儿OS密切相关(P<0.05)。
综上所述,儿童allo-HSCT发生AKI较为常见,其危险因素为GVHD、SOS,严重AKI与HSCT患儿预后密切相关,其治疗原则以对症治疗为主,同时预防及治疗AKI发生的相关危险因素。未来需要进一步开展多中心大样本研究以探索有效控制allo-HSCT 过程中AKI 的相关危险因素,预防并早期诊断AKI,以期改善患儿的生存及预后。
