EphA8在非小细胞肺癌中的表达及其预后价值*
2022-01-19朱惠君刘益飞
王 伟,刘 颖,黄 芳,何 鑫,袁 傲,靳 钦,朱惠君,刘益飞
(南通大学附属医院病理科,江苏 226001)
近年来肺癌已成为世界范围内常见的恶性肿瘤,发病率和死亡率高[1],85%以上肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC)。由于NSCLC的高度侵袭性和对治疗的耐受性,易侵犯淋巴结或远处转移,5年生存率小于15%[2],早期诊断和综合治疗是降低死亡率的关键。
受体酪氨酸激酶包含16个成员,分为EphA和EphB亚家族,其中EphA1-8、EphA10和EphB1-3与细胞表面配体Ephrin-A1-5和Ephrin-B结合[3]介导细胞间相互作用,产生细胞内信号传导,在上皮细胞中起着重要作用[4]。研究表明,EphA8(ephrin type-A receptor 8)与多种肿瘤的增殖、转移密切相关[3-6]。本文收集南通大学附属医院病理科2010年1月—2017年12月167例NSCLC肿瘤组织石蜡样本,制作组织芯片,应用免疫组织化学方法检测EphA8表达情况,回顾性分析EphA8表达与临床病理特征及预后的相关性。
1 资料与方法
1.1 一般资料 手术切除并经病理诊断为NSCLC的肿瘤组织石蜡标本167例,其中男性92例,女性75例,年龄36~80岁,平均60±9岁,有吸烟史32例;肿瘤直径<3 cm 48例,≥3 cm 119例。肿瘤分期按照第八版TNM分期指南。本研究经南通大学附属医院伦理研究委员会批准。
1.2 免疫组织化学分析 组织芯片又称组织微阵列(TMA),其制作按照苏木精-伊红染色(H&E)结果,选择代表性癌区标记在石蜡块中,获得直径2 mm TMA样品。对TMA连续切片,切片厚度为4μm。经二甲苯脱蜡和梯度浓度酒精脱水后,用柠檬酸盐溶液(pH 6.0)加压煮沸20 min进行抗原修复。自然冷却至室温后,以3%H2O2阻断内源性过氧化物酶活性,10%山羊血清封闭,以EphA8单克隆抗体(1∶200,OMI189940,Omnimabs,NJ)孵育,4℃冰箱过夜。次日复温后加辣根过氧化物酶标记山羊抗兔IgG抗体(Dako,Carpinteria,CA,USA)孵育,DAB显色,苏木素染胞核1 min,脱水,透明,封片,晾干。以PBS代替一抗作为空白对照。
1.3 染色结果观察 采用半定量双盲法评估,由两位主治以上病理学医师在显微镜下独立阅片。细胞质中出现棕黄色颗粒为阳性,染色强度计分:阴性0分,弱阳性1分,中等阳性2分,强阳性3分。按阳性染色细胞占总细胞数的百分比评分:0分,无阳性染色;1分,阳性细胞<25%;2分,阳性细胞25%~50%;3分,阳性细胞>50%。细胞质染色强度计分乘以染色阳性细胞占比评分为最终染色评分,<6分为EphA8低表达,≥6分为EphA8高表达。
1.4 统计学处理 应用SPSS 22.0统计学软件进行数据分析。采用Pearsonχ2检验分析EphA8表达与患者临床病理特征的关系,单因素和多因素COX回归模型分析影响预后的相关因素。绘制Kaplan-Meier累积生存率曲线,运用log-rank法比较生存率的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 EphA8表达水平与NSCLC临床病理特征的相关性 167例NSCLC肿瘤组织中91例(54.5%)EphA8高表达,EphA8表达水平与肿瘤大小(P<0.001)、TNM分期(P=0.001)、原发肿瘤分级(P<0.001)和淋巴结转移(P=0.035)有关,而与年龄、性别、吸烟史、分化程度、病理分类及远处转移无相关性。见表1。

表1 EphA8蛋白表达水平与NSCLC患者临床病理学特征的关系 例(%)
2.2 影响NSCLC患者预后的因素分析 单因素Cox回归分析显示,EphA8表达水平(HR=1.474,P=0.030)和肿瘤大小(HR=1.722,P=0.012)是影响NSCLC患者生存率的重要因素。多因素Cox回归模型分析显示,EphA8表达水平(P=0.046)和肿瘤大小(P=0.018)是NSCLC独立的预后因素,EphA8高表达、肿瘤体积大预示NSCLC患者预后不良。见表2。Kaplan-Meier生存曲线显示,EphA8高表达患者5年总生存率低于EphA8低表达患者,肿瘤直径≥3 cm患者5年总生存率低于肿瘤直径<3 cm患者,差异均有统计学意义(P<0.05)。见图1、图2。

图2 肿瘤大小与NSCLC患者总体生存率分析

表2 EphA8蛋白表达与NSCLC患者预后的关系
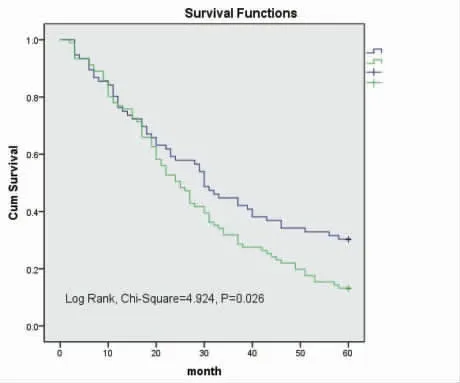
图1 EphA8表达与NSCLC患者总生存率分析
3 讨 论
在神经元和血管组织中首次发现的Ephs和Ephrins是受体酪氨酸激酶中最大的家族,Ephs/Ephrins信号通路参与许多重要的生物发育和细胞过程,如轴突引导[7]和血管生成[8]。Ephs/Ephrins几乎在所有类型肿瘤组织中表达,可能通过促进血管化过程来增强肿瘤生长能力[8-9],其过度表达可阻碍细胞粘附,有利于肿瘤转移[9]。Ephs参与调节细胞增殖、凋亡、侵袭和迁移[10],许多Ephs家族成员在转移性癌细胞中的表达水平高于原发肿瘤,其表达水平往往与肿瘤恶性程度和侵袭性有关[11]。EphA1过表达与胃癌的侵袭、转移和不良预后有关[12],EphA2促进胃癌上皮间质转换[13],促进结肠癌[14]、前列腺癌[15]发生发展,在胃癌组织中EphA3表达上调,并与肿瘤血管生成和预后相关[16]。
EphA8是Ephs RTKs亚家族的受体之一,通过与GPI锚定的Ephrin-A2、A3和A5结合而发挥作用。EphA8-Fc以caspase依赖方式增加Ephrin-A5表达,从而抑制细胞凋亡[17]。越来越多的研究表明,EphA8是调节肿瘤进展的重要参与者。在胶质瘤中miR-10a靶向下调EphA8 mRNA表达,从而抑制肿瘤细胞的侵袭和迁移[5]。在舌癌[6]、卵巢癌[7]、结肠癌和胃癌[8]组织中EphA8 mRNA表达上调,促进肿瘤的增殖,侵袭和迁移。对不同肿瘤组织中EphA8表达与临床病理参数相关性分析表明,EphA8可能是一种促癌基因[18]。
本研究选择NSCLC为研究对象,旨在探讨EphA8在NSCLC肿瘤组织中的表达与临床病理特征的相关性以及对患者预后的影响。结果显示,EphA8表达水平与肿瘤大小(P<0.001)、TNM分期(P=0.001)、原发肿瘤分级(P<0.001)和淋巴结转移(P=0.035)有关。单因素Cox回归分析显示,EphA8表达水平(HR=1.474,P=0.030)和肿瘤大小(HR=1.722,P=0.012)是影响NSCLC患者生存率的重要因素。多因素Cox回归模型分析显示,EphA8表达水平(P=0.046)和肿瘤大小(P=0.018)是NSCLC独立的预后因素。Kaplan-Meier生存曲线显示,EphA8高表达患者5年总生存率低于EphA8低表达患者,肿瘤直径≥3 cm患者5年总生存率低于肿瘤直径<3 cm患者,差异均有统计学意义(P<0.05)。说明EphA8高表达与NSCLC患者的不良预后有关,与舌癌[4]、卵巢癌[5]、结肠癌和胃癌[6]的研究结果相似。然而,单因素Cox回归分析结果显示TNM分期与预后无相关性,这可能是因为TNM分期的制定基于大样本数据,而本研究样本数较少,所以并没有显著性差异。
综上所述,EphA8可作为监测NSCLC患者预后的潜在生物标志物,有望为精准治疗提供新的策略。但本研究仅限于临床观察,今后需扩大样本量,并深入探讨EphA8在NSCLC中的分子作用机制。
