阿勒泰脂臀羊臀脂分提产物对小鼠肝脏脂质水平及氧化应激的影响
2022-01-19徐艳丽朱明睿孙佳宁马玉洁王子荣
徐艳丽,朱明睿,孙佳宁,张 莉,马玉洁,王子荣
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
阿勒泰脂臀羊主要产区集中在新疆北部的阿勒泰地区福海县、富蕴县、清河县等地,2012年被评为“地理标志产品”[1]。阿勒泰脂臀羊尾部呈方圆形,尾臀合一且硕大,因此也被为“大尾羊”。阿勒泰脂臀羊臀脂主要为饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸[2]。何鑫等[3]研究发现阿勒泰脂臀羊臀脂中含18种脂肪酸成分,包括不饱和脂肪酸8种,共占比49.30%,主要成分油酸(37.40%),还有少量的亚油酸(2.23%),单不饱和脂肪酸含量为4.70%,以亚油酸(2.23%)、亚麻酸(0.91%)及共轭亚油酸(1.56%)为主;饱和脂肪酸10种,占比50.70%,主要为棕榈酸(20.39%)、硬脂酸(19.37%)、肉豆蔻酸(4.57%)。较高含量油酸的摄入,能够软化血管、促进机体新陈代谢有利于健康[4]。亚油酸作为人体必需脂肪酸对人体心血管疾病具有较好的预防作用[5]。棕榈酸具有降血脂、抗动脉粥样硬化、抗血小板聚集以及抗血栓形成等作用[6]。
目前对于阿勒泰羊臀脂的研究多见于提取精炼、脂肪酸组成、贮藏及综合加工利用等方面[7-15],而对于阿勒泰羊臀脂及其分提产物的营养健康性研究却鲜有报道。故本研究以阿勒泰脂臀羊臀脂及其分提产物为实验材料,探讨脂臀羊臀脂及其不同分提产物的摄入对小鼠肝脏脂质水平和氧化应激的影响,初步探索阿勒泰脂臀羊臀脂及其分提产物对机体食用健康性可能产生的影响,为分提油脂的健康合理的运用提供理论依据,同时也为脂臀羊臀脂资源的开发和利用奠定生理学基础。
1 材料与方法
1.1 材料与仪器
阿勒泰脂臀羊臀脂 购自新疆乌鲁木齐华凌市场;福临门非转基因纯香菜籽油 市售;阿勒泰脂臀羊原脂、阿勒泰脂臀羊臀脂分提产物 自制;SPF级4周龄雄性昆明种(Kunming,KM)小鼠 平均体质量(18±3)g,购于新疆医科大学动物实验中心,实验动物通过新疆农业大学实验动物福利委员会批准,批准编号:2019019;低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)、甘 油 三 酯(Triglyceride,TG)、TG、HDL-C、SOD、MDA、TAOC、GSH-Px、CAT、蛋白定量测定试剂盒 南京建成生物科技有限公司。
DZF-6050LC真空干燥箱 上海齐欣科学仪器有限公司;DL-3010低温冷却液循环泵 上海市百典仪器厂;HS-S型组织切片机 沈阳恒松科技有限公司;HRS-22D高清恒染染色机 武汉汉谷医疗科技有限公司;Xmark酶标仪 伯乐生命医学产品(上海)有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 原脂及臀脂分提产物的制备 原脂的制备采用何鑫[3]的真空加热抽提法,置于真空干燥箱70 ℃、5 h粗提得到原脂(未分提的阿勒泰脂臀羊臀脂油),密封-20 ℃冻藏备用。
阿勒泰脂臀羊臀脂分提产物的制备:改进李涛[16]的溶剂法,以丙酮:原脂按2:1的比例置于冷却液循环泵中,设置温度32 ℃、恒温16 h,待其充分结晶真空后抽提得到32 ℃固脂;迅速将剩余液脂置于22 ℃冷却液循环泵中恒温16 h使其充分结晶后真空抽提得到22 ℃固脂;12 ℃、2 ℃固脂分提操作同22 ℃固脂。得到的32、22、12、2 ℃固脂减压挥发残余丙酮,密封-20 ℃冻藏备用。
1.2.2 小鼠灌胃剂量的设定 中国营养学会的统计结果显示,我国居民烹调油脂有5%~10%的居民高达95 g[17]。本研究采用魏伟[18]的方法以居民烹调油最高摄入量95 g折算为0.15 mL/10 g的灌胃剂量灌服小鼠。
1.2.3 动物实验分组 84只雄性KM小鼠基础饲料适应性饲喂1周,按空腹体重随机分为灌胃20 d和灌胃40 d两个批次,每批7组(n = 6),分别设为空白组、菜籽油组、原脂组、2 ℃固脂、12 ℃固脂、22 ℃固脂、32 ℃固脂组,自由采食饮水,单笼喂养。每日称重灌胃1次,环境温度维持在(22±2)℃,相对湿度50%~60%,每日12 h昼夜交替。
1.2.4 实验油脂灌胃方法 菜籽油常温下为液态,按照剂量直接灌服小鼠。原脂、32、22、12、2 ℃固脂在室温下呈固态,参照GB/T 12766-2008中方法对原脂、32、22、12、2 ℃固脂熔点进行了测定,熔点分别 为(39.46±0.75)℃、(47.83±0.53)℃、(41.13±0.69)℃、(39.50±0.62)℃、(25.30±0.65)℃。灌胃前依次根据熔点温度恒温水浴加热(1~2 min)至液态。12、2 ℃固脂熔化至液态后直接灌服小鼠,原脂、32、22 ℃固脂熔化后冷却至小鼠体温(38.0±1.0)℃后灌服小鼠(此时原脂、32、22 ℃固脂依旧为液态),空白组以基础饲料喂养,实验油脂组以基础饲料喂养+0.15 mL/10 g的油脂灌服小鼠。
1.2.5 样品采集及处理 分别在20、40 d结束后对小鼠禁食不禁水12 h,称重,乙醚麻醉后断颈处死解剖,剪取肝脏组织,生理盐水清洗表面血液,用滤纸拭干用于后续各项指标测定。
1.2.6 肝指数的测定 小鼠肝脏冲洗滤纸拭干后称重,记录肝脏湿重,用于计算肝指数。
1.2.7 肝脏组织病理学观察 取小鼠肝左叶于5%中性甲醛溶液中固定24 h,梯度脱水,浸蜡包埋,采用苏木精伊红染色法染色,置数码显微镜下进行病理学观察。
1.2.8 肝脏组织脂质含量及氧化应激指标测定 称取0.2 g肝组织,1:9加入预冷生理盐水,冰水浴匀浆制备10%的肝组织匀浆,4 ℃、3000 r/min离心10 min,吸取上清液,置于4 ℃冰箱保存,以待后续各项肝脏指标的检测。依据试剂盒标注的方法测定肝脏TC、TG、HDL-C、LDL-C、MDA、总蛋白含量以及SOD、T-AOC、GSH-Px、CAT活力。
1.3 数据处理
实验数据均以均值±标准差表示。采用SPSS 19.0统计软件包进行数据处理,相同时间多组间比较采用One way ANOVA检验,同组不同时间上差异对比采用配对样本T检验,以P<0.05为有统计学差异。
2 结果与分析
2.1 阿勒泰脂臀羊臀脂分提产物对小鼠肝指数的影响
肝脏指数是一项能够大体地初步判断肝脏病变程度的常用指标。如表1所示,肝指数在20 d和40 d时各组间均无显著性差异。随着摄入时间的增长,菜籽油组肝指数显著升高8.21%。本实验结果与雷红等[19]研究发现菜籽油使小鼠肝指数升高的结果一致。

表1 阿勒泰脂臀羊臀脂分提产物对小鼠肝指数的影响(%)Table 1 Effects of Altay sheep buttocks fat extract on liver index of mice(%)
2.2 阿勒泰脂臀羊臀脂分提产物对小鼠肝脏组织显微病理学的影响
对20 d和40 d小鼠肝脏组织解剖学观察发现,各组小鼠肝脏均色泽红润,大小正常,外形齐整,分叶清晰,肝叶边缘锐利,未见明显肿大、淤血、脂肪颗粒聚集等实质性损伤或病变。从图1和图2中可以看出,小鼠肝脏切片中,肝小叶位置、肝细胞索、门管区均可明显区分,肝细胞形态正常,细胞间隙适中,无明显脂肪组织的浸润,肝细胞无坏死,均未造成小鼠肝脏器质性病变。说明高膳食的菜籽油与原脂及其分提产物均不会造成小鼠肝脏组织器质性病变。孙宗扬等[20]以牛羊油脂0.2 mL/10 g的剂量灌胃小鼠研究发现牛羊油脂不影响小鼠肝脏正常结构,这与本实验中原脂组小鼠肝脏病理解剖学观察结果相近。
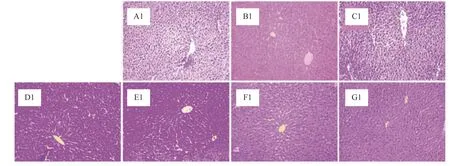
图1 阿勒泰脂臀羊臀脂分提产物对20 d小鼠肝脏组织病理学观察(200×)Fig.1 Histopathological observation of 20 d mice liver by the Altay sheep buttocks fat extract(200×)
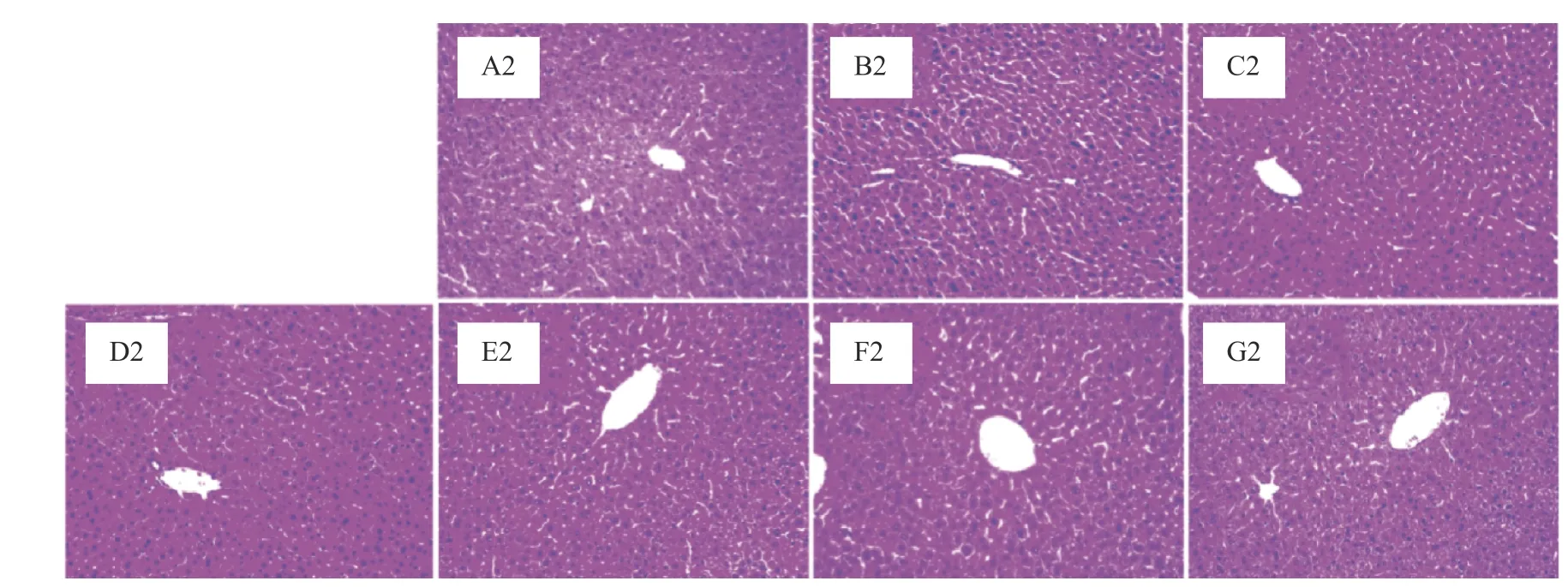
图2 阿勒泰脂臀羊臀脂分提产物对40 d小鼠肝脏组织病理学观察(200×)Fig.2 Histopathological observation of 40 d mice liver by the Altay sheep buttocks fat extract(200×)
2.3 阿勒泰脂臀羊臀脂分提产物对小鼠肝脏脂质水平的影响
肝脏是脂类代谢主要器官[21],在脂类合成的消化和吸收、合成、分解与运输中均具有重要作用。人体的TC主要是由肝脏合成,检测肝细胞中的TC含量可一定程度上反映肝脏合成内源性TC的总量,并间接反映机体TC的代谢情况[22]。储存在肝脏中的脂肪更多是TG,大量摄入的外源脂肪会增加肝脏中脂肪酸的合成、氧化紊乱、脂质分解和输出减少,均可引起TG在肝脏内的贮积[23]。肝脏中可将过量TG转变为脂滴,逐渐积聚并膨胀肝细胞,从而引起脂肪肝的发生[24]。通过检测肝细胞中TG的含量,可以在一定程度上反映肝细胞脂肪病变的状态。临床上以肝脏中的TC、TG、HDL-C、LDL-C基础指标检测肝脏脂质水平。
20 d肝脏脂质水平如表2所示,与空白组对比,菜籽油组、原脂组TC、LDL-C、HDL-C水平无显著差异(P>0.05),而TG水平显著降低(P<0.05),羊臀脂分提产物TC、TG水平均显著低于空白组(P<0.05),各组TC含量下降水平:12 ℃固脂组(31.31%)、2 ℃固脂组(20.20%)、22 ℃固脂组(12.12%)、32 ℃固脂组(10.10%),TG含量下降顺序:12 ℃固脂组(72.50%)、22 ℃固脂组(63.75%)、2 ℃固脂组(59.75%)、32 ℃固脂组(45.25%)、菜籽油组(15.50%)、原脂组(8.00%)。与菜籽油和原脂相比,羊臀脂分提产物组小鼠肝脏TC、TG水平均显著降低(P<0.05)。与原脂组相比,羊臀脂分提产物HDL-C、LDL-C含量无显著差异(P>0.05)。以上实验结果显示短时间内高剂量摄入菜籽油、原脂、2、12 ℃固脂均不会引起小鼠肝脏脂质水平异常,且12 ℃固脂较菜籽油和未分提的原脂更加有效促进小鼠肝脏内脂质的分解代谢从而具有有效控制肝脏脂质水平的特点。
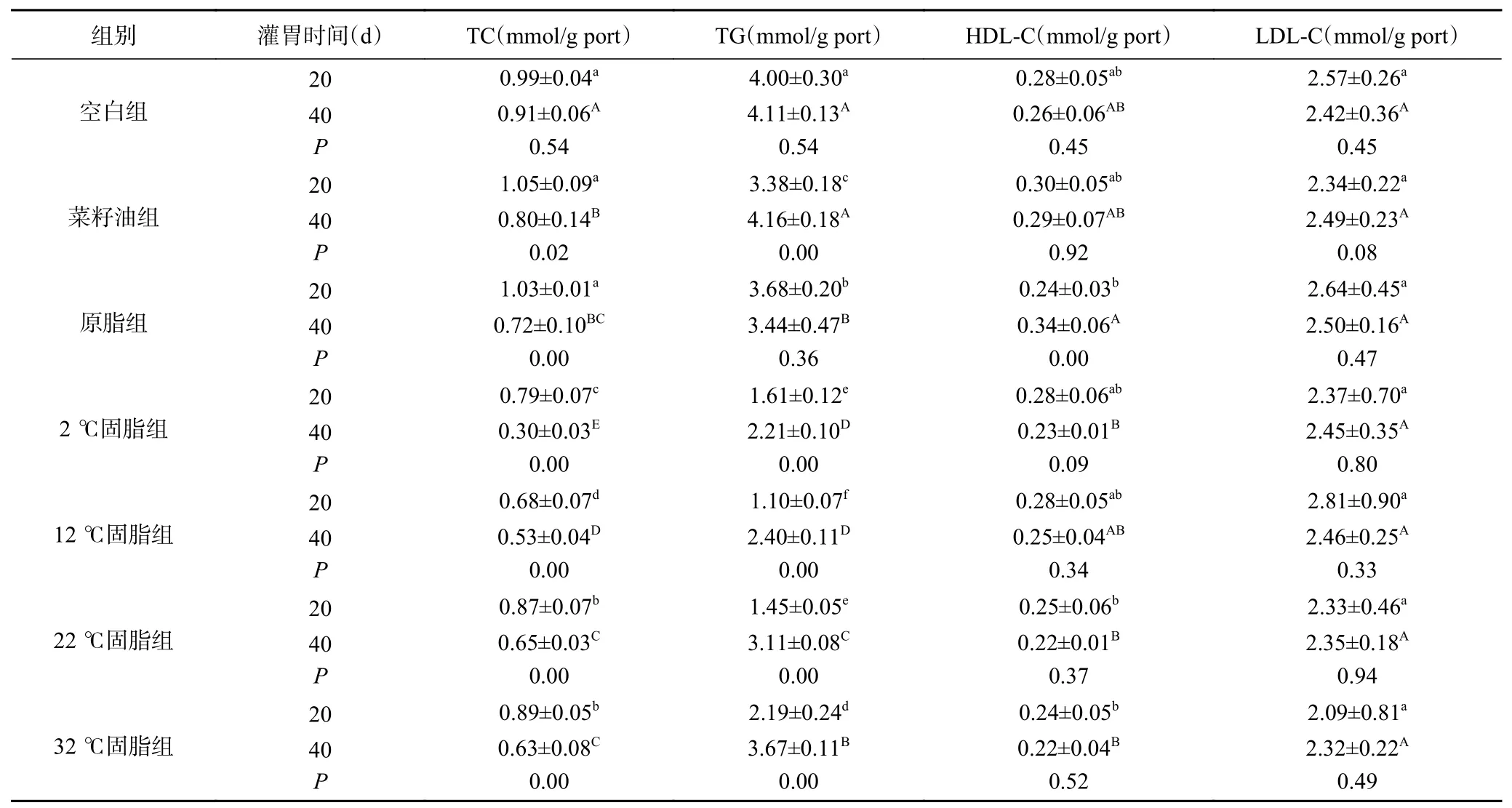
表2 阿勒泰脂臀羊臀脂分提产物对小鼠肝脏脂质水平的影响Table 2 Effects of Altay sheep buttocks fat extract on liver lipid level in mice
40 d肝脏脂质水平如表2所示,与空白组相比,实验油脂组肝脏HDL-C、LDL-C水平无显著差异(P>0.05),TC、TG水平均显著降低(P<0.05)。原脂组与菜籽油组相比,TG水平显著降低17.31%(P<0.05),TC水平下降10.00%但差异不显著。羊臀脂分提产物组与原脂组相比,除32 ℃固脂组无显著差异外其余各组TG水平均显著下降(P<0.05),分别 为:2 ℃固 脂 组(35.75%)、12 ℃固 脂 组(30.23%)、22 ℃固脂组(9.59%);2、12 ℃固脂组TC水平分别显著下降58.33%、26.39%(P<0.05)。羊臀脂分提产物组与菜籽油组相比,羊臀脂分提产物组TG、TC水平均显著降低(P<0.05)。羊臀脂分提产物组中,2 ℃固脂组TC、TG水平最低。以上实验结果说明长时间摄入高膳食的原脂及其分提产物可降低小鼠肝脏TC、TG水平,控制HDL-C水平降低;分提产物较菜籽油可有效降低小鼠肝脏脂质水平,其中2 ℃固脂效果更显著,推测这与2 ℃固脂含有较高的不饱和脂肪酸有关。长时间摄入高剂量的油脂对小鼠肝脏TC无显著影响,长时间摄入菜籽油会显著增高小鼠肝脏TG水平,而原脂相反。李萍[25]研究发现菜籽油的芥酸含量对机体的健康也有一定的影响,高芥酸含量的菜籽油会使大鼠血液及肝脏TG水平显著上升,与本实验中菜籽油显著升高小鼠肝脏TG水平的结果一致。
同组不同灌胃时间结果如表2所示,空白组小鼠肝脏脂质水平前后无显著变化。随着实验油脂摄入时间的增长,实验油脂组TC含量显著降低(P<0.05);原脂组小鼠TC水平显著下降30.09%(P<0.05),HDL-C水平显著升高41.67%;说明摄入时间的长短对肝脏脂质水平影响程度存在显著影响,随着摄入时间的增长,使原脂组TC显著降低、HDLC水平显著升高。低TC、高HDL-C有助于机体脂质代谢平衡[26],相比较菜籽油本实验中的原脂更有益于人体健康,可长期食用。
2.4 阿勒泰脂臀羊臀脂分提产物对小鼠肝脏氧化应激的影响
氧化应激是发生在自由基传递与抗氧化系统之间的平衡[27]。肝脏中过量的脂肪积累常伴随着抗氧化酶的下调从而引起氧化应激[28]。抗氧化酶是一组存在于细胞环境中的蛋白质,用以促进和调节体内抗氧化酶清除自由基[29]。肝脏也有几种抗氧化酶,如SOD、CAT、GSH-Px等抵御氧化应激过程中产生的自由基从而使机体免受氧化损伤[30-31]。SOD是一种重要的抗氧化酶,可以及时修复细胞并阻断脂质过氧化过程,抵抗和阻止多种氧自由基引起的损伤[32]。GSH-Px可促进机体中过氧化氢的分解,维持细胞膜结构和功能完整性,保护细胞免受氧自由基的破坏[33]。CAT是一种存在于红细胞及某些组织细胞的微粒体中的酶[34],其功能是将过氧化氢转化为水和氧气[35],使机体免受自由基损伤。研究发现,T-AOC的强弱可以反映体内抗氧化剂之间的相互协作能力以及机体的健康状况[36]。
20 d饲养小鼠肝脏氧化应激结果如表3所示,与空白组相比,菜籽油组、原脂组的CAT、GSHPx无显著变化,SOD活性显著上升27.79%、30.81%(P<0.05),T-AOC显著增强47.62%、52.38%(P<0.05),菜籽油组的MDA显著高于各实验组(P<0.05);臀脂分提产物组CAT、GSH-Px活性显著下降(P<0.05),2、12、22 ℃固脂组的SOD活性无显著差异(P>0.05),32 ℃固脂组T-AOC显著增强(P<0.05)。与菜籽油组对比,臀脂及其分提产物组MDA均显著降低(P<0.05);臀脂分提产物组间CAT差异不显著(P>0.05);2 ℃固脂组与12 ℃固脂组间SOD活性无显著差异(P>0.05),22 ℃固脂组的GSH-Px活性显著降低(P<0.05),32 ℃固脂组的T-AOC显著高于各组。说明短时间摄入原脂或分提产物均可减少小鼠体内MDA积累,虽然CAT、GSH-Px活力有所下降但肝脏中总抗氧化能力显著上调。
40 d饲养小鼠肝脏氧化应激结果如表3所示,与空白组相比,菜籽油组MDA含量最高(1.50±0.10),12 ℃固脂组MDA含量最低;原脂组GSH-Px、SOD显著上升14.57%、17.02%(P<0.05);32 ℃固脂SOD显著上升12.16%(P<0.05);与菜籽油组相比,2 ℃固脂组的CAT、SOD活性无显著差异(P>0.05),32 ℃固脂组的GSH-Px、T-AOC、SOD显著上升(P<0.05),2 ℃固脂的GSH-Px活性无显著差异(P>0.05);12 ℃固脂组T-AOC活性显著上升(P<0.05)。与原脂组相比,2、32 ℃固脂组的CAT活性无显著差异(P>0.05);32 ℃固脂GSHPx活性无显著差异(P>0.05)。说明长时间摄入菜籽油有升高MDA含量降低T-AOC使机体内脂质过氧化程度升高的风险,由于32 ℃固脂组SOD、CAT、GSH-Px活性及T-AOC水平较高,因此防止氧化损伤的作用更明显。
同一油脂不同摄入时间对小鼠肝脏氧化应激的影响如表3所示,随着试验油脂摄入时间的增长,32 ℃固脂组、22 ℃固脂组、菜籽油组的MDA含量均显著降低(P<0.05);2 ℃固脂组的小鼠肝脏CAT、GSH-Px活力显著升高47.29%、39.93%(P<0.05);12 ℃固脂组、22 ℃固脂组的小鼠肝脏CAT活力显著升高29.37%、26.67%(P<0.05);32 ℃固脂组的小鼠肝脏CAT、GSH-Px、SOD活力显著上升41.96%、25.61%、30.85%(P<0.05);原脂组的肝脏GSH-Px显著升高6.97%;MDA含量显著降低43.44%,其余指标均无显著变化(P>0.05)。从同一油脂不同摄入时间对小鼠肝脏氧化应激的影响分析可知,长时间摄入22 ℃固脂组、32 ℃固脂组均会使小鼠肝脏脂质过氧化物MDA含量下降,12 ℃固脂组、2 ℃固脂组摄入时间的长短对MDA含量无显著影响;32 ℃固脂组摄入时间的长短与清除氧自由基的SOD活力呈正相关,其中32 ℃固脂组摄入时间越长抗氧化酶SOD、CAT、GSH-Px活性越强。臀脂分提产物通过调节体内各种抗氧化酶类活性抑制自由基产生从而减少氧化损伤,这种抗氧化效果在小鼠短时间摄入和较长时间摄入都有所表现。在本试验中长时间摄入菜籽油组的小鼠肝脏GSHPx活性以及T-AOC均显著低于原脂组,这与孙海燕[37]的研究结果一致。
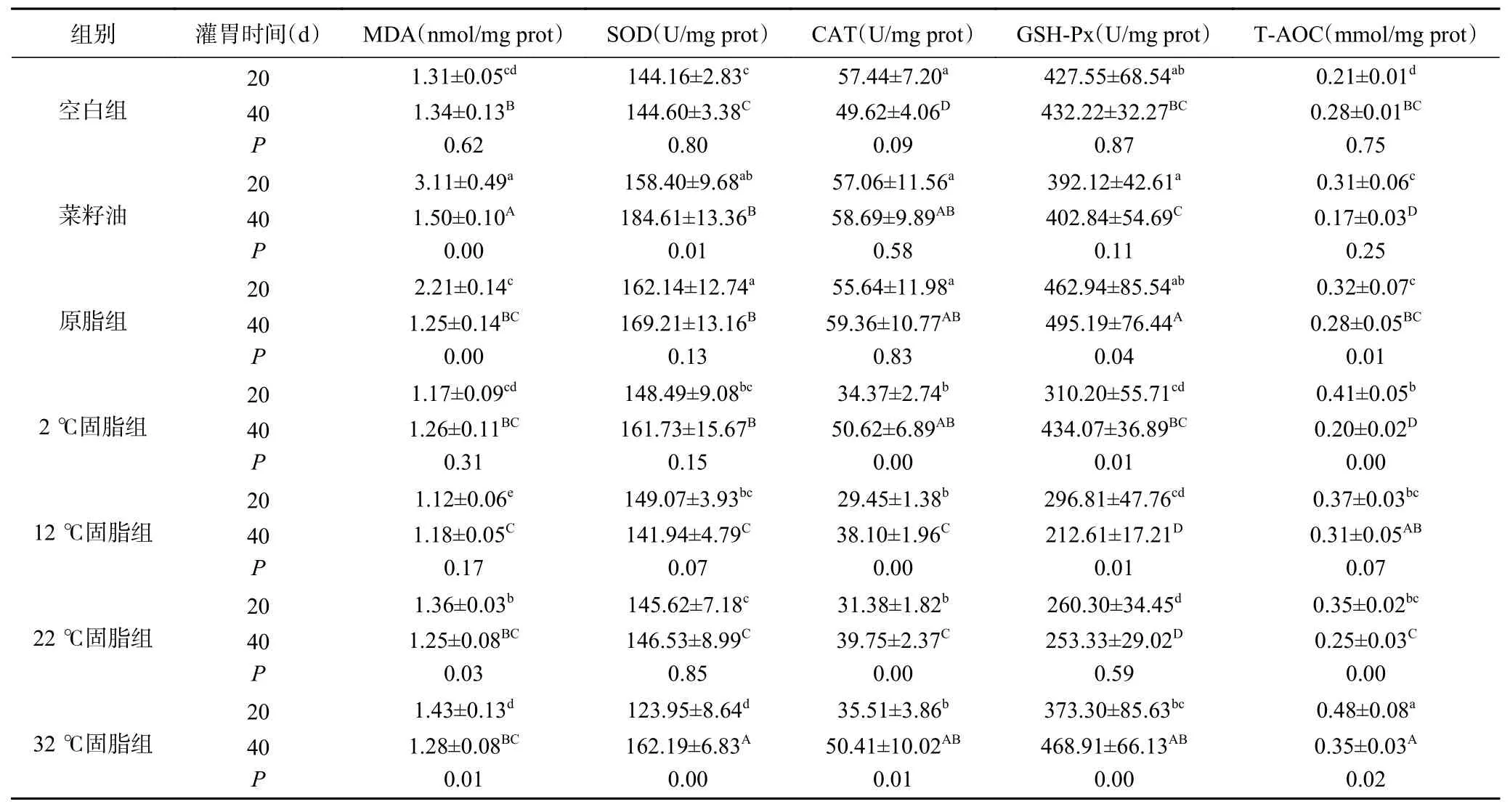
表3 阿勒泰脂臀羊臀脂分提产物对小鼠肝脏氧化应激的影响Table 3 Effects of Altay sheep buttocks fat extract on liver oxidative stress in mice
3 结论
本研究模拟我国部分人群油脂高摄入量,以未分提的臀脂和植物油中的菜籽油为对照,研究阿勒泰脂臀羊臀脂分提产物对高膳食油脂摄入的小鼠肝指数、肝组织病理变化、肝脏脂质代谢水平及氧化应激的影响。结合各项指标变化得出短时间内摄入菜籽油、原脂及其分提产物均不会引起小鼠肝脏脂质水平异常;原脂组TC含量随着摄入时间的增长显著降低而HDL-C含量显著上升;分提产物中2 ℃固脂降低小鼠肝脏脂质水平效果更显著;而长时间高剂量摄入菜籽油会使肝脏中TG含量上升、肝指数升高,造成肝脏脂质代谢异常的风险,不建议长期高剂量摄入菜籽油。羊臀脂分提产物通过调节体内各种抗氧化酶类活性抑制自由基产生从而减少氧化损伤,这种抗氧化效果在小鼠短时间摄入和较长时间摄入都有所表现,其中32 ℃固脂摄入时间越长抗氧化酶SOD、CAT、GSH-Px活性越强,防止氧化损伤效果越突出。
羊臀脂分提产物作为改性动物油脂,模拟人体长时间的高剂量摄入未对小鼠肝脏造成器质性损伤,具有控制小鼠肝脏脂质的上升、改善小鼠肝脏抗氧化酶活性、减少氧化损伤的效果。研究结果与人们通常意识里认为动物油脂的摄入会引起脂质代谢紊乱等疾病的观念不一致,启示动物油脂营养健康性的研究还需进一步的深入。
