LncRNA SNHG14/miR⁃148a⁃3p/PODXL轴在瘢痕疙瘩形成过程中的分子机制
2022-01-19李嫚温晓东张立燕刘军
李嫚 温晓东 张立燕 刘军
中国人民解放军联勤保障部队第九四一医院烧伤整形科(西宁810007)
瘢痕疙瘩是临床常见的一种皮肤纤维化疾病,其主要特征为成纤维细胞增殖过度与胶原等细胞外基质沉积过度,目前瘢痕疙瘩形成的分子机制尚未阐明,且缺乏有效治疗药物,手术切除后患者复发率较高且预后较差,因而探究瘢痕疙瘩的形成机制对寻找其有效治疗靶点具有重要意义[1-5]。LncRNA 在瘢痕疙瘩成纤维细胞中表达上调或下调,并可参与瘢痕疙瘩形成过程[6-10]。LncRNA SNHG14 在宫颈癌中表达水平升高,其高表达量与患者预后不良有关[11]。生物信息学分析显示SNHG14 与miR⁃148a⁃3p 存在结合位点,研究表明miR⁃148a⁃3p 在食管癌中表达水平降低,上调其表达可通过靶向DNMT1 抑制食管癌细胞增殖及转移[12]。生物信息学分析显示miR⁃148a⁃3p与Podocalyxin 样 蛋 白(podocalyxin⁃like protein,PODXL)存在结合位点,PODXL 属于唾液酸糖蛋白且属于CD34 家族成员,研究表明PODXL 在瘢痕疙瘩成纤维细胞中表达量升高,下调其表达可明显诱导细胞周期阻滞及细胞凋亡,并可抑制细胞增殖[13]。因此,本研究主要探讨SNHG14 是否可通过靶向调控miR⁃148a⁃3p/PODXL 轴而参与瘢痕疙瘩形成过程。
1 材料与方法
1.1 材料与试剂研究对象为2018年2月至2020年3月诊治的42 例皮肤瘢痕疙瘩患者,所有患者均经病理组织学检查确诊为瘢痕疙瘩,均为首次诊治的患者;未合并其他皮肤疾病或恶性肿瘤,其中男22例,女20例,年龄(38.56±3.65)岁。选取同期42 例良性皮肤疾病(皮肤外伤或植皮)患者为对照,其中男28 例,女14 例,年龄(38.18 ± 5.49)岁。两组研究对象年龄、性别比较差异无统计学意义,具有可比性。术中切除正常皮肤组织、瘢痕疙瘩组织后于液氮中速冻,然后转移至-80 ℃冰箱内保存。患者或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。人瘢痕疙瘩成纤维细胞购自中科院上海细胞库;DMEM 培养基购自美国Gibco;胎牛血清购自美国Hyclone;双荧光素酶报告基因检测购自美国Promega;MTT 试剂、RNA 提取试剂、蛋白提取试剂盒与山羊抗兔IgG 二抗购自武汉博士德生物;Lipofectamine2000、逆转录与荧光定量PCR 试剂购自美国Thermo Fisher;si⁃NC、si⁃SNHG14、miR⁃NC、miR⁃148a⁃3p mimics、anti⁃miR⁃NC、anti⁃miR⁃148a⁃3p 购自广州锐博生物;Transwell 小室、Matrigel 基质胶购自北京索莱宝;兔抗人PODXL 多克隆抗体购自武汉艾美捷科技;兔抗人ProcollagenⅠ单克隆抗体购自上海远慕生物;兔抗人α⁃SMA、Col1 抗体购自美国Pro⁃teintech。
1.2 方法
1.2.1 实验分组瘢痕疙瘩成纤维细胞用DMEM培养基于37 ℃培养箱内培养,待细胞融合度达到70%时用Lipofectamine2000 说明书对瘢痕疙瘩成纤维细胞进行转染,分别转染si⁃NC(si⁃NC 组)、si⁃SNHG14(si⁃SNHG14 组),转染6 h 后将无血清培养基更换为DMEM 完全培养基继续培养48 h。
1.2.2 qRT⁃PCR 检测SNHG14、miR⁃148a⁃3p 的表达水平用RNA 提取试剂盒提取正常皮肤组织、瘢痕疙瘩组织与各组瘢痕疙瘩成纤维细胞的总RNA,用cDNA 第一链合成试剂盒进行反转录合成cDNA,以2 μL cDNA 为模板,用SYBR Green 荧光定量PCR 试剂盒进行qPCR 扩增,SNHG14 以GAP⁃DH 为内参,miR⁃148a⁃3p 以U6 为内参,用2⁃ΔΔCt法计算SNHG14、miR⁃148a⁃3p 的相对表达量。
1.2.3 MTT 检测细胞增殖收集各组处理后的瘢痕疙瘩成纤维细胞,每孔分别加入20 μL MTT溶液,于37 ℃培养箱内培养4 h,弃培养液,每孔分别加入150 μL DMSO,室温振荡溶解5 min,用酶标仪检测各孔OD值(490 nm)。
1.2.4 平板克隆形成实验各组瘢痕疙瘩成纤维细胞培养2 周后收集细胞,预冷PBS 洗涤,用5%甲醛固定30 min,PBS 洗涤,用0.1%结晶紫染色液染色30 min,PBS洗涤,晾干后于显微镜下计数≥50个细胞的菌落数量。
1.2.5 Transwell 实验检测细胞迁移与侵袭转染后的各组瘢痕疙瘩成纤维细胞(1 × 106个/mL)分别加入预先铺制Matrigel 基质胶稀释液(侵袭实验)或未铺制Matrigel 基质胶稀释液(迁移实验)的小室的上室(200 μL/孔),其中重悬细胞所用培养基均为不含血清的培养基,小室的下室中分别加入600 μL 含有10%胎牛血清的培养液,于37 ℃培养箱内培养24 h 后取出小室,PBS 洗涤后多聚甲醛固定20 min,0.1%结晶紫染液染色10 min,于显微镜下计数。
1.2.6 双荧光素酶报告基因检测SNHG14 与miR⁃148a⁃3p 的靶向关系,以及miR⁃148a⁃3p 与PODXL的靶向关系将pmirGLO⁃WT⁃SNHG14与pmirGLO⁃MUT⁃SNHG14 分别与miR⁃148a⁃3p mimics 或其阴性对照(miR⁃NC)在Lipofectamine2000 的介导下共转染至瘢痕疙瘩成纤维细胞,48 h 后用双荧光素酶报告基因系统检测细胞中的荧光素酶活性。将pmirGLO⁃WT⁃PODXL 与pmirGLO⁃MUT⁃PODXL 分别与miR⁃148a⁃3p mimics 或其阴性对照(miR⁃NC)在Lipofectamine2000 的介导下共转染至瘢痕疙瘩成纤维细胞,48 h 后用双荧光素酶报告基因系统检测细胞中的荧光素酶活性。
1.2.7 Western blot 检测PODXL、ProcollagenⅠ、α⁃SMA、Col1 蛋白表达用蛋白提取试剂盒提取瘢痕疙瘩组织与正常皮肤组织以及各组瘢痕疙瘩成纤维细胞总蛋白,用BCA 法测定蛋白浓度,SDS⁃PAGE分离蛋白,将其转移至PVDF膜,5%脱脂奶粉封闭PVDF 膜1 h,加入稀释的PODXL(1∶1 000)、
Procollagen Ⅰ(1∶800)、α⁃SMA(1∶600)、Col1(1∶800)、GAPDH(1∶1 000)一抗4 ℃孵育过夜,加入稀释的二抗(1∶2 000)室温下孵育PVDF 膜1 h,ECL 显色试剂盒显影,ImageJ 软件分析目的条带与内参GAPDH 条带灰度值。
1.3 统计学方法采用SPSS 21.0统计学软件分析数据,计量资料以()表示且均符合正态分布,两组间比较采用独立样本t检验;Pearson 法检测瘢痕疙瘩组织中SNHG14 与miR⁃148a⁃3p 的相关性,以及miR⁃148a⁃3p 与PODXL 的相关性,以P<0.05为差异有统计学意义。
2 结果
2.1 瘢痕疙瘩组织与正常皮肤组织中SNHG14、miR⁃148a⁃3p 及PODXL 表达量比较与正常皮肤组织比较,瘢痕疙瘩组织中SNHG14 与PODXL 的表达量升高(P<0.05),miR⁃148a⁃3p 的表达量降低(P<0.05);Pearson 法检测瘢痕疙瘩组织中SN⁃HG14 与miR⁃148a⁃3p 的相关性,以及miR⁃148a⁃3p与PODXL 的相关性,结果显示,SNHG14 与miR⁃148a⁃3p呈负相关(r=-0.803 1,P<0.001),miR⁃148a⁃3p 与PODXL 呈负相关(r=-0.855 9,P<0.001),SNHG14与PODXL呈正相关(r=0.724 1,P<0.001),见图1-2 及表1。
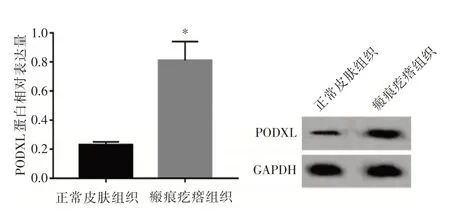
图1 Western blot 法检测PODXL 表达量Fig.1 Western blot was used to detect the expression of PODXL

图2 瘢痕疙瘩组织中SNHG14、miR⁃148a⁃3p 及PODXL 表达量之间的相关性分析Fig.2 Correlation analysis between SNHG14,miR⁃148a⁃3p and PODXL expression in keloid tissue
表1 瘢痕疙瘩组织与正常皮肤组织中SNHG14、miR⁃148a⁃3p 比较Tab.1 Comparison of SNHG14 and miR⁃148a⁃3p in keloid tissue and normal skin tissue ±s

表1 瘢痕疙瘩组织与正常皮肤组织中SNHG14、miR⁃148a⁃3p 比较Tab.1 Comparison of SNHG14 and miR⁃148a⁃3p in keloid tissue and normal skin tissue ±s
注:与正常皮肤组织比较,*P <0.05
组别正常皮肤组织瘢痕疙瘩组织t 值P 值SNHG14 1.00±0.07 2.51±0.56*17.340<0.001 miR⁃148a⁃3p 1.00±0.09 0.37±0.10*30.348<0.001
2.2 干扰SNHG14 表达对瘢痕疙瘩成纤维细胞增殖、克隆的影响与si⁃NC 组比较,si⁃SNHG14 组SNHG14 与PODXL 的表达量降低(P<0.05),miR⁃148a⁃3p 的表达水平升高(P<0.05),细胞活力降低(P<0.05),克隆形成数减少(P<0.05),见图3、表2。
表2 干扰SNHG14 表达对瘢痕疙瘩成纤维细胞增殖、克隆的影响Tab.2 The effect of interference with SNHG14 expression on the proliferation,cloning of keloid fibroblasts±s

表2 干扰SNHG14 表达对瘢痕疙瘩成纤维细胞增殖、克隆的影响Tab.2 The effect of interference with SNHG14 expression on the proliferation,cloning of keloid fibroblasts±s
注:与si⁃NC 组比较,*P <0.05
组别si⁃NC si⁃SNHG14 t值P值SNHG14 1.00±0.05 0.26±0.05*31.396<0.001 miR⁃148a⁃3p 1.00±0.07 2.94±0.43*13.359<0.001 OD值0.82±0.03 0.30±0.04*31.200<0.001克隆形成数(个)121.44±11.27 52.33±7.38*15.390<0.001

图3 Western blot 法检测PODXL 表达量Fig.3 Western blot was used to detect the expression ofPODXL
2.3 干扰SNHG14 表达对瘢痕疙瘩成纤维细胞迁移、侵袭及胶原合成相关蛋白表达量的影响与si⁃NC 组比较,si⁃SNHG14 组迁移与侵袭细胞数均明显减少(P<0.05),ProcollagenⅠ、α⁃SMA、Col1 蛋白水平降低(P<0.05),见图4、表3。
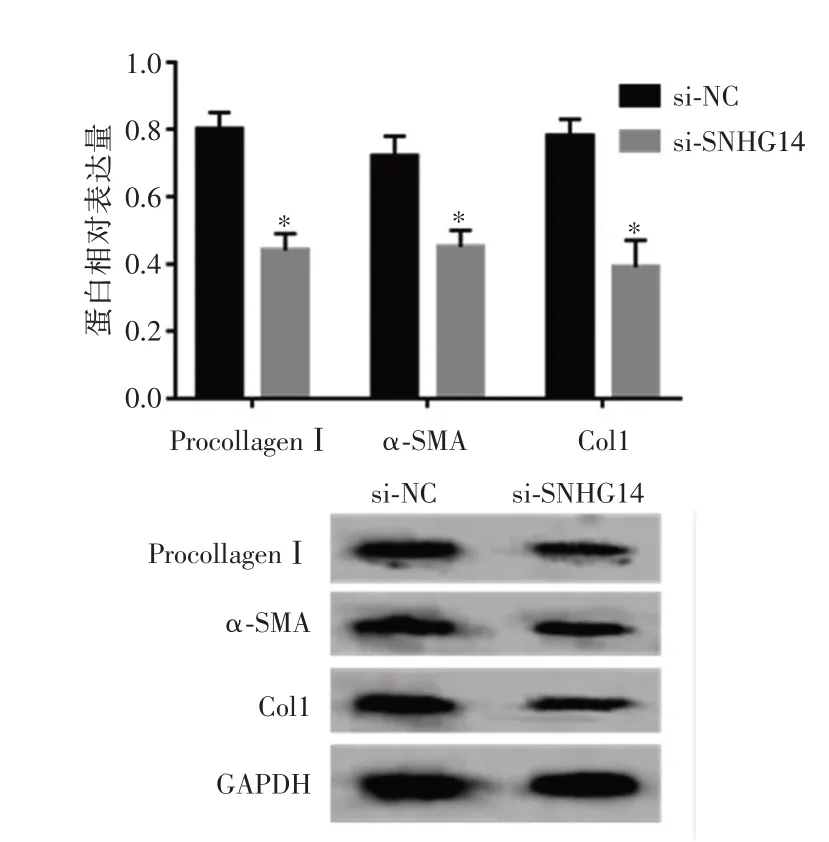
图4 Western blot 法检测Procollagen Ⅰ、α⁃SMA、Col1 表达量Fig.4 Western blot method was used to detect the expression of Procollagen Ⅰ,α⁃SMA,and Col1
表3 干扰SNHG14 表达对瘢痕疙瘩成纤维细胞迁移、侵袭的影响Tab.3 The effect of interference with SNHG14 expression on the migration and invasion of keloid fibroblasts±s

表3 干扰SNHG14 表达对瘢痕疙瘩成纤维细胞迁移、侵袭的影响Tab.3 The effect of interference with SNHG14 expression on the migration and invasion of keloid fibroblasts±s
注:与si⁃NC 组比较,*P <0.05
组别si⁃NC si⁃SNHG14 t 值P 值迁移细胞数(个)116.22±10.47 43.11±5.88*18.265<0.001侵袭细胞数(个)122.22±12.98 49.67±10.93*12.826<0.001
2.4 SNHG14 靶向调控miR⁃148a⁃3p,以及miR⁃148a⁃3p 靶向调控PODXLSNHG14 与miR⁃148a⁃3p 存在结合位点,miR⁃148a⁃3p 与PODXL 存在结合位点,见图5A、B。转染miR⁃148a⁃3p mimics 可降低含有WT⁃SNHG14 或WT⁃PODXL 的瘢痕疙瘩成纤维细胞的荧光素酶活性(P<0.05),而未能抑制含有MUT⁃SNHG14 或MUT⁃PODXL 的瘢痕疙瘩成纤维细胞的荧光素酶活性,见图5C。

图5 SNHG14 靶向调控miR⁃148a⁃3p,以及miR⁃148a⁃3p 靶向调控PODXLFig.5 SNHG14 targeted miR⁃148a⁃3p and miR⁃148a⁃3p targets PODXL
3 讨论
SNHG14 可通过调节miR⁃206/YWHAZ 分子轴促进宫颈癌的进展[14]。SNHG14 通过充当miR⁃613的竞争性内源RNA,调节膜联蛋白A2 的表达而促进胰腺癌细胞增殖及转移[15]。SNHG14 通过充当miR⁃655⁃3p 的竞争性内源RNA 促进子宫内膜癌细胞增殖[16]。本研究结果显示,瘢痕疙瘩组织SNHG14 的表达量升高,干扰SNHG14 表达后可明显降低瘢痕疙瘩成纤维细胞活力,还可促使克隆形成数减少,提示干扰SNHG14 表达可抑制瘢痕疙瘩成纤维细胞增殖及克隆形成。瘢痕疙瘩类似于肿瘤生物学特性,胶原蛋白生成量增多可造成局部皮肤纤维组织过度增生而促使病理性瘢痕的形成,Procollagen Ⅰ、α⁃SMA、Col1 在瘢痕疙瘩中表达量升高,抑制其表达可能抑制胶原蛋白合成,减少细胞外基质沉积[17-18]。本研究结果显示,干扰SNHG14 表达后瘢痕疙瘩成纤维细胞迁移与侵袭细胞数均明显减少,Procollagen Ⅰ、α⁃SMA、Col1 蛋白水平降低,提示干扰SNHG14 表达可抑制瘢痕疙瘩成纤维细胞迁移、侵袭及胶原蛋白合成,进而减少细胞外基质沉积。
为进一步探究SNHG14 在瘢痕疙瘩形成过程中的分子机制,本研究证实SNHG14 可靶向结合miR⁃148a⁃3p,瘢痕疙瘩组织中miR⁃148a⁃3p 的表达量降低,且SNHG14 与miR⁃148a⁃3p 呈负相关,而干扰SNHG14 表达后miR⁃148a⁃3p 的表达水平升高,提示干扰SNHG14 表达可能通过靶向调控miR⁃148a⁃3p而参与瘢痕疙瘩形成过程。研究表明miR⁃148a⁃3p 主要通过靶向c⁃Met 抑制上皮性卵巢癌的进展[19]。miR⁃148a⁃3p通过调控ERBB3/AKT2/c⁃myc和DNMT1 而抑制膀胱癌细胞增殖[20]。LncRNA SNHG4 通过靶向miR⁃148a⁃3p 调节c⁃Met 促进宫颈癌的进展[21]。进一步研究发现瘢痕疙瘩组织中miR⁃148a⁃3p与PODXL呈负相关,SNHG14与PODXL呈正相关,瘢痕疙瘩组织中PODXL 的表达量升高,干扰SNHG14 表达后PODXL 的表达量降低。研究表明NNT⁃AS1 通过靶向miR⁃1301⁃3p/PODXL轴并激活Wnt 途径而促进膀胱癌细胞的生长[22]。LncRNA BBOX1⁃AS1 通过靶向miR⁃361⁃3p 而增强PODXL 表达从而促进卵巢癌的发展[23]。本研究结果提示SNHG14 可能通过调控miR⁃148a⁃3p/PODXL轴而促进瘢痕疙瘩形成。
综上所述,瘢痕疙瘩组织SNHG14 与PODXL的表达量升高,而miR⁃148a⁃3p 的表达量降低,干扰SNHG14 表达可通过促进miR⁃148a⁃3p 表达而抑制PODXL 表达从而抑制瘢痕疙瘩成纤维细胞增殖、克隆形成、迁移、侵袭及胶原蛋白合成。下一步将进行体内动物实验证实SNHG14/miR⁃148a⁃3p/PODXL 轴在瘢痕疙瘩生长进程中的作用机制。
