内质网应激蛋白GRP78在脑出血后星形胶质细胞炎性活化中的作用及机制
2022-01-19张春阳郭振委何效兵周芯羽
张春阳 郭振委 何效兵 周芯羽
南京医科大学连云港临床医学院(连云港市第一人民医院)神经内科(江苏连云港222002)
自发性脑内出血(intracerebral hemorrhage,ICH)是一种严重的致死性卒中亚型,占所有卒中患者的10% ~ 15%[1]。炎症在ICH 引起的脑损伤中起着重要作用[2]。探讨炎症反应在ICH 中的机制有重要意义。星形胶质细胞是中枢神经系统中最丰富的细胞,其在脑出血后几分钟内被激活,并通过建立最终导致神经变性的前馈炎症环路在神经炎症期间发挥神经毒性作用[3]。因此,星形胶质细胞在ICH 的发生发展中起着至关重要的作用,研究其作用机制对ICH 的治疗具有重要意义。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)是一种多功能蛋白,主要表达于内质网(endoplas⁃mic reticulum,ER)内腔[4]。GRP78 作为ER 的主要伴侣和ER 应激信号的主要调节者,通过控制蛋白质折叠和组装、防止蛋白质聚集来调节未折叠蛋白反应(unfolded protein response,UPR)[5]。目前认为,GRP78 参与多种神经退行性疾病,包括阿尔茨海默病、亨廷顿病、肌萎缩侧索硬化和帕金森病等[6]。此外,活化的星形胶质细胞被认为有助于神经退行性变,它们的数量与神经退行性变过程中持续的损伤有关[7]。然而,尚未明确GRP78 是否在星形胶质细胞炎性活化中发挥作用,目前国内关于此类研究较少。因此,本研究建立了ICH小鼠模型和体外LPS 诱导的星形胶质细胞的炎症模型,探讨了GRP78 在星形胶质细胞炎性活化中的作用。
1 材料与方法
1.1 动物及ICH 模型建立8 周龄雄性CD1 小鼠(体质量约30 ~ 40 g)购自北京维通利华实验动物技术有限公司。小鼠在手术前至少3 d被饲养在温度和湿度受控以及12 h光/暗循环的房间中,能自由进食和饮水。参照文献方法通过自体全血注射诱导ICH[8]。具体操作为:小鼠用氯胺酮(100 mg/kg)和甲苯噻嗪(10 mg/kg)(2∶1 v/v,腹腔注射)麻醉并俯卧在Kopf立体定向头架(美国CA公司)。在手术过程中使用人工泪液软膏(德国海露公司)保持小鼠眼睛湿润。将动脉血收集在非肝素化毛细管中,立即转移到250 μL Hamilton 注射器上的27 号针头中。钻出一个1 mm 的颅骨钻孔,并将Hamilton注射器立体定向地插入右侧基底神经节(坐标:前囟后0.2 mm,前囟外侧2.2 mm 和硬脑膜下方3.5 mm)。使用Stoelting 微型输液泵(美国Holliston公司)将总体积为30 μL 的血液输注到右侧基底神经节中,并在注射完成后,将针头留在原位5 min以防止可能的泄漏,然后以1 mm/min 的速度缓慢撤回。颅骨钻孔用骨蜡封闭,缝合头皮切口。皮下注射0.4 mL 生理盐水以避免术后脱水。在密切观察下使小鼠从麻醉中完全恢复。假手术是按照相同的程序进行的,没有注射全血。
1.2 实验分组在本研究中,所有小鼠都被随机分配到以下实验中。(1)为了评估ICH 后脑中内源性GRP78 表达的时间过程,将42 只小鼠随机分为7 组(n=6/组):分别为假手术、ICH 后3、6、12、24、48、72 h 组。采用Western blot 检测各组血肿周围区域GRP78 的表达。(2)为了评估GRP78 靶向抑制剂HA15 在ICH 中的神经保护作用,将36 只小鼠随机分为3 组(n= 12/组):假手术、ICH + 载体(PBS)、ICH + HA15。HA15(美国MCE 公司)溶于PBS 中,并在ICH 后1 h 鼻内施用HA15(剂量为0.5 μg/kg)。在ICH 后24、72 h 评估神经行为测试和脑水含量,每个时间点每组各分配6 只小鼠进行测定。(3)为了评估用HA15 抑制GRP78 对ICH后24 h 神经炎症和神经凋亡的影响,将54 只小鼠随机分为3 组(n= 18/组):假手术、ICH + 载体(PBS)和ICH+HA15(0.5 μg/kg)。在ICH 后1 h 鼻内施用HA15。在ICH 后24 h,进行神经胶质纤维酸性蛋白(GFAP)的免疫荧光染色(n= 6/组)以计数血肿周围区域的GFAP 阳性细胞(20 ×,平均来自3 个视野/切片,10 个切片/鼠标)。使用双标记免疫荧光染色评估GRP78 的星形胶质细胞定位(n= 6/组),并计数血肿周围区域的GFAP+GRP78+细胞(20 ×,平均来自3 个视野/切片,10 个切片/鼠标)。使用TUNEL 法评估神经元凋亡(n=6/组),并计数血肿周围区域的TUNEL 阳性染色神经元(40 ×,平均来自3 个视野/切片,10 个切片/鼠标)。(4)为了评估用HA15 抑制GRP78 对ICH 后24 h 血肿周围区域ER 形态学变化和应激情况,将总共24 只小鼠随机分为3 组(n= 8/组):假手术、ICH+载体(PBS)、ICH+HA15(0.5 μg/kg)。在ICH后1 h 鼻内施用HA15。在ICH 后24 h,各取2 只小鼠进行透射电镜观察脑组织形态学变化。每组其余6 只小鼠取血肿周围区域组织,进行Western blot 分析ER 应激的经典下游标志物Caspase 12 和CHOP 蛋白表达。
1.3 短期神经行为评估在ICH 后24、72 h,使用改良的Garcia 评分测试、前肢放置测试和转角测试评估短期神经行为功能[9]。
1.4 脑含水量测量通过湿/干方法测量脑含水量[10]。
1.5 透射电子显微镜观察ER结构小鼠麻醉后用经心灌注0.1 mol/L PBS,再灌注4%多聚甲醛(pH 7.4)。获得1 mm3的血肿周围区域组织,并浸泡在4 ℃2.5%戊二醛溶液(pH 7.40)固定24 h。随后,将组织放入1%四氧化锇中1 h,并用一系列分级乙醇对组织进行脱水。再将组织浸入环氧丙烷和树脂(1∶1)的混合物中。4 h后,将组织埋入树脂中,并切割成100 nm 截面,使用4%醋酸铀酰(20 min)和0.5%柠檬酸铅(5 min)染色。最后用TECNAI10 透射电镜(德国Philips 公司)观察脑组织的ER 结构。
1.6 免疫组化对于体内实验,将小鼠麻醉并随后用4%多聚甲醛灌注。取出大脑并在4%多聚甲醛中固定[10]进行免疫组化。
1.7 Western blot 分析将组织或细胞用1×RIPA缓冲液匀浆,在4 ℃下以14 000 ×g 离心10 min,并通 过Bradford 方 法 测 量 上清液蛋白质[11],进行Western blot 分析。
1.8 统计学方法使用Graph Pad Prism 进行统计分析。计量数据表示为均数±标准差。使用单向方差分析(ANOVA)和Tukey 事后分析对多重比较进行统计分析。P<0.05为差异有统计学意义。
2 结果
2.1 ICH后GRP78在大脑皮层中的表达水平与假手术组相比,脑出血小鼠血肿周围区域中GRP78水平在ICH 后3 h 开始上升,并在24 h 达到最高(P<0.05)。见图1。

图1 ICH 后血肿周围区域GRP78 时间进程的代表性蛋白质印迹图像和定量分析Fig.1 Representative Western blot images and quantitative analysis of GRP78 time course in the area around hematoma after ICH
2.2 HA15 抑制GRP78 可改善ICH 后神经行为缺陷并减少脑水肿在ICH 后24 h 和72 h,与假手术组相比,ICH 小鼠的神经行为评分显著更低,脑水肿更高。在ICH 后24 h 和72 h,与ICH+PBS 组相比,ICH+HA 组小鼠神经功能缺损显著改善(P<0.05),并且基底神经节和皮质的脑水肿显著降低(P<0.05),见图2。

图2 HA15 对ICH 后24 h 和72 h 的神经行为测试、脑水含量的影响Fig.2 Effect of ha15 on neurobehavioral test and brain water content 24 and 72 hours after ICH
2.3 HA15 抑制ICH 后星形胶质细胞增生和神经细胞凋亡由于ICH 后星形胶质细胞增生与神经功能缺损、神经炎症和细胞凋亡密切相关,因此研究进行了GFAP的免疫荧光以评估ICH后24 h星形胶质细胞增生。与假手术组相比,ICH+PBS组小鼠血肿周围区域星形胶质细胞明显增加(P<0.05)。然而,这种效果在HA 治疗的ICH 小鼠中被部分逆转(图3A)。此外,免疫双染显示,ICH + PBS 组小鼠血肿周围区域GFAP + GRP78+细胞较假手术组显著增加(P<0.05),而HA治疗后GFAP+GRP78+细胞显著下调(P<0.05,图3B)。细胞凋亡是ICH引起损伤的标志,TUNEL 染色显示ICH+PBS 组小鼠血肿周围区域TUNEL 阳性神经元的数量显著增加(P<0.05),这种效应在HA 治疗的ICH 小鼠中被部分消除(图3C)。
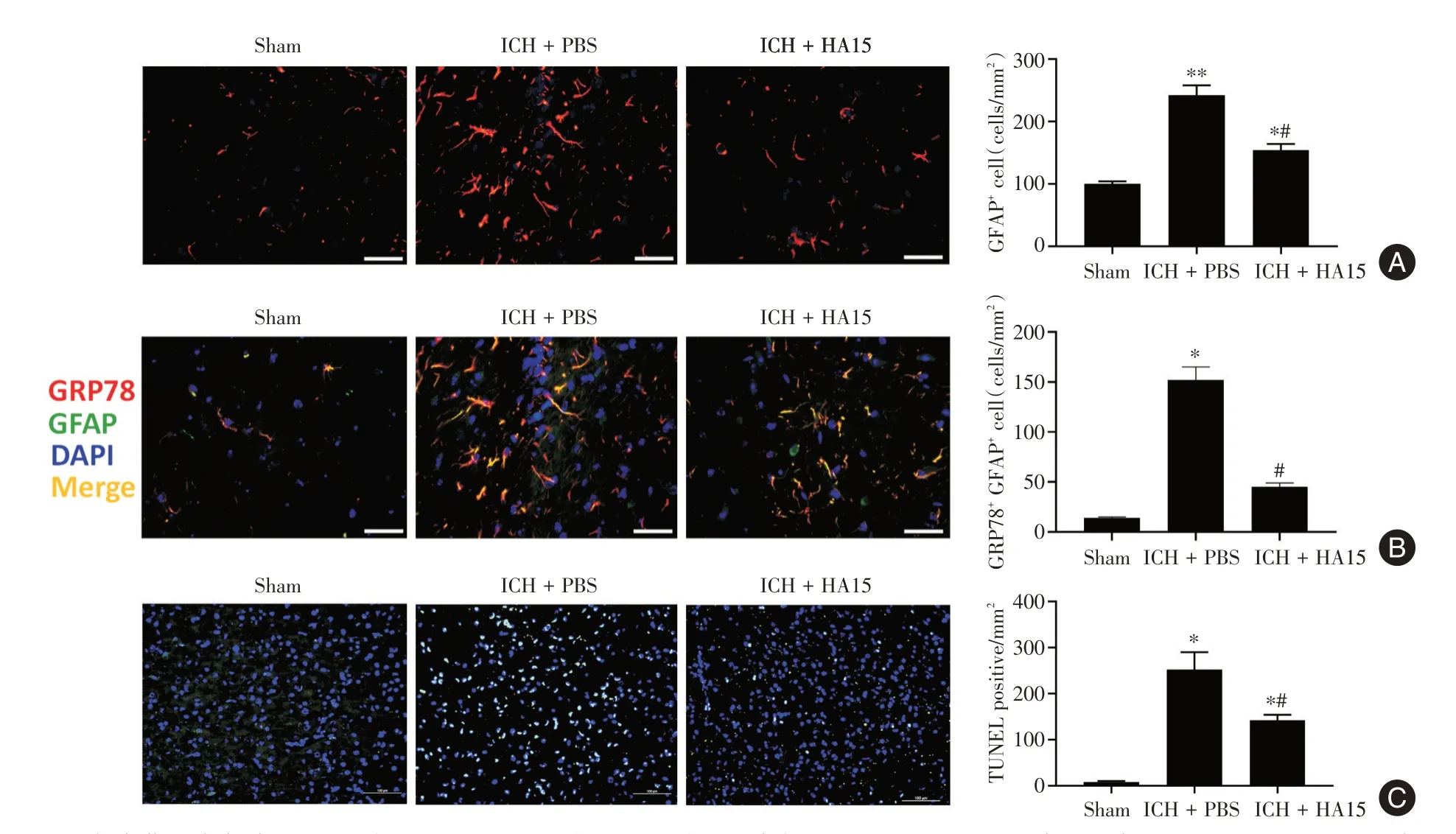
图3 HA15 对ICH 大脑的神经保护作用Fig.3 neuroprotective effect of ha15 on ICH brain
2.4 ICH 诱导后24 h 血肿周围区域ER 形态学变化和应激情况TEM显示,与假手术组相比,ICH组在ICH 后24 h 血肿周围区域中破裂和肿胀ER 增加,而HA15 处理减少了破裂和肿胀ER(图4A)。Caspase 12 和CHOP 是ER 应激的经典下游标志物,它们在ICH 后24 h 血肿周围区域中被强烈激活或升高,而HA15 处理减少了二者表达(图4B、C)。

图4 ICH 诱导后24 h 血肿周围区域ER 形态学变化和应激情况Fig.4 Er morphological changes and stress in the area around hematoma 24 hours after ICH induction
3 讨论
本研究探讨了GRP78 激活在小鼠ICH 后神经炎症中的作用,结果发现:(1)在血肿周围区域中GRP78 的内源性表达在ICH 发生后逐渐增加并在24 h 后达到峰值。(2)GRP78 靶向抑制 剂HA15(0.5 μg/kg)在ICH 后1 h 鼻内给药显著改善神经功能缺损和减少脑水肿,并减少星形胶质细胞增生、神经细胞凋亡和ER 应激。(3)体外LPS 诱导的星形胶质细胞的炎症模型显示HA15 通过抑制星形胶质细胞中GRP78 表达,抑制星形胶质细胞中ER 应激和促炎细胞因子分泌,进而保护神经元免受LPS 诱导的损伤。这初步阐述了ICH 发病中ER应激的意义。
近年来,许多研究表明,ER 应激介导的细胞凋亡在ICH 出血后早期脑损伤中起重要作用[13]。ER 是一种主要控制蛋白质合成和进一步加工的细胞器。炎症、氧化应激、线粒体钙超载通过干扰ER 功能引起ER 应激[14]。ER 应激的过度激活导致ER 中错误折叠蛋白水平的升高和积累。GRP78作为ER应激的主要效应分子,其在非ER应激条件下,可以与三个主要ER 应激传感器(PERK、ATF6和IRE1)的ER 内端结合,保持它们的非活动状态[5]。在ER应激过程中,GRP78与这三个分子分离。本研究表明,GRP78 蛋白表达在ICH 后24 h 内逐渐增加,表明ER 应激可能在ICH 后被持续激活。然而,当发生过量的ER应激时,细胞的正常功能将无法恢复,导致转录因子CCAAT/增强子结合蛋白同源蛋白(CHOP)上调,激活Caspase⁃12 介导的细胞凋亡途径[15]。此外,转录因子CHOP 可以下调抗凋亡Bcl⁃2 蛋白并增加促凋亡Bax 蛋白的表达。本研究结果表明,在ICH 小鼠模型中,Caspase 12和CHOP 表达显著上调,而HA15 可以减少过量的ER应激,表现为Caspase 12 和CHOP 表达降低。噻唑苯磺酰胺化合物HA15 是GRP78 的新型抑制剂,已被证明结合并抑制必需的ER 伴侣GRP78,可强烈抑制ER 应激途径[16-18]。
因此,GRP78 蛋白通过介导过量的ER 应激参与ICH 脑损伤。本研究较好阐述了ER 应激在ICH中的具体作用途径及机制,有助于进一步了解ICH脑损伤的病理生理过程,从而为预防该疾病提供策略。ICH损伤会刺激星形胶质细胞的损伤和促炎细胞因子的释放,如TNF⁃α、IL⁃1β 和IL⁃6[17]。星形胶质细胞有助于神经炎症过程,已成为未来治疗方法的一个有吸引力的靶标[18]。整体研究结果显示GRP78 介导的星形胶质细胞激活与ICH 神经元存活和脑功能恢复密切相关[19-20]。
总之,本研究结果表明ER 应激蛋白GRP78 通过介导星形胶质细胞炎性活化参与ICH 后神经损伤。GRP78靶向抑制剂HA15可能对ICH 后神经元存活产生积极影响,应进一步研究其作用机制。本研究可进一步深入研究临床药物干预ER 应激的可能,为以后治疗ICH脑损伤提供途径。
