孕妇血清IL-6、sVEGFR-1预测早发型胎儿生长受限最佳分娩时机的临床价值*
2022-01-19文精灵
王 艳,焦 波,文精灵
海南省三亚市妇幼保健院产科,海南三亚 574000
胎儿生长受限(FGR)具有较高的死胎或胎儿窒息风险以及较差的围生期结局[1];FGR若发生在妊娠32周及以前则诊断为早发型FGR,其与晚发型FGR在临床表现、与子痫前期的关系、胎儿结局等方面有所不同[2]。早发型FGR增加了早产胎儿窒息的风险,且更易发生早产儿并发症,因此,选择最佳分娩时机对于平衡胎儿和新生儿风险至关重要[3]。目前,对于早发型FGR的评估标准尚未达成一致意见,寻找有助于准确识别早发型FGR的孕妇在2周内分娩风险的血清分子生物标志物尤为重要。早发型FGR胎盘血流灌注明显中断,进而诱导胎盘中凋亡颗粒的大量分泌。此外FGR孕妇胎盘膜厚度增加和表面积减少可能导致氧分子在胎盘膜上的扩散受损及分布减少,促使活性氧簇在细胞内毒性积累,进而刺激促炎细胞因子的释放,引起细胞损伤甚至凋亡[4]。这些潜在的病理改变机制为寻找有效的FGR生物标志物提供了理论基础。因此,笔者推测母体血清中的某些细胞因子水平变化可能提示胎儿缺氧或母体子痫前期引起的早发型FGR。本研究旨在利用悬浮芯片技术分析早发型FGR孕妇血清细胞因子谱,并最终筛选可用于预测早发型FGR孕妇分娩时机的有效因子。
1 资料与方法
1.1一般资料 收集2020年4-12月162例在本院经产前诊断为早发型FGR的单胎妊娠孕妇作为FGR组,另外选择20例胎儿发育正常的妊娠26~32周的孕妇作为对照组。2组孕妇年龄、孕周相匹配。纳入标准:(1)自然受孕的单胎妊娠;(2)根据SHINOZUKA等[5]报道的公式估计胎儿体质量(包括胎儿双顶叶直径、胎腹围和胎儿股骨长度),以妊娠26~32周估计胎儿体质量(EFW)低于同孕龄第3百分位数和脐动脉多普勒搏动指数(PI)>95%作为早发型FGR的诊断标准;(3)孕妇末次月经时间或孕周明确。排除标准:(1)多胎妊娠;(2)胎儿存在染色体异常或先天性畸形;(3)合并其他自体免疫性疾病、肾脏疾病、恶性肿瘤或长期高血压的孕妇;(4)既往有剖宫产或其他生殖系统手术史者;(5)未在本院生产者。本研究方案经本院医学伦理委员会批准,所有孕妇均签署知情同意书。
1.2方法
1.2.1标本采集 在就诊当天采集所有孕妇血液标本5 mL,置于无菌试管中,4 ℃以3 800 r/min离心10 min,回收无细胞上清液,-80 ℃保存待测。
1.2.2方案1 随机选择FGR组与对照组各20份血清标本,采用Bio-Plex Pro悬液芯片技术及Bio-Plex Pro多重芯片试剂盒检测血清细胞因子谱,方法如下:标准样品和样品使用样品稀释剂稀释。以重组标准品为原料,制备了8点标准曲线。将稀释后的标准品、对照组、空白组和待测标本加入到96孔板中,把涂层抗体连接到荧光标记的微珠上。将96孔板在室温黑暗中恒温孵育1 h,每个平板洗涤3次,每个平板加入一个探测器,平板在室温下摇晃30 min。在每个孔井里加入链霉亲和素-藻红蛋白,在室温下黑暗中孵化10 min。微珠被悬浮在125 μL的缓冲液中,利用Bio-Rad Bio-Plex 200悬浮芯片系统对其进行量化。采用Bio-Plex处理器6.1软件对每份标本进行自动分析和处理。采用斜交旋转对血清各细胞因子进行分析,根据细胞因子载荷的强弱推断潜在的与FGR相关的细胞因子,选择载荷≥0.6或≤-0.6的细胞因子(载荷范围-1~1,表示与观察变量相关的回归系数)用于ELISA试剂盒检测。对于差异有统计学意义(P<0.05)的细胞因子,用于方案2大样本检测。
1.2.3方案2 FGR组剩余标本(142例)采用ELISA检测血清细胞因子水平,包括白细胞介素-6(IL-6)、IL-8、血管内皮生长因子A(VEGF-A)、肿瘤坏死因子-α(TNF-α)、可溶性Fas配体(sFasL)、可溶性血管内皮生长因子受体-1(sVEGFR-1)、胎盘生长因子(PLGF)、瘦素、可溶性CD40配体(sCD40L)、表皮生长因子(EGF)、胰岛素样生长因子结合蛋白-1(IGFBP-1)、细胞膜糖蛋白(CD105)、肝素结合EGF样生长因子(HB-EGF)、转化生长因子α(TGF-α)、尿激酶型纤溶酶原激活剂(uPA)、血小板衍生生长因子(PDGF)、纤维蛋白溶酶原激活物抑制因子-1(PAI-1)、可溶性表皮生长因子受体(sEGFR)、血管生成素-2(Ang-2)、碱性成纤维细胞生长因子(FGF)。
1.2.4分娩结局及分组 FGR组均在本院产科行超声检查评估羊水量,每隔24~72 h进行脐动脉和静脉导管多普勒超声检查(无或反向舒张末期血流速度),以确定胎儿最佳分娩时间。孕妇入院至少每天进行心电图监测。追踪所有孕妇的分娩结局,将方案1及方案2中FGR孕妇及新生儿均根据分娩时间分为诊断FGR 2周后分娩组、诊断FGR 2周内分娩组。小于胎龄儿(SGA)为出生体质量低于同胎龄和同性别平均体质量第10百分位数的新生儿。严重SGA被定义为出生体质量低于同胎龄和同性别第3百分位数[6]。
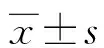
2 结 果
2.1方案1孕妇一般资料比较 根据分娩时间,20例早发型FGR孕妇分为诊断FGR 2周后分娩组6例、诊断FGR 2周内分娩组14例。诊断FGR 2周后分娩组6例中,1例发生子痫前期,1例在分娩时舒张末期静脉血流速度发生逆转,1例胎心监护CTG异常。诊断FGR 2周内分娩组14例中,6例发生子痫前期,其中1例出现羊水过少;8例出现胎儿问题,其中3例羊水过少,2例在分娩时舒张末期静脉血流速度发生逆转,7例胎心监护CTG异常。3组孕妇年龄、孕前体质量指数(BMI)、初产妇比例、采样孕周及新生儿性别比例差异无统计学意义(P>0.05)。FGR孕妇2亚组与对照组比较,早发型FGR孕妇早产比例、子痫前期比例及新生儿SGA、严重SGA 5 min Apgar评分<7分的比例均高于对照组(P<0.05),早发型FGR孕妇分娩孕周、新生儿出生体质量均低于对照组(P<0.05),见表1。

表1 方案1孕妇一般资料
2.2方案1孕妇血清细胞因子分布及血清细胞因子谱分析 采用斜交旋转对血清各细胞因子进行分析,结果显示,IL-6、VEGF-A、IL-8、TNF-α、sFasL与羊水过少有关;sVEGFR-1、PLGF、瘦素与子痫前期因素有关;sCD40L、EGF与胎心监护异常因素有关;IGFBP-1则与脐动脉或导管静脉舒张末期血流缺失/逆流因素有关,见图1、表2。

图1 斜交旋转分析孕妇血清细胞因子谱的因子空间样本图

表2 方案1孕妇血清细胞因子谱斜交旋转分析因子载荷结果
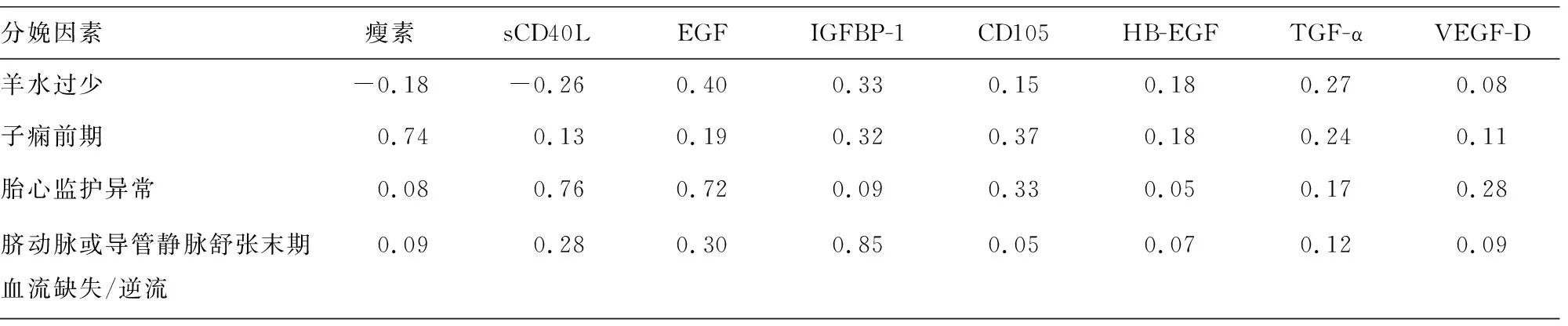
分娩因素瘦素sCD40LEGFIGFBP-1CD105HB-EGFTGF-αVEGF-D羊水过少-0.18-0.260.400.330.150.180.270.08子痫前期0.740.130.190.320.370.180.240.11胎心监护异常0.080.760.720.090.330.050.170.28脐动脉或导管静脉舒张末期血流缺失/逆流0.090.280.300.850.050.070.120.09
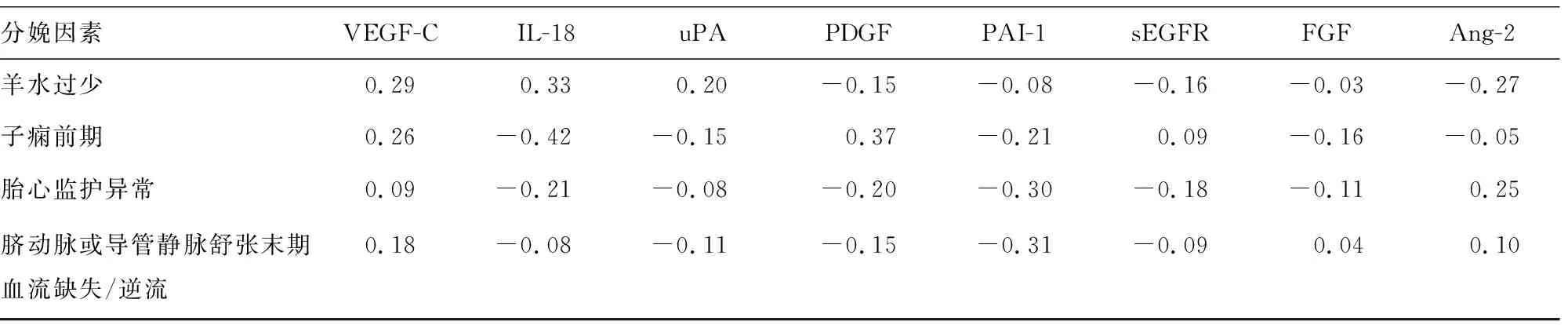
分娩因素VEGF-CIL-18uPAPDGFPAI-1sEGFRFGFAng-2羊水过少0.290.330.20-0.15-0.08-0.16-0.03-0.27子痫前期0.26-0.42-0.150.37-0.210.09-0.16-0.05胎心监护异常0.09-0.21-0.08-0.20-0.30-0.18-0.11 0.25脐动脉或导管静脉舒张末期血流缺失/逆流0.18-0.08-0.11-0.15-0.31-0.09 0.04 0.10
2.3方案1孕妇血清中与FGR分娩因素相关的细胞因子水平比较 根据细胞因子分析结果,确定了5种细胞因子(IL-6、sVEGFR-1、PLGF、sCD40L、瘦素)与FGR分娩因素相关,采用ELISA测定这5种细胞因子水平,结果显示,诊断FGR 2周后分娩组、诊断FGR 2周内分娩组、对照组孕妇间血清IL-6、sVEGFR-1、PLGF、sCD40L、瘦素水平差异有统计学意义(P<0.05),其他细胞因子水平在3组孕妇间比较,差异无统计学意义(P>0.05),见表3。
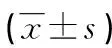
表3 方案1孕妇血清中与FGR分娩因素相关的细胞因子水平比较
2.4方案2孕妇一般资料及血清IL-6、sVEGFR-1、PLGF、sCD40L、瘦素水平比较 追踪分娩结局,根据分娩时间,将方案2中142例FGR孕妇分为诊断FGR 2周后分娩组(40例)、诊断FGR 2周内分娩组(102例),2组孕妇年龄、孕前BMI、初产妇比例、采样孕周、子痫前期比例、新生儿性别比例差异无统计学意义(P>0.05);与诊断FGR 2周后分娩组相比,诊断FGR 2周内分娩组血清IL-6、sVEGFR-1、sCD40L、瘦素水平升高(P<0.05),而PLGF水平则相对降低(P<0.05),见表4。

表4 方案2孕妇一般资料及IL-6、sVEGFR-1、PLGF、sCD40L、瘦素水平比较

组别n早产[n(%)]子痫前期[n(%)]新生儿性别(男/女,n/n)IL-6(x±s,ng/mL)瘦素(x±s,μg/mL)诊断FGR 2周后分娩组 4027(67.50)10(25.00)21/1933.59±12.3024.39±4.55诊断FGR 2周内分娩组102102(100.00)43(42.16)59/4347.04±15.1129.68±6.80t/χ2 36.4913.6150.334 5.092 4.585P<0.0010.0570.564<0.001<0.001

续表4 方案2孕妇一般资料及IL-6、sVEGFR-1、PLGF、sCD40L、瘦素水平比较
2.5影响早发型FGR 2周内分娩的血清细胞因子的Logistic回归模型分析 以分娩时间为因变量,以与FGR分娩因素相关的细胞因子为自变量建立Logistic回归模型,分析结果显示,血清IL-6、sVEGFR-1水平增高是诊断FGR 2周内分娩的独立危险因素(P<0.05),见表5。

表5 影响早发型FGR 2周内分娩的血清细胞因子的Logistic回归模型分析

组别n子痫前期[n(%)]新生儿性别(男/女,n/n)出生体质量(x±s,g)SGA[n(%)]严重SGA[n(%)]5 min Apgar评分<7分[n(%)]对照组200(0.00)12/83 090.00±812.451(5.0)0(0.0)0(0.00)诊断FGR 2周后分娩组61(16.67)a3/32 133.21±510.60a6(100.0)a3(50.0)a0(0.00)诊断FGR 2周内分娩组146(42.86)a8/61 451.67±265.82a14(100.0)a11(78.57)a 3(21.43)aF/χ210.4820.19028.210 36.192 23.0526.023P0.0050.909<0.001<0.001<0.0010.049
2.6血清IL-6、sVEGFR-1水平对早发型FGR 2周内分娩的预测价值 ROC曲线分析结果显示,血清IL-6、sVEGFR-1单独预测早发型FGR 2周内分娩的曲线下面积AUC分别为0.778(95%CI:0.693~0.864)、0.844(95%CI:0.780~0.908),最佳临界值分别为33.875 ng/mL、2 479.09 pg/mL,此时灵敏度分别为82.4%、82.4%,特异度分别为62.5%、70.0%;IL-6、sVEGFR-1联合预测早发型FGR 2周内分娩的AUC为0.875(95%CI:0.815~0.936),灵敏度为86.3%,特异度为75.0%,见图2。
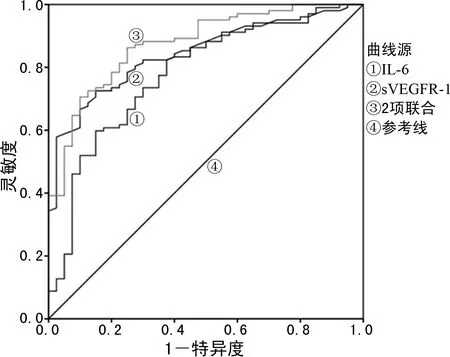
图2 血清IL-6、sVEGFR-1水平预测早发型FGR2周内分娩的ROC曲线
3 讨 论
早发型FGR是一种常见的产科疾病,其增加了新生儿围生期窒息、死亡等不良结局的风险,还可能并发后遗症,威胁新生儿的长期健康[7]。同时早发型FGR比晚发型FGR更易出现因母体血管灌注不良引起的胎盘组织病理学病变,因此,筛查早发型FGR并推测其分娩时机具有重要意义[8]。本研究对不同孕妇的血清细胞因子谱进行分析,在对照组与不同分娩时间的2组早发型FGR孕妇之间,血清IL-6、sVEGFR-1、PLGF、sCD40L、瘦素水平差异有统计学意义(P<0.05),因此,本课题组对以上因子采用Logistic回归模型进行了分析,结果显示孕妇血清IL-6、sVEGFR-1水平升高是早发型FGR 2周内分娩的独立影响因素,为预测早发型FGR孕妇的分娩时间提供了新的诊断依据。
早发型FGR胎儿更易伴有脐血流异常、羊水过少,从而导致胎儿丢失率升高,因此临床对于早发型FGR常给予密切的胎儿血流及羊水情况监测,但并不能有效预测分娩时间[9]。羊水过少极易导致胎儿发育畸形,是诱发FGR的重要因素之一,且多数羊水过少的孕妇分娩孕周要更短。而常见的引起羊水过少的原因有胎膜早破、胎盘血流灌注异常及因胎盘功能差,这些原因致使胎儿水合作用减少、生长迟缓、胎儿尿流减少[10]。其中细胞因子水平异常是胎膜早破的常见原因,有研究表明,IL-6、IL-8及TNF-α水平升高会激活溶酶体酶进而破坏胎膜[11];同时,胎盘血流及功能也与炎症因子水平相关,在INOUE等[12]的研究中,核苷酸结合的寡聚域-1(Nod1)会引起小鼠血管炎症的发展,通过给受孕的C57BL/6小鼠注射Nod1配体之一的FK565可诱导孕鼠胎儿宫内生长受限、死亡,且母体、胎盘和胎儿组织中IL-6、TNF-α水平均明显增加,说明激活Nod1信号传导可诱导胎儿免疫应答、炎性反应等,进而对胚胎的生长与发育产生不良影响。RAGHUPATHY等[13]也发现胎儿宫内生长受限与正常妊娠相比具有更强的促炎倾向性,尤其是对于胎盘供血不足或功能不全的孕妇,炎症相关因子水平升高更明显。此外,本研究结果还显示,诊断FGR 2周内分娩的孕妇血清IL-6水平比诊断FGR 2周后分娩的孕妇更高(P<0.05),提示IL-6可能有预测早发型FGR分娩时间的重要价值。
子痫前期和FGR是2种常见妊娠相关并发症,子痫前期孕妇FGR发生率为20%~30%,而在早发型重度子痫前期孕妇中FGR发生率可高达60%[14]。sVEGFR-1主要由内皮细胞分泌,在血管生成中扮演重要角色,VAISBUCH等[15]对健康孕妇及重度子痫前期、子痫的孕妇sVEGFR-1水平进行分析,结果显示,重度子痫前期及子痫孕妇的sVEGFR-1水平明显高于健康孕妇,但其二者之间的sVEGFR-1水平并无显著差异,故研究者认为子痫与重度子痫前期有相同致病途径,且与sVEGFR-1水平相关。sVEGFR-1通过结合、抑制VEGF、PLGF活性从而达到抗血管生成的作用,同时增强内皮细胞对促炎因子的敏感性,诱发血管炎性反应,已有研究表明FGR、子痫前期及胎儿死亡的发生均与抗血管生成状态相关[16-17]。此外,本研究结果中还发现诊断FGR 2周内分娩的孕妇血清sVEGFR-1水平比诊断FGR 2周后分娩的孕妇高(P<0.05)。因此,本课题组采用ROC曲线分析血清IL-6、sVEGFR-1水平对诊断FGR 2周内分娩的预测价值,结果说明血清IL-6、sVEGFR-1水平对诊断FGR 2周内分娩有重要意义。但是本研究也存在一定的局限性:首先,多数孕妇在早发型FGR诊断2周内分娩,导致2组研究队列偏倚;其次,孕妇均由同一所研究中心招募;第三,没有进一步评估早发型FGR孕妇血清标志物水平与胎儿体质量之间的相关性。因此,下一步计划进一步扩大样本量,并进行多重生物标志物分析,以提供更具有临床应用价值的信息。
综上所述,IL-6和sVEGFR-1与早发型FGR孕妇分娩时间有关,监测孕妇血清IL-6、sVEGFR-1水平对预测早发型FGR最佳分娩时机有重要价值。
