AHSG与CEA联合检测对膀胱癌的诊断价值*
2022-01-19刘牟林丁大朋
刘牟林,丁大朋
大连医科大学附属第一医院检验科,辽宁大连 116011
膀胱癌是泌尿系统最常见的恶性肿瘤之一,发病率和病死率呈逐年上升趋势,是危害人类身心健康的主要疾病之一[1-2]。膀胱癌患者早期临床表现多为尿频、尿急等非特异性症状,导致临床漏诊率和误诊率较高。目前,膀胱镜检查与组织活检是诊断膀胱癌的金标准[3-4],但以上方法为侵入性的有创检查手段,很多患者对其心理接受度低且要承受更多痛苦,加上较高的经济成本和尿路感染、出血等风险,使其无法成为常规筛查方法。血液作为无创类检查标本,可以提供DNA、RNA和蛋白质等来源信息,是寻找肿瘤标志物的理想标本。血液检查具有标本用量少、易取得且创伤小、患者易接受等优点[5]。本研究利用在线肿瘤数据库starBase和Oncomine分析血清胎球蛋白A(AHSG)在膀胱癌中的mRNA表达情况,并采用Human Protein Atlas(HPA)数据库和酶联免疫吸附试验(ELISA)验证AHSG在膀胱癌组织中的蛋白表达水平。同时,利用受试者工作特征(ROC)曲线分析AHSG与CEA联合检测对膀胱癌的诊断价值,为膀胱癌筛查提供新的、潜在的客观评价指标。
1 资料与方法
1.1一般资料 选择2017年9月至2019年9月就诊于本院的膀胱癌患者30例作为膀胱癌组,其中男24例、女6例,年龄41~83岁、平均(64.9±11.27)岁。入选标准:(1)年龄大于18岁;(2)病理检查明确诊断为膀胱癌;(3)未接受手术、放化疗等治疗。排除标准:患有急性或慢性感染及其他膀胱相关疾病者。选择本院同期30例体检健康者作为健康组,健康组年龄和性别与膀胱癌组患者相匹配,各项生化指标正常,无膀胱癌家族史且无重要脏器疾病与恶性肿瘤。本研究通过本院伦理委员会批准(YJ-KY-SB-2017-50),所有受试者均签署知情同意书。
1.2仪器与试剂 北京威士达公司SunriseTM酶标仪,罗氏Cobas e601全自动化学发光免疫分析仪,美国P&D公司人AHSG ELISA试剂盒。
1.3方法
1.3.1在线肿瘤数据库分析AHSG mRNA及蛋白的表达水平 在starBase(http://starbase.sysu.edu.cn/index.php)数据库中的“Pan-Cancer”模块中选择“Gene Differential Expression”,在“Gene”选项中输入“AHSG”,得到AHSG在各种肿瘤中的表达数据,选择“BLCA(Bladder Urothelial Carcinoma)”得到AHSG mRNA在膀胱癌组织中的表达数据,mRNA表达水平由RNA-seq数据通过log2(FPKM+0.01)获得。
在Oncomine(https://www.oncomine.org/resource/login.html)数据库的“Search”选项中输入“AHSG”,在“Analysis Type”选项中的“Cancer vs. Normal Analysis”下选择“Bladder Cancer vs. Normal Analysis”,“THRESHOLD BY:P-VALUE”选择“0.05”,得到AHSG mRNA在膀胱癌组织中的表达数据。
在HPA(https://www.proteinatlas.org/)数据库的“Search”选项中输入“AHSG”,点击“TISSUE”中的“Urinary bladder”得到AHSG蛋白在正常膀胱组织中的表达结果;点击“PATHOLOGY”中的“Urothelial cancer”得到AHSG蛋白在膀胱癌组织中的表达结果。
1.3.2在线肿瘤数据库分析AHSG预测膀胱癌患者预后的价值 在Kaplan-Meier Plotter(KM Plotter,http://kmplot.com/analysis/index.php?p=background)数据库中选择“Start KM Plotter for pan-cancer”,在“Gene symbol”选项中输入“AHSG”,在“Survival”选项中选择“OS(n=7 462)”,在“Select all(n=7 489)”选项中选择“Bladder Carcinoma”,点击“Draw Kaplan-Meier plot”,得到AHSG预测膀胱癌患者总体生存概率的生存曲线;在“Survival”选项中选择“RFS(n=4 420)”,在“Select all(n=7 489)”选项中选择“Bladder Carcinoma”,点击“Draw Kaplan-Meier plot”,得到AHSG预测膀胱癌患者无复发生存概率的生存曲线。
1.3.3血清标本采集与储存 采集受试者清晨空腹静脉全血3~5 mL,置于10 mL含促凝剂的真空采血管中,室温下垂直静置1 h,使血液充分凝固。然后将标本以3 000 r/min离心10 min,充分分离血清,取上层血清分装于2.0 mL冻存管中,-80 ℃保存备用。
1.3.4血清AHSG和CEA水平检测 利用ELISA商品化试剂盒检测受试者血清AHSG水平,操作严格按照试剂盒说明书进行,利用SunriseTM酶标仪检测450 nm波长处的吸光度值,根据标准曲线法计算血清AHSG水平并进行统计分析。利用罗氏Cobas e601全自动化学发光免疫分析仪检测血清CEA水平,检测过程严格按照仪器操作规程进行。
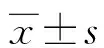
2 结 果
2.1AHSG mRNA在膀胱癌组织中的表达水平升高 利用starBase(图1A)和Oncomine(图1B、C)数据库分析AHSG mRNA在膀胱癌组织中的表达情况,结果发现,膀胱癌组织中AHSG mRNA表达水平明显升高,且与肿瘤分级(图1D)高低、有无远处转移(图1E)和淋巴结转移(图1F)密切相关(P<0.05)。当膀胱癌患者肿瘤分级越高、伴有远处转移或淋巴结转移时,AHSG的表达也随之升高。

注:A为starBase数据库分析AHSG mRNA在膀胱癌组织中的表达情况;B、C为Oncomine数据库分析AHSG mRNA在膀胱癌中的表达情况;D、E、F分别为Oncomine数据库分析不同肿瘤分级、有无远处转移和有无淋巴结转移膀胱癌的AHSG mRNA表达情况。图1 starBase和Oncomine数据库分析AHSG mRNA在膀胱癌组织中的表达情况
2.2AHSG是预测膀胱癌患者预后的潜在标志物 利用HPA数据库验证AHSG蛋白在膀胱癌组织中的表达情况,结果发现,与正常膀胱组织相比,膀胱癌组织中AHSG蛋白表达水平更高(图2)。ELISA发现,本研究中膀胱癌组血清AHSG水平较健康组明显升高(P<0.05),见图3A。KM Plotter数据库分析发现,AHSG高表达的膀胱癌患者较AHSG低表达的患者具有更高的无复发生存概率(P<0.05),表明AHSG是潜在的膀胱癌患者预后分析的客观评价标志物,见图3B、C。

注:A、B分别为HPA数据库分析AHSG蛋白在正常膀胱组织和膀胱癌组织中的表达情况。图2 HPA数据库验证AHSG蛋白在膀胱癌组织中的表达情况

注:A为本研究膀胱癌组与健康组血清AHSG水平比较;B、C分别为KM Plotter数据库分析AHSG预测膀胱癌患者总体生存概率和无复发生存概率的生存曲线。与健康组比较,***P<0.001。图3 膀胱癌患者血清AHSG水平及其预后预测价值分析
2.3AHSG、CEA检测对膀胱癌的诊断效能分析 为分析AHSG与CEA联合检测对膀胱癌的诊断价值,本研究首先验证了膀胱癌组患者血清CEA水平高于健康组(P<0.05),见图4。同时,ROC曲线(图5)显示,AHSG单独检测诊断膀胱癌的AUC为0.855,灵敏度为66.7%,特异度为86.7%;CEA单独检测诊断膀胱癌的AUC为0.851,灵敏度为93.3%,特异度为70.0%。与AHSG相比,CEA检测诊断膀胱癌的灵敏度(93.3%)较AHSG(66.7%)高,特异度(70.0%)较AHSG(86.7%)稍有降低,但降低幅度小。当AHSG与CEA联合检测诊断膀胱癌时,AUC为0.952,灵敏度为90.0%,特异度为93.3%,其诊断价值优于AHSG、CEA单独检测。
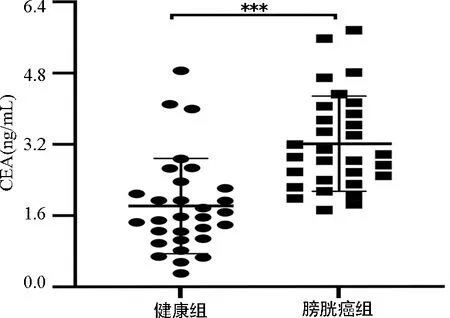
注:与健康组比较,***P<0.001。图4 健康组与膀胱癌组血清CEA水平比较

图5 AHSG、CEA诊断膀胱癌的ROC曲线
3 讨 论
膀胱癌起病隐匿,恶性程度高,手术是目前临床上治疗膀胱癌的首选方案,但患者术后生存率较低,其中转移性膀胱癌患者的5年生存率仅为6%[6]。早期发现是膀胱癌诊断、治疗和预后的关键。膀胱镜检查与组织活检是传统的诊断膀胱癌的有效方法,但其操作复杂,对患者损伤大,难以成为膀胱癌筛查和常规检测的手段。因此,寻找和发现有效的血清学标志物来提高膀胱癌的临床诊断率具有重要意义。近年来,血清蛋白质组学已成为发现肿瘤标志物的重要手段,且已证实血清标志物具有较高的灵敏度和特异度[7-10]。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)是临床上检测血液、体液等标本的成熟质谱技术,具有操作简便、检测快速、高选择性、高灵敏度和高特异性等特点。郑爱文等[11]利用MALDI-TOF-MS检测了子宫内膜癌患者和健康女性的血清多肽谱,发现12个差异多肽峰,其中质荷比(m/z)为2 768.0、3 402.0和6 441.0的3种血清多肽联合诊断子宫内膜癌的灵敏度为88.1%,特异度为75.8%,鉴别子宫内膜癌和子宫良性病变的灵敏度为94.9%,能较准确地区分子宫内膜癌患者、健康女性和子宫良性病变患者,有助于子宫内膜癌的早期筛查。本研究前期利用MALDI-TOF-MS筛选并验证了膀胱癌患者血清中5种表达上调的差异血清多肽(m/z为2 081.0、3 938.3、1 954.0、4 268.8和3 946.5),通过纳米级液相色谱耦合串联质谱技术进行鉴定,并与UniProt数据库比对,确定了其中2种血清多肽对应的蛋白,分别是m/z为2 018.0对应的AHSG和m/z为1 954.9对应的血清转铁蛋白(TRF)[12]。
AHSG是一种可分泌到体液中的蛋白质。研究发现,AHSG可以作为多种肿瘤如口腔鳞状细胞癌、非小细胞肺癌和胃癌等的标志物。JAIN等[13]利用液相色谱仪-质谱仪(LC-MS)分析,发现AHSG在口腔鳞状细胞癌中表达升高,其诊断口腔鳞状细胞癌的灵敏度为78.0%,特异度为87.5%,是口腔鳞状细胞癌辅助诊断的潜在标志物。SHI等[14]分析了32例胃癌患者和30例健康对照者血清标本中AHSG的蛋白表达变化,并利用ELISA验证差异纤维蛋白原ɑ链、AHSG和载脂蛋白A-I水平,发现它们在胃癌患者中表达水平升高,且具有良好的诊断价值,可成为诊断胃癌的潜在血清学标志物。目前,较少见AHSG在膀胱癌中表达水平的研究。根据前期研究结果,本研究选择AHSG进行后续验证和研究。首先利用starBase和Oncomine数据库分析确定了AHSG mRNA在膀胱癌中高表达,且与膀胱癌的肿瘤分级高低、有无远处转移和淋巴结转移密切相关。同时HPA数据库和ELISA也验证了AHSG蛋白在膀胱癌中的高表达。KM Plotter数据库分析发现,与AHSG低表达的膀胱癌患者相比,AHSG高表达膀胱癌患者具有更高的无复发生存概率。ROC曲线显示,AHSG单独检测诊断膀胱癌的AUC为0.855,灵敏度为66.7%,特异度为86.7%,表明AHSG是膀胱癌诊断和预后分析的潜在血清学标志物。
目前,膀胱癌缺乏特异的血清学肿瘤标志物,主要通过检测CEA水平来监测患者病情变化[15]。CEA是由黏膜上皮细胞分泌的可溶性跨膜糖蛋白,在健康人群血清中含量极低,是高效、广谱的肿瘤标志物。血清或尿CEA检测在膀胱癌的诊断和监测中具有重要的应用价值。正常情况下,机体内CEA水平低于10 ng/mL。当膀胱组织癌变或肿瘤复发时,尿CEA水平会快速升高,其与肿瘤大小和病情严重程度密切相关,是膀胱癌诊断和预后评估的有效指标[16]。AHMADI等[17]发现,膀胱癌患者术前血清CEA和糖类抗原(CA)19-9水平升高,是判断患者预后不良的独立预测因子。本研究验证了膀胱癌患者血清CEA水平升高,并利用ROC曲线分析AHSG、CEA对膀胱癌的诊断价值,发现AHSG与CEA联合检测诊断膀胱癌的AUC为0.952,较AHSG或CEA单独检测更高,说明AHSG与CEA联合检测诊断膀胱癌的临床应用价值更高。
综上所述,AHSG在膀胱癌中的表达明显升高,是膀胱癌诊断和预后预测的客观评价指标,其与CEA是膀胱癌诊断和预后分析中临床应用价值更高的、潜在的血清学标志物。
