沉默wee1基因对卵巢癌细胞增殖、迁移和侵袭的作用机制*
2022-01-19季万里
李 霞,季万里,高 月
山东医学高等专科学校附属医院(临沂市老年病医院):1.检验科;2.病理科,山东临沂 276004;3.重庆市北碚区中医院检验科,重庆 400700
卵巢癌是一种严重威胁女性身心健康的常见妇科肿瘤,其发病隐匿、转移率高,整体生存率较低,5年生存率不足30%[1]。化疗是目前卵巢癌的主要治疗手段,但其不良反应很大。因此,卵巢癌的靶向治疗及相关分子标志物的研究备受关注。文献[2-3]报道wee1是一种属于丝氨酸/苏氨酸家族的蛋白激酶,在多种恶性肿瘤的发生、发展进程中起到重要作用。目前,有关wee1基因在卵巢癌中的相关研究报道甚少。本研究观察沉默wee1基因对卵巢癌细胞增殖、侵袭、迁移的影响及其作用机制,现报道如下。
1 资料与方法
1.1材料 人卵巢癌SKOV3细胞购自中国科学院上海细胞库;胎牛血清(FBS)、RPMI-1640培养基购自美国Invitrogen公司;Matrigel基质胶购自美国BD Biosciences公司;Transwell小室购自美国Millipore公司;小干扰RNA(siRNA)由上海吉玛公司合成;鼠抗人Wnt3a单克隆抗体、鼠抗人β-连环蛋白(β-catenin)单克隆抗体、鼠抗人细胞周期蛋白D1(Cyclin-D1)单克隆抗体、鼠抗人基质金属蛋白酶7(MMP-7)单克隆抗体和鼠抗人β-actin多克隆抗体购自美国Santa Cruz公司。Lipofectamine 2000购自上海吉玛公司,CFX96实时荧光定量PCR(qPCR)仪购自美国伯乐公司。
1.2方法
1.2.1卵巢癌细胞培养和转染 将卵巢癌细胞培养在含10%FBS的RPMI-1640培养液中,放置在37 ℃、5%CO2细胞培养箱中。待细胞融汇至80%,按每孔1×105个细胞加入6孔板,待细胞密度达到50%,按Lipofectamine 2000说明书转染细胞。试验共分3组:Blank组、siRNA阴性对照(siRNA-NC)组和携带wee1基因片段(siRNA-wee1)组。将siRNA-NC组(GCTGTTTTTTGAGATTTCAG)和siRNA-wee1组(ACGCTCTGTCAGCCTTACTA-TA)转染SKOV3细胞,Blank组不转染。
1.2.2qPCR 收集上述3组卵巢癌细胞,按照操作说明提取总RNA并测定RNA表达水平。以1 μg RNA为模板,按qPCR反转录试剂盒合成cDNA;以1 μL cDNA为模板,采用qPCR检测wee1 RNA表达水平。反应条件:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 15 s,72 ℃ 15 s,40个循环。引物序列Sence:5′-CCACCACCCT-GCCAGTTAA-3′,Antisence:5′-TAAACTTTTGT-GCAA CCAGGGTAA-3′。wee1 RNA表达水平采用2-ΔΔCt法确定。
1.2.3卵巢癌细胞平板集落形成试验 将转染后的3组卵巢癌细胞悬液(1×106/L)加入12孔板,轻轻混匀,隔2天换1次培养液。孵育10 d后用磷酸盐缓冲液(PBS)清洗3次,然后用4%多聚甲醛固定10 min,PBS再清洗3次,最后用0.2%结晶紫染色10 min,肉眼计数集落数,试验重复3次。
1.2.4划痕试验 用直尺在6孔板背后划横线。在孔中分别加入5×105个转染后的3组卵巢癌细胞。第2天用枪头垂直于背后的横线划痕,PBS清洗3次,加入无血清培养基细胞培养箱中培养。于0、12、24 h取样拍照。
1.2.5Transwell试验 试验前1 d将无FBS的RPMI-1640培养液和Matrigel基质胶按8∶1混合,将60 μL混合液加入到Transwell小室,培养过夜。试验前,将无FBS的RPMI-1640培养基100 μL加入小室中,继续培养30 min。将上述转染24 h的卵巢癌细胞消化并计数,将200 μL细胞悬液加入Millicell小室中,下室加入600 μL条件培养基。继续培养15 h,然后用4%多聚甲醛固定细胞,染色后倒置显微镜拍照。
1.2.6免疫印迹法(WB)检测 在各组转染48 h的卵巢癌细胞中加入裂解液,裂解细胞后提取总蛋白并测其水平。取30 μL蛋白样品进行上样,8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后转膜,室温封闭2 h,分别加入wee1、Wnt3a、β-catenin、Cyclin-D1、MMP-7单克隆抗体孵育过夜再加入二抗封闭1 h。ECL化学发光曝光,Bio-rad凝胶成像系统扫描拍照,测定Wnt3a、β-catenin、Cyclin-D1、MMP-7蛋白表达水平。上述蛋白测定均以β-actin为内参,蛋白表达水平=目的蛋白灰度值/β-actin蛋白灰度值。
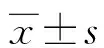
2 结 果
2.1转染后3组卵巢癌细胞wee1 mRNA及蛋白表达水平比较 利用qPCR和WB检测转染后卵巢癌细胞wee1 mRNA及蛋白表达情况,结果显示,3组卵巢癌细胞的wee1 mRNA表达水平比较,Blank组(3.51±0.96)与siRNA-NC组(3.69±0.88)差异无统计学意义(P>0.05),siRNA-wee1组(0.92±0.19)低于Blank组和siRNA-NC组(P<0.05),见图1A。WB结果显示siRNA-wee1组wee1蛋白表达水平低于siRNA-NC组和Blank组(P<0.05),见图1B。

注:A为3组wee1 mRNA表达情况;B为wee1蛋白表达情况;与Blank组比较,aP<0.05;与siRNA-NC组比较,bP<0.05。图1 转染后3组卵巢癌细胞wee1 mRNA及蛋白表达水平
2.2沉默wee1基因后3组卵巢癌细胞平板集落形成情况比较 沉默wee1基因后卵巢癌细胞平板集落形成试验结果显示,siRNA-wee1组卵巢癌细胞集落形成数少于Blank组和siRNA-NC组(P<0.05),见图2。

注:A为3组卵巢癌细胞集落形成图;B为3组卵巢癌细胞集落形成数比较。与Blank组比较,aP<0.05;与siRNA-NC组比较,bP<0.05。图2 沉默wee1基因后3组卵巢癌细胞集落形成情况
2.3沉默wee1基因后3组卵巢癌细胞迁移能力比较 利用细胞划痕愈合试验观察沉默wee1基因后卵巢癌细胞迁移能力,结果显示siRNA-wee1组卵巢癌细胞12 h、24 h的迁移距离小于siRNA-NC组和Blank组(P<0.05)。
2.4沉默wee1基因后3组卵巢癌细胞侵袭能力比较 利用Transwell试验观察沉默wee1基因后卵巢癌细胞侵袭能力,结果表明siRNA-wee1组卵巢癌细胞穿膜数量少于siRNA-NC组和Blank组(P<0.05),见图3。

注:A为3组卵巢癌细胞侵袭能力图;B为3组卵巢癌细胞穿膜数比较。与Blank组比较,aP<0.05;与siRNA-NC组比较,bP<0.05。图3 沉默wee1基因后卵巢癌细胞侵袭能力
2.5沉默wee1基因后3组卵巢癌细胞Wnt/β-catenin信号通路相关蛋白表达水平比较 利用WB检测沉默wee1基因后Wnt/β-catenin信号通路相关蛋白表达情况,结果显示,siRNA-wee1组Wnt3a、β-catenin、Cyclin-D1和MMP-7蛋白表达水平均低于siRNA-NC组和Blank组(P<0.05),见图4。

注:A为3组WB检测Wnt3a/β-catenin信号通路相关蛋白表达情况;B为3组Wnt3a/β-catenin信号通路相关蛋白表达水平比较。与Blank组比较,aP<0.05;与siRNA-NC组比较,bP<0.05。图4 沉默wee1基因后Wnt/β-catenin信号通路相关蛋白的表达情况
3 讨 论
wee1蛋白激酶是人wee激酶家族的成员之一,最早在裂殖酵母细胞中被发现,其结构由位于中间的激酶结构域、氨基端的调节结构域和一个短的羧基端组成,编码含有647个氨基酸的蛋白质,主要分布在细胞核中[4-5]。wee1蛋白激酶是G2/M期检查点的关键蛋白激酶,能够特异性地参与细胞周期的调节,其表达异常影响细胞周期的正常运行,进而改变细胞的生物学功能[6]。研究发现,敲除老鼠体内wee1基因,其胚胎因wee1基因缺失,DNA受损无法修复,诱发细胞进行有丝分裂而死亡[7]。wee1基因不仅在机体胚胎发育等方面起重要作用,而且在维持肿瘤细胞生物学行为方面发挥着至关重要的作用[8-9]。文献[10-13]报道wee1蛋白激酶在卵巢癌、乳腺癌、结直肠癌、胃癌等多种肿瘤中高表达,而且其高表达与患者预后生存相关。卵巢癌是女性常见的恶性肿瘤,近年来其发病率呈明显上升趋势,而且病死率居妇科肿瘤之首。本研究在卵巢癌细胞中沉默Wee1基因后发现卵巢癌细胞的增殖、侵袭、迁移能力均受到抑制,说明沉默wee1基因能够抑制卵巢癌细胞的恶性增殖进程,进而阻碍卵巢癌的转移。
卵巢癌在女性肿瘤中发病率和病死率均较高,而且恶性程度较高,因此深入研究其发病机制具有重要的临床意义。文献[14-15]报道,Wnt/β-catenin信号通路作为细胞内Wnt信号传导的重要经典途径参与恶性肿瘤的增殖、分化、侵袭、迁移等。一旦Wnt信号被激活,引起β-catenin聚集在细胞质和细胞核中,激活下游靶基因的活性,引起细胞异常增殖和迁移[16-17]。有报道显示,沉默wee1能够抑制直肠癌细胞的生长、侵袭、迁移,并显著抑制Wnt/β-catenin通路中的Wnt3a和β-catenin基因表达水平,表明RNA干扰wee1基因抑制结直肠癌细胞的增殖、侵袭和迁移很可能是通过Wnt/β-catenin信号通路调控来完成的[12]。Cyclin-D1和MMP-7作为β-catenin的下游靶基因,直接受β-catenin的调控。研究发现,过表达Cyclin-D1可促进肿瘤的侵袭、迁移,MMP-7过表达可促进肿瘤的生长和细胞侵袭能力[18-19]。本研究结果显示,沉默wee1基因后Wnt3a、β-catenin、Cyclin-D1和MMP-7蛋白表达均下调,表明沉默wee1基因能够抑制Wnt/β-catenin 信号通路的激活,下调其下游靶基因Cyclin-D1和MMP-7表达水平来抑制卵巢癌细胞增殖、侵袭和迁移。
综上所述,沉默wee1基因可抑制Wnt/β-catenin信号通路的激活,进而抑制卵巢癌细胞的增殖、侵袭和迁移过程,从而抑制卵巢癌的发生、发展。该分子机制的阐述为进一步寻找卵巢癌的治疗靶点提供了研究方向。
