结直肠无蒂锯齿状腺瘤/息肉的临床病理特征分析
2022-01-19陈思敏赵苏苏王耀辉龚冠闻章宜芬
李 惠,陈思敏,赵苏苏,王耀辉,韩 梅,龚冠闻,章宜芬
近年来,由锯齿状息肉癌变为结直肠癌的锯齿状途径,作为新的致癌途径引起了广泛关注。WHO(2010)消化系统肿瘤分类将结直肠锯齿状息肉分为增生性息肉(hyperplastic polyp, HP)、无蒂锯齿状腺瘤/息肉(sessile serrated adenoma/polyp, SSA/P)和传统的锯齿状腺瘤(traditional serrated adenoma, TSA)三种类型。2019年发表的关于结直肠锯齿状息肉形态学和分子病理的更新中建议将结直肠锯齿状息肉重新分为五类,包括HP、无蒂锯齿状息肉(SSP)、无蒂锯齿状息肉伴异型增生(SSP伴异型增生)、TSA和锯齿状腺瘤-未分类[1]。最终,WHO(2019)消化系统肿瘤分类将结直肠锯齿状息肉分为上述五类,并将SSA/P改称为无蒂锯齿状病变(sessile serrated lesion, SSL)[2],但这一命名在临床上尚未得到广泛接受,因此本文仍沿用旧称SSA/P。本文通过回顾性分析223例SSA/P的临床特征、内镜表现和病理学特点,以期帮助临床及病理医师提高对新分类的认识和对该类疾病的诊断能力。
1 材料与方法
1.1 材料收集2018年1月~2019年10月南京中医药大学附属医院病理科存档的223例结直肠SSA/P和4例SSA/P伴异型增生,同时收集同期4 218例HP(包括微泡性HP和富于杯状细胞性HP)作为对照。223例SSA/P中,男性109例,女性114例;年龄24~87岁,中位年龄58岁。4例SSA/P伴异型增生中男性2例,女性2例,年龄41~76岁。
1.2 方法标本均经10%中性福尔马林固定,常规脱水、石蜡包埋,3~4 μm厚切片,烤片后脱蜡,乙醇梯度脱水,HE染色,光镜下检查。
1.2.1SSA/P诊断标准 隐窝变形、不对称的扩张,隐窝底部的膨胀、形成锯齿状结构,沿着黏膜肌水平生长,形成L型或倒T型隐窝结构。根据WHO(2019)的诊断标准,具有一个典型特征的隐窝即可诊断SSA/P。
1.2.2SSA/P伴异型增生诊断标准 (1)非特殊类型:明显的结构异常和细胞学异常,通常黏膜全层可见异型性,属于排除性诊断。(2)微偏型异型增生:异型不明显,轻度隐窝拥挤、分支,锯齿减少,胞质富含黏液、嗜酸,核位于基底、深染。(3)锯齿状异型增生:密集排列的腺体,锯齿减少,可见筛状结构,细胞呈立方形、嗜酸性胞质、泡状核和突出的核仁,黏膜全层可见异型性。(4)腺瘤性异型增生:锯齿结构消失,类似普通腺瘤,胞质嗜碱,杆状核、深染,杯状细胞分化,异型增生区通常位于表面。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析。应用χ2检验、Fisher确切概率法进行显著性检验。P<0.05为差异有统计学意义。
2 结果
2.1 SSA/P的临床病理特征223例SSA/P包括内镜活检标本164例,内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)/内镜下黏膜切除术(endoscopic mucosal resection, EMR)标本55例,手术切除标本4例。病变直径0.2~2.5 cm。SSA/P内镜下为扁平隆起的纵向发育型病变(图1),窄带成像内镜下可见红色黏液帽。SSA/P镜下隐窝伴有明显的锯齿状结构,延伸至隐窝底部沿黏膜肌横向生长,呈L型或倒T型(图2、3),而HP锯齿状结构仅限于隐窝的上2/3(图4)。223例SSA/P中,165例(74.0%)位于右半结肠(升结肠91例、肝曲21例、横结肠29例、脾曲3例、回盲部21例),58例(26.0%)位于左半结肠(降结肠14例、乙状结肠24例、直肠20例)。与HP相比,SSA/P好发于右半结肠(P<0.05);两者性别、病变直径差异有统计学意义(P<0.05,表1)。

①②③④⑤⑥
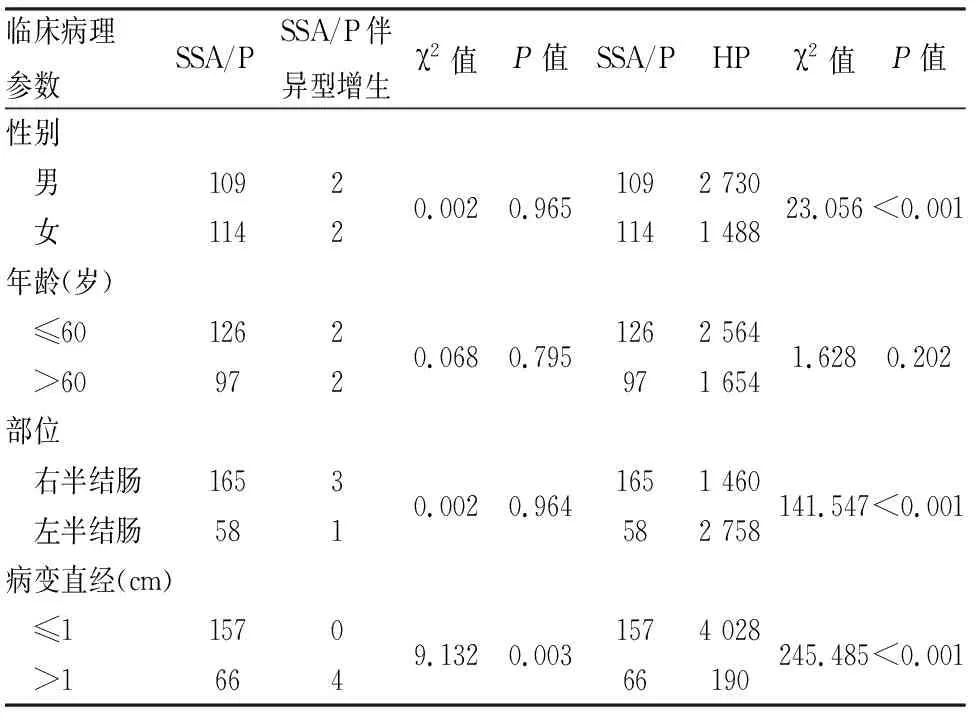
表1 HP、SSA/P和SSA/P伴异型增生的临床病理特征
2.2 SSA/P伴异型增生的临床病理特征4例SSA/P伴异型增生中,3例位于右半结肠,1例位于左半结肠,提示其更易发生于右半结肠。内镜下均表现广基(无蒂)纵向发育型肿瘤,肉眼观为广基浅表隆起息肉状肿物(图5)。显微镜下显示2例为非特殊类型(图6),1例为锯齿状异型增生,1例为腺瘤性异型增生。4例局部均可见典型SSA/P的形态。4例病变平均直径为3.3 cm,提示体积较大的SSA/P更易伴有异型增生(P<0.05),而与患者性别、年龄无关。
3 讨论
1996年Torlakovic和Snover首次描述并命名了SSA/P,随后发现其体积比HP大,好发于右半结肠并具有独特的形态学特征和分子改变。近年来有学者提出SSA/P不完全呈息肉状且缺乏腺瘤性上皮,为避免与传统的腺瘤性息肉混淆,WHO(2019)将SSA/P更名为SSL,但考虑到SSL易与目前使用的锯齿状病变概念混淆,国内共识建议仍使用SSA/P。目前认为SSA/P可能起源于微泡型HP,因为他们共同存在BRAF基因突变,表现为CpG岛甲基化(CpG island methylator phenotype, CIMP)阳性和微卫星稳定[3]。其中,右半结肠的SSA/P具有高度甲基化,左半结肠的SSA/P具有低~中度甲基化。SSA/P伴异型增生具有BRAF突变、高甲基化和MLH1基因的表观沉默和微卫星不稳定。而富于杯状细胞的HP表现为KRAS突变、BRAF野生及CIMP阴性。本组223例SSA/P中均未见富于杯状细胞的HP形态,间接提示了其基因通路的差异性。
国内对于结直肠锯齿状息肉占结肠镜检查比例的报道差异较大,从0.1%~8.1%不等[4-5],对SSA/P的检出率较低,可能由于对锯齿状息肉的认识不足导致诊断率较低。正确认识SSA/P的形态学改变可以避免漏诊SSA/P。其中,HP是最易与SSA/P相混淆的锯齿状息肉。HP病变直径 1~5 mm,很少大于1 cm,好发于远端结肠和直肠,有蒂或无蒂,锯齿状结构仅限于隐窝的上2/3,隐窝基底部大致正常。而SSA/P好发于近端结肠,内镜下通常为扁平状或广基(无蒂)的微隆起的息肉,一般直径>5 mm,镜下锯齿状结构累及隐窝的下1/3,隐窝基底部扩张。免疫组化可以帮助鉴别两者:正常结肠黏膜中Ki-67阳性增殖区位于隐窝的基底,而CK20阳性的成熟区位于表面;HP中Ki-67阳性增殖区向表面扩大延伸,而CK20阳性区向基底扩大延伸;SSA/P中Ki-67阳性增殖区呈不对称增生。有研究请胃肠亚专科病理学家重新判读切片发现,有很大比例的大的或近端SSA/P最初被误诊为HP[6]。本组223例SSA/P中有11例曾被诊断为HP,大部分误诊病例均是由于活检标本,切面原因导致无法观察黏膜肌,由于病变较大,临床进行ESD/EMR治疗后可明确诊断。鉴于大的(≥1 cm)或近端的锯齿状息肉,特别是SSA/P与肿瘤风险增加相关,应进行更严格的监视及内镜下切除。
SSA/P伴异型增生占所有SSA/P的2%~14%[7],近端结肠、女性多见。内镜下表现为明显凸出的病变,有的表现为扁平或微凹陷的病变。镜下一般可见SSA/P到异型增生区域的突然转变,当异型增生的周围观察不到典型的SSA/P时,诊断应谨慎。SSA/P伴异型增生是SSA/P进展为癌的过程中一个短暂的、重要的步骤。研究表明[8]SSA/P发展为SSA/P伴异型增生的平均时间为17年,而SSA/P伴异型增生患者和SSA/P伴癌患者的平均年龄差异无显著性,这提示SSA/P伴异型增生会快速恶变。过去SSA/P伴异型增生被认为是SSA/P和管状腺瘤的混合表现,现在发现两种成分均存在BRAF V600E突变,因此代表同一个病变的两个阶段。SSA/P伴异型增生通常MLH1表达缺失,有助于鉴别诊断[9]。本组4例SSA/P伴异型增生,其中3例发生在右半结肠,体积均较大,未见明显性别差异,因异型增生周围可以观察到SSA/P而确诊。
综上,在过去10年中积累了许多关于锯齿状息肉的分子遗传学数据,但仍有许多问题有待解决。锯齿状腺瘤-未分类这个诊断名词应避免过度使用,应根据其形态学进一步分类,例如锯齿状管状绒毛状腺瘤、富于黏液的TSA亚型和表浅型锯齿状腺瘤[10]。其次,SSA/P伴异型增生具有广泛的形态异质性,常规的分级系统可能并不适用,目前尚无一项研究观察SSA/P伴异型增生分级的一致性。此外,SSA/P可以根据其临床病理特征及分子表达谱进一步进行危险度分层,从而根据危险度进行个体化监测。
