氧化铁纳米颗粒引起肝血窦内皮细胞损伤及其机制研究
2022-01-18许海燕
张 雪 孔 非 温 涛 张 宇 孟 洁#∗ 许海燕#∗
1(中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005)
2(东南大学生物科学与医学工程学院,江苏省生物材料与器件重点实验室,南京 210096)
引言
氧化铁纳米颗粒(iron oxide nanoparticles,IONPs)具有优异的磁学性能和良好的生物相容性,在核磁共振对比剂、肿瘤热疗和药物载体等诸多生物医学领域具有广泛的转化应用潜力[1-2]。但是,其应用的潜在风险也引起了研究者的关注。有研究证实,IONPs 可促进细胞产生活性氧物种(reactive oxygen species,ROS),这种效应主要决定于其理化性质和使用剂量[3-4]。有文章报道,羧基、氨基修饰的IONPs 和裸IONPs 均可通过氧化应激引起人心脏、大脑和肾脏来源的细胞中与增殖相关的基因发生改变[5];裸IONPs 可通过产生ROS 诱导人微血管内皮细胞的通透性增加[6]。当细胞内ROS 浓度过高时,就会发生氧化应激损伤,引起脱氧核糖核酸、蛋白质和脂质氧化,具有引发多种疾病的风险[7]。
静脉途径注射是IONPs 的主要应用方式,这增加了IONPs 暴露于血管内皮细胞的风险。肝血窦内皮细胞是构成血液与肝脏组织之间屏障的重要成分[8-9],也是与血液来源的物质最先接触的细胞[10],参与肝脏的炎症、脂肪变性、肝纤维化、肝硬化和肝癌等发病过程[11]。肝脏中的血流速度明显慢于全身循环,纳米材料在肝血窦中的循环速度可下降到体循环的1/1 000,为200~800 μm/s[12],使纳米材料与肝血窦内皮细胞的接触时间大幅度延长,并易于在肝脏中积累[13]。已有研究主要集中在IONPs 对血管内皮细胞的作用,包括血管生成[14]、内皮间质转分化[15]和内皮通透性改变[16]等方面。目前,关于IONPs 对肝血窦内皮细胞作用的研究还比较少。本课题从氧化应激的角度,研究了二巯基丁二酸修饰的四氧化三铁纳米颗粒(dimercaptosuccinic acid-magnetite nanoparticles,DMSA-Fe3O4)对人原代肝血窦内皮细胞(human hepatic sinusoid endothelial cells,HHSECs)的作用。在此基础上,采用静脉给药方式,将DMSA-Fe3O4注射到健康小鼠体内,观察其在肝脏中的分布及对肝脏的损伤。本研究将有助于确定DMSA-Fe3O4的应用安全窗口,并以此为依据设计临床应用方案。
1 材料和方法
试剂与材料的来源:DMSA-Fe3O4购自南京东纳生物科技有限公司;人原代肝血窦内皮细胞(human hepatic sinusoidal endothelial cells,HHSECs)及相关培养试剂,即内皮细胞基础培养基、胎牛血清(fetal bovine serum,FBS)、内皮细胞生长补充物(endothelial cell growth supplement,ECGS)、青霉素/链霉素溶液(penicillin/streptomycin solution,P/S)与纤粘连蛋白,购自北京裕恒丰科技有限公司;2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-Dichlorodihydro fluorescein Diacetate,DCFH-DA)和0.25%胰酶购自Sigma-Aldrich 公司;Trizol 购自Ambion 公司;逆转录试剂盒和TB Green 购自Takara公司;引物购自生工公司。
1.1 纳米颗粒表征
将DMSA-Fe3O4分散于超纯水中,滴加到透射电镜铜网上,彻底干燥后,使用透射电镜观察(TEM-1010)。通过纳米颗粒追踪分析仪(Zetaview PMX120,Particle Metrix),检测DMSA-Fe3O4的水合粒径和Zeta 电势,在室温下重复测量3 次。
1.2 细胞培养过程
将基础培养基配制成含5% FBS、1% P/S 和1% ECGs 的完全培养基。将不含钙离子和镁离子的磷酸盐缓冲液(phosphate buffer saline,PBS)配制的纤粘连蛋白按照2 μg/cm2的量加入到培养瓶中,37℃过夜孵育后,吸去纤粘连蛋白溶液,完成培养瓶的包被。将HHSECs 加入到该培养瓶中,在37℃、5% CO2条件下培养。当细胞生长到融合度约90%时,进行胰酶消化和传代。
1.3 普鲁士蓝染色
按照8×104/孔的密度,将HHSECs 接种在纤粘蛋白包被的24 孔细胞培养板中,培养过夜后加入DMSA-Fe3O4,培养不同时间后,用PBS 洗涤,加入4%多聚甲醛室温固定30 min。加入300 μL 普鲁士蓝染液(5%亚铁氰化钾和5%盐酸按照体积比为1∶1混合)处理30 min,再加入200 μL 伊红染液复染2 min。用倒置显微镜(Olympus IX71)观察细胞并采集图像,实验重复3 次。
1.4 检测细胞活性
对于实时无标记细胞分析技术(real time celI anaIysis,RTCA)中用到的E-plate,每孔中加入100 μL 培养基,待基线平稳后,将细胞按照8×103/孔的密度接种。在相应孔中分别加入终浓度为50、100 和200 μg/mL DMSA-Fe3O4后,将E-plate 放入仪器中(xCELLigence S16,ACEA Biosciences)。检测细胞电阻的变化情况,检测间隔为15 min,实验重复3 次。
1.5 ROS 检测实验
按照8×104/孔的密度,将HHSECs 接种在包被过的24 孔细胞培养板中,过夜贴壁后,分别与50、100 和200 μg/mL 的DMSA-Fe3O4孵育30 min。弃去培养基,加入10 μM DCFH-DA,37℃避光处理30 min。胰酶消化后收集细胞,用流式细胞仪(C6,BD Biosciences)检测,实验重复3 次。
1.6 实时荧光定量PCR
按照4×105/孔的密度,将HHSECs 接种在包被过的6 孔细胞培养板中,过夜培养后,弃去上清,分别与50、100 和200 μg/mL 的DMSA-Fe3O4孵育24 h。使用1 mL Trizol 提取细胞的总RNA,用逆转录试剂盒将RNA 逆转成cDNA。使用实时定量PCR仪(Bio-Rad)检测相关基因表达。甘油醛-3-磷酸脱氢酶(GAPDH) 作为管家基因,血红素加氧酶-1(HO-1)、缺氧诱导因子-1(HIF-1α)和血管内皮生长因子(VEGF)作为目的基因。具体引物信息如表1所示,实验重复3 次。
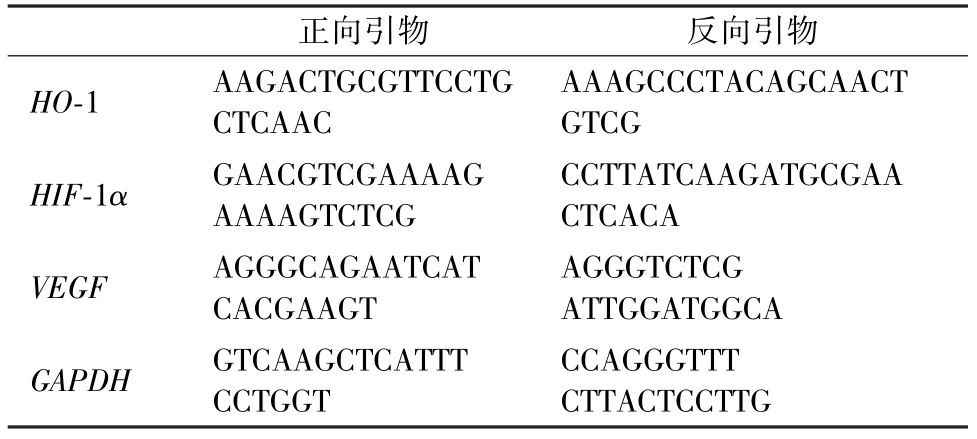
表1 引物序列信息Tab.1 Sequences information of the gene primer
1.7 动物实验过程
动物实验按照动物保护和利用委员会(中国医学科学院基础医学研究所)批准的方案进行。6 周龄SPF(18-21 g)雌性C57BL/6 J 小鼠购自北京维通利华公司,饲养在中国医学科学院基础医学研究所实验动物中心。小鼠分为3 组,每组4 只。其中,两组注射纳米颗粒,一组注射5%葡萄糖,作为对照。将分散在5%葡萄糖里的DMSA-Fe3O4按照1 mg/kg 的剂量,通过尾静脉注射到小鼠体内,每隔两天注射1 次,共注射4 次。在第4 次注射后第2 和第158 d 处死小鼠,分别为D2 和D158 组。取小鼠肝脏,在4%多聚甲醛中固定。利用常规操作,进行组织固定、包埋、切片。用核固红染液和普鲁士蓝染液对切片进行染色,再用苏木素-伊红染色法(hematoxylin-eosin staining,HE)对切片进行染色。
1.8 统计学分析
实验数据均表示为平均数±标准误(mean±SEM)。利用Graphpad Prism 软件中的One-way ANOVA 方法进行统计学分析,P<0.05 被认为差异具有统计学意义,∗P<0.05,∗∗P<0.01。
2 结果
2.1 HHSECs 对DMSA-Fe3O4 的摄取
使用透射电镜观察DMSA-Fe3O4的形貌。由图可见,DMSA-Fe3O4为球形,直径为5~10 nm(见图1(a)),平均水合粒径为(75.00±0.67)nm(见图1(b)),Zeta 电势为(-34.00±2.96)mV,说明颗粒表面带负电荷(见图1(c))。
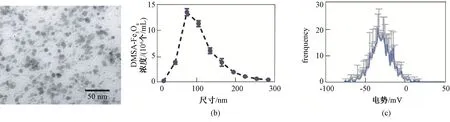
图1 DMSA-Fe3O4 的表征。(a)透射电镜图,标尺代表50 nm;(b)DMSA-Fe3O4 的水合粒径;(c)DMSAFe3O4 的电势Fig.1 Characterization of DMSA-Fe3O4.(a) Transmission electron microscopy image,scale bar represents 50 nm;(b) Dynamic diameter of DMSA-Fe3O4;(c) Zeta potential of DMSA-Fe3O4
将HHSECs 与DMSA-Fe3O4孵育6 h。可以看到,随着DMSA-Fe3O4浓度的提高,HHSECs 的蓝染程度相应增加(见图2(a));将孵育时间延长,HHSECs 的蓝染程度也相应增加(见图2(b))。结果表明,HHSECs 对DMSA-Fe3O4的摄取具有浓度和时间依赖性。

图2 HHSECs 对DMSA-Fe3O4 的摄取(所有图片的标尺一致,代表20 μm)。(a)HHSECs 对不同浓度DMSA-Fe3O4 的摄取(从左至右,DMSA-Fe3O4 的终浓度分别为0、25、50、100 μg/mL);(b)不同孵育时间对HHSECs 摄取DMSA-Fe3O4的影响(从左至右,孵育时间分别为0、2、4、6 h)Fig.2 Uptake of DMSA-Fe3O4 by HHSECs (The scale bar of all images is the same,representing 20 μm).(a) HHSECs uptake of DMSA-Fe3O4 with different concentrations (From left to right,the concentration of DMSA-Fe3O4 was 0,25,50,100 μg/mL respectively);(b) Uptake of DMSA-Fe3O4 by HHSECs with different incubation time (From left to right,the incubation time was 0,2,4,6 h)
2.2 DMSA-Fe3O4 对HHSECs 活性的影响
使用RTCA 方法检测DMSA-Fe3O4对HHSECs活性的影响,得到细胞指数(NCI),该数值越大说明细胞活性越高。由图3可见,共孵育12 h 后,对照组的NCI 值为1.08±0.01,50、100 和200 μg/mL 的DMSA-Fe3O4处理组的NCI 分别为0.75±0.01、0.80±0.02 和0.62±0.03(见图3(a));共孵育24 h 后,对照组的NCI 升高到1.42±0.01;而50、100 和200 μg/mL DMSA-Fe3O4处理组对应的NCI 分别为0.80±0.03、0.75±0.01 和0.53±0.04(见图3(b))。DMSA-Fe3O4处理组NCI 的增加幅度明显低于对照组,说明细胞的增殖受到一定程度的抑制,提示DMSA-Fe3O4的长时间和高剂量暴露会引起细胞损伤。
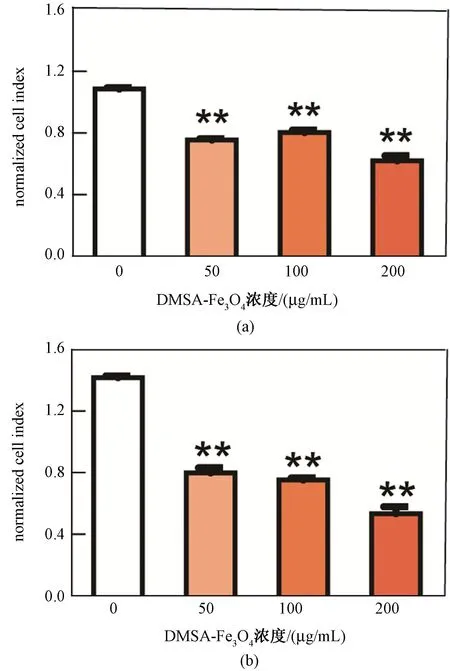
图3 与DMSA-Fe3O4 孵育不同时间后,HHSECs 细胞活性指数(∗∗表示与对照组相比P<0.01,n=3)。(a)孵育12 h;(b)孵育24 hFig.3 The cell viability induced by DMSA-Fe3O4 with different time (∗∗P<0.01 VS control,n=3).(a) The incubation time was 12 h;(b) The incubation time was 24 h
2.3 DMSA-Fe3O4 引起HHSECs 氧化应激
利用DCFH-DA 探针,检测HHSECs 中ROS 水平。由图4可见,随着DMSA-Fe3O4浓度的增加,HHSECs 细胞的DCFH-DA 平均荧光强度(MFI)明显增高,分别为4.57×105±0.20×105、6.43×105±0.15×105、6.23×105±0.15×105、6.04×105±0.29×105(见图4(a)),说明DMSA-Fe3O4提高了HHSECs 中的ROS水平,引起细胞的氧化应激反应。HO-1 是细胞氧化应激的标志性基因,利用q-PCR 对HO-1 的表达情况进行分析。结果显示,DMSA-Fe3O4的暴露使细胞内HO-1 基因的表达显著上调;特别是高浓度200 μg/mL处理组,其HO-1 基因的表达水平是对照组的20.8 倍(见图4(b))。
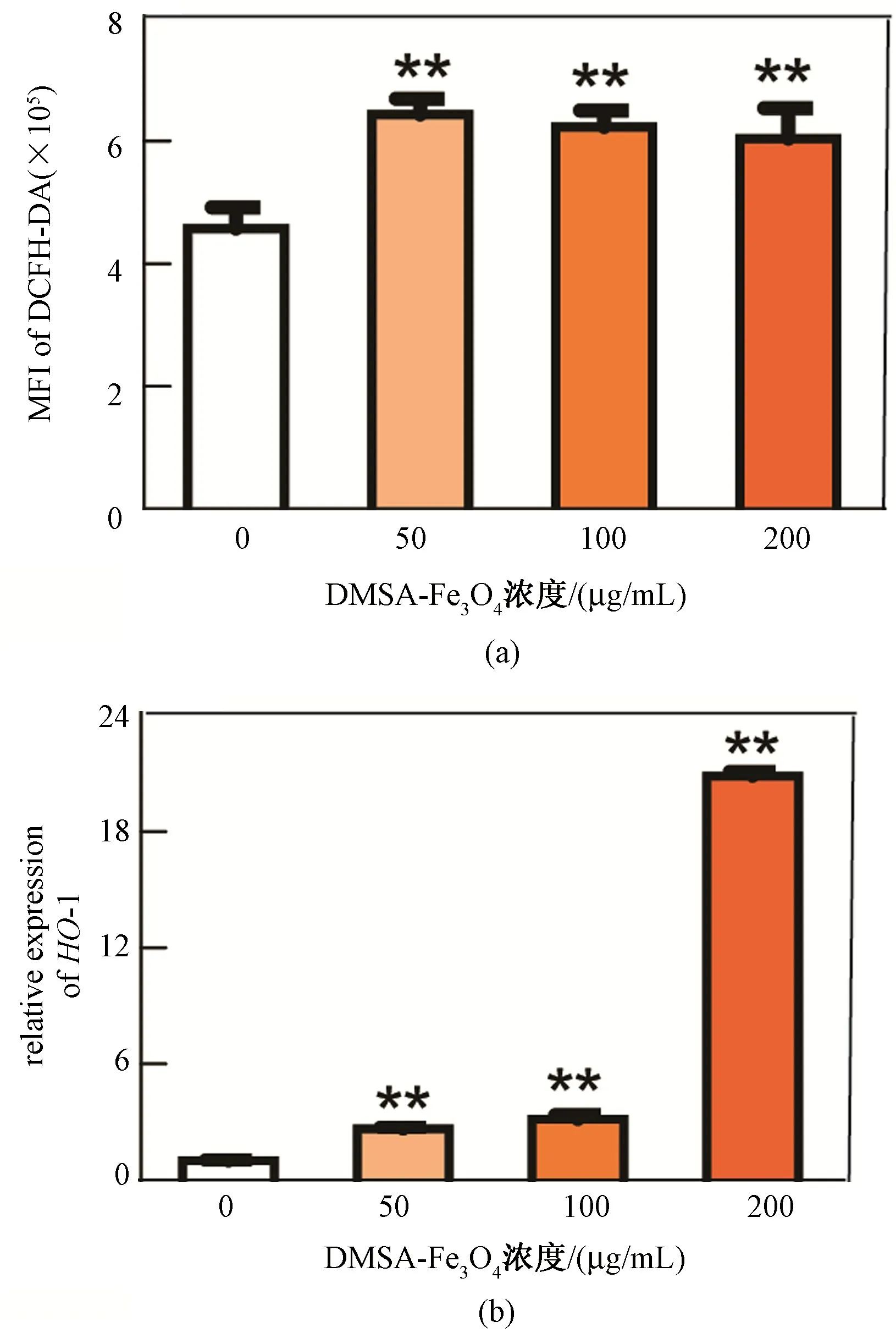
图4 DMSA-Fe3O4 引起HHSECs 氧化应激(∗∗表示与对照组相比,P<0.01,n=3)。(a)不同浓度DMSAFe3O4 处理后,HHSECs 细胞内DCFH-DA 的平均荧光强度值;(b) 不同浓度DMSA-Fe3O4 处理后,HHSECs 中HO-1 基因相对表达水平Fig.4 DMSA-Fe3O4 induced HHSECs oxidative stress (∗∗P<0.01 vs control,n=3).(a) MFI of DCFH-DA in HHSECs with different treated concentration of DMSA-Fe3O4;(b) Relative HO-1 gene expression of HHSECs with different treated concentration of DMSA-Fe3O4
2.4 DMSA-Fe3O4 激活HHSECs 缺氧相关信号通路
进一步的研究发现,与DMSA-Fe3O4孵育后,HHSECs 细胞中HIF-1α基因的表达显著升高,50、100 和200 μg/mL 的DMSA-Fe3O4处理组的细胞HIF-1α基因表达水平分别是对照组的1.65、1.68和2.01 倍(见图5(a))。HIF-1α基因下游的VEGF基因表达水平也随之升高,50、100 和200 μg/mL 的DMSA-Fe3O4处理组的细胞VEGF基因表达水平分别是对照组的1.64、2.0 和4.2 倍(见图5(b))。结果表明,DMSA-Fe3O4暴露促进了HIF-1α基因和VEGF基因的表达,并具有一定的浓度依赖性。
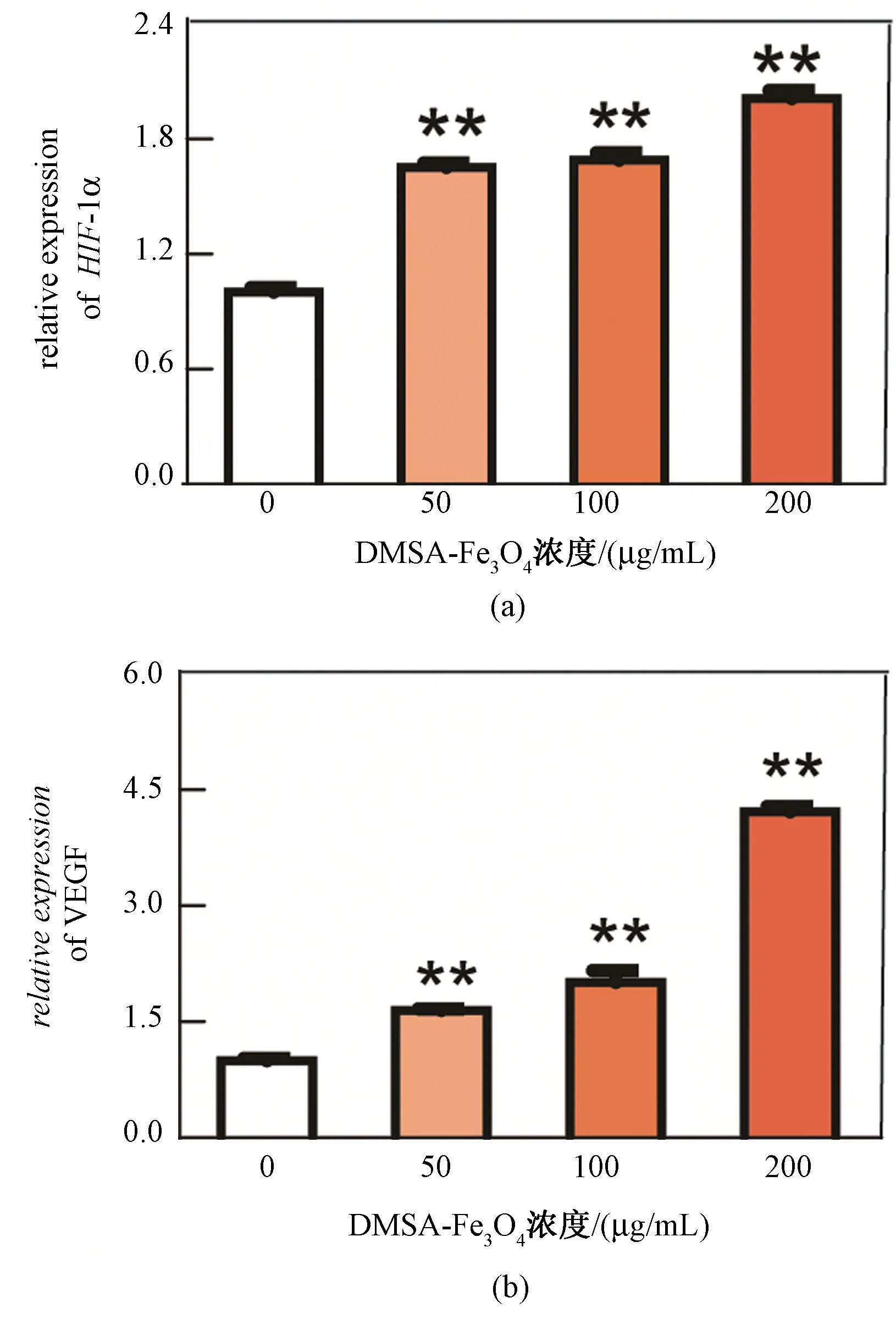
图5 DMSA-Fe3O4 对HHSECs 中HIF-1α 和VEGF基因表达的影响(∗∗表示与对照组相比,P<0.01,n=3)。(a)HIF-1α 基因的表达;(b)VEGF 基因的表达Fig.5 The influence of DMSA-Fe3O4 on the gene expression of HIF-1α and VEGF for HHSECs (∗∗P<0.01 vs control,n=3).(a) HIF-1α gene expression;(b) VEGF gene expression
2.5 DMSA-Fe3O4 对小鼠肝脏组织的影响
最后一次注射DMSA-Fe3O4后,分别在第2 d天(D2)和第158 d(D158)处死小鼠,取肝脏组织进行普鲁士蓝染色。由图6(a)可见,对照组肝脏中几乎没有细胞蓝染;D2 组小鼠肝脏中蓝染细胞的数量明显增多,且主要集中在内皮细胞(实线短箭头)和库普弗细胞(虚线长箭头)中(见图6(b));D158 组的小鼠肝脏中蓝染细胞(箭头所示)的数量明显下降(见图6(c))。这些结果说明,静脉注射后,DMSA-Fe3O4在肝脏中会有一定蓄积,但大部分可在半年内排出。
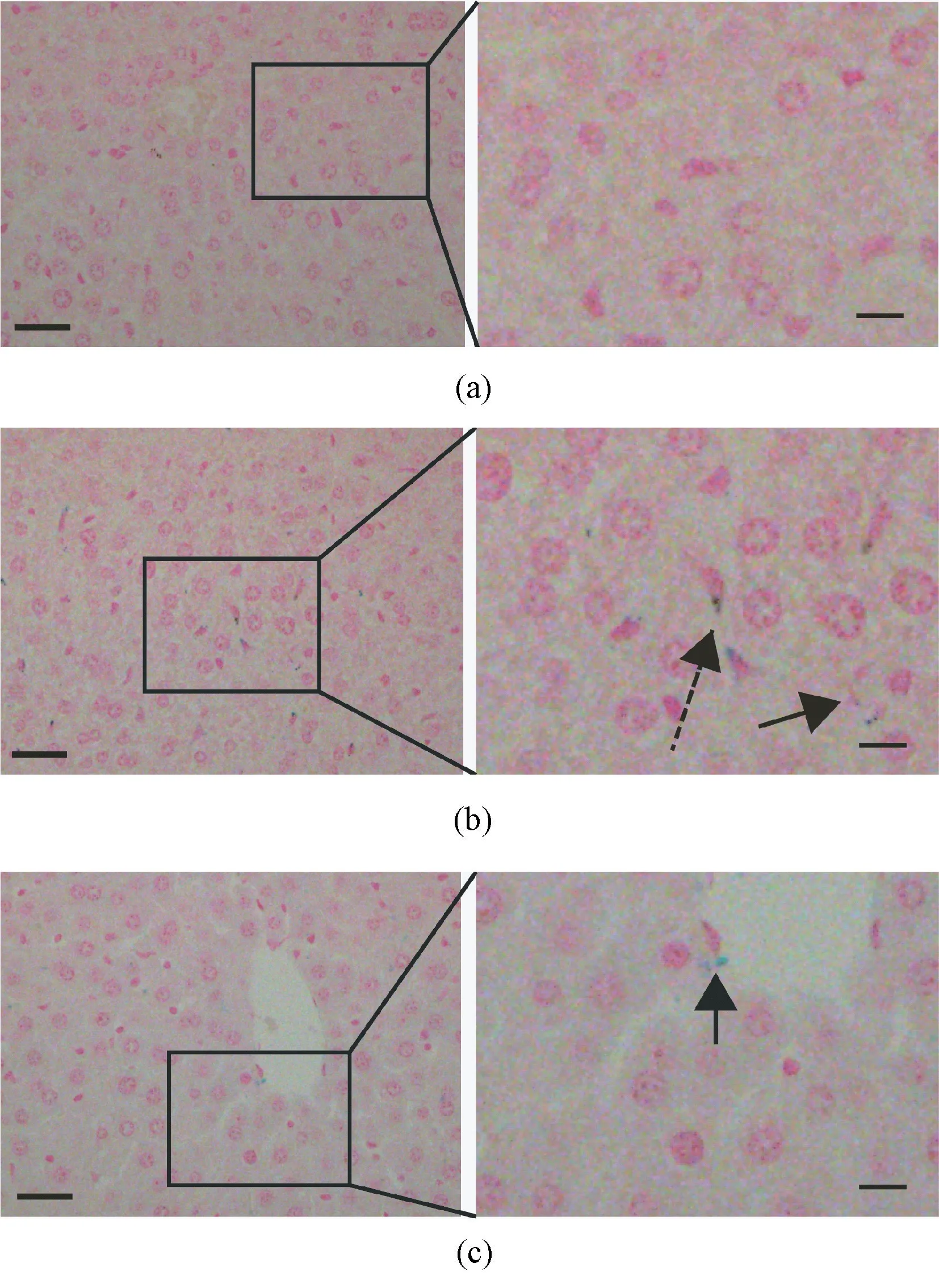
图6 小鼠肝脏组织的普鲁士蓝染色结果(每行左侧标尺代表30 μm,右侧标尺代表10 μm)。(a)对照组肝脏组织染色;(b)DMSA-Fe3O4 注射第2 d,小鼠肝脏组织染色(虚线长箭头所示为库普弗细胞,实线短箭头所示为内皮细胞);(c)DMSA-Fe3O4 注射第158 d,小鼠肝脏组织染色(箭头所示为蓝染的内皮细胞)Fig.6 Prussian staining images of liver tissue (Scale bars in left column images represent 30 μm,scale bars in right column images represent 10 μm).(a)Representative images of liver tissue for control mice;(b) Representative images of liver tissue for mice sacrificed on D2 post DMSA-Fe3O4administration(The long dashed arrow points to Kupffer cells,the short solid arrow points to endothelial cell);(c)Representative images of liver tissue for mice sacrificed on D158 post DMSA-Fe3O4 administration(The arrow points to blue-stained endothelial cells)
肝脏组织的HE 染色结果显示,与对照组(见图7(a))相比,D2 组的肝脏组织结构相对松散,细胞核和细胞质染色变浅,部分细胞出现核固缩或消失,可见坏死的肝细胞(箭头所示)(见图7(b));D158 肝脏组织与对照组相似,结构有序,细胞核分布整齐,肝细胞状态良好(见图7(c))。上述结果表明,多次注射DMSA-Fe3O4后,在短时间内可引起一定程度的肝细胞损伤,但损伤是可逆转的,半年内可以恢复。
3 讨论
本研究的结果表明,DMSA-Fe3O4可以被HHSECs 摄取,并引起细胞的氧化应激反应,进而会引起一定程度的肝损伤,但是随着DMSA-Fe3O4从体内排出,肝脏组织的病理性改变可在半年内恢复到对照组的状态。内皮细胞覆盖在血管内表面,构成具有组织特异性的内皮屏障[17],在血管再生、凝血和维持血管稳态以及免疫功能等方面起重要作用[18]。
有文献报道称,内皮细胞易于主动摄取纳米颗粒[19];本课题组前期报道过DMSA-Fe3O4可以被人脐静脉内皮细胞(HUVECs)摄取,并引起细胞活性降低[20]。比较DMSA-Fe3O4对两种内皮细胞的作用,在相同的DMSA-Fe3O4浓度下,HUVECs 活性的下降程度高于HHSECs 的状况,即HUVECs 对DMSA-Fe3O4更加敏感,这提示不同器官中内皮细胞对DMSA-Fe3O4引起的氧化应激损伤耐的受性不同,后续的研究应重视和区分纳米颗粒对不同器官组织中内皮细胞的效应。DMSA-Fe3O4可被内皮细胞大量摄取,这也是其导致细胞损伤的重要原因。在前期研究中,使用山梨醇羧甲基醚包覆的三氧化二铁纳米颗粒(PSC-Fe2O3)与HUVECs 细胞孵育。这种纳米颗粒不被HUVECs 摄取,在较高浓度下对细胞活性无明显影响,但引起了内皮细胞的内皮间质转分化[15]。鉴于不同器官组织的内皮细胞具有特殊性,后续的研究应重视IONPs 的理化性质,以及对不同来源的内皮细胞的影响及机制。
本研究推测,DMSA-Fe3O4引起的可逆性肝损伤主要通过两种机制:一方面,引起HHSECs 的氧化应激而使ROS 水平升高,导致细胞上调HIF-1α,由此促进了VEGF的表达,而VEGF的高表达会引起血管异常增生和肝损伤[11,21-22];另一方面,DMSAFe3O4可在溶酶体中缓慢降解,会造成细胞内铁过载[23]。肝脏是铁代谢调节的中心器官之一,可以将降解的铁储存起来,是铁超载损伤的主要靶器官[24]。需要强调的是,DMSA-Fe3O4引起的肝脏组织损伤是可逆的,从第158 d 的肝脏组织病理切片上没有观察到明显的肝损伤现象,这是因为DMSAFe3O4可以从肝脏中排出,而且肝脏具有较强的自我更新和修复能力[25]。
4 结论
HHSECs 对DMSA-Fe3O4的摄取具有时间和浓度依赖性,DMSA-Fe3O4引起细胞ROS 水平升高和氧化应激反应。多次静脉注射DMSA-Fe3O4可蓄积在肝脏中,并引起短暂性肝细胞损伤。随着DMSAFe3O4从肝脏中排出,这种肝损伤可恢复。
