雷公藤红素调控Hedgehog通路促进人卵巢癌SKOV-3细胞凋亡
2022-01-18赵晓娟高文军郭慧玲胡律江饶赟梅鸥
赵晓娟,高文军*,郭慧玲,胡律江,饶赟,梅鸥
(1江西中医药大学药学部,南昌330006;2江西中医药大学附属医院药学部,南昌330006;3江西中医药大学附属医院妇科,南昌330006;4江西中医药大学附属医院骨科,南昌330006)
卵巢癌是女性生殖器官常见的肿瘤之一[1],发病率高居不下。卵巢癌约占所有女性生殖道肿瘤的23%,但其死亡率却高达47%[2]。目前,卵巢癌发生的病因还不明确,可能跟内分泌、遗传等因素有关。卵巢癌的发生伴随着基因突变和相关信号通路被异常激活。Hedgehog信号通路与多种肿瘤细胞的形成、生长具有相关性[2]。探讨卵巢癌的凋亡与Hedgehog信号通路的关系,有助于卵巢癌发病机制的研究,提供新的方向用于卵巢癌的防治。Hedgehog信号通路抑制剂环巴胺在成体中具有抗肿瘤作用,且在胰腺癌、胆管癌、卵巢癌、肝癌等的体内或体外实验中均得到证实。近年来有大量研究表明,雷公藤红素有显著的抗肿瘤作用,但雷公藤红素是否通过调控Hedgehog信号通路抑制人卵巢癌SKOV-3细胞凋亡有待证明。
材料与方法
1 材料
人卵巢癌细胞株-SKOV3,来自中国科学院典型培养物保藏委员会细胞库,编号HTB-78;雷公藤红素(分子式C29H38O4,分子量450.61,纯度99%;批号:48748-32-2)购自南京春秋生物工程有限公司;RPMI-1640 培养基(批号:507767)购自GIBCO公司;胎牛血清(批号:11011-8613)购自杭州亿枫生物公司;考马斯亮蓝蛋白定量试剂盒(批号:AR0145)购自武汉科昊佳生物科技有限公司 ;TRIzol 试剂购自美国 Invitrogen公司;M-MLV逆转录酶试剂盒和 SYBR Green RT-qPCR试剂盒购自北京索莱宝科技有限公司;兔抗小鼠GAPDH、SHH、PTCH1、Gli1、SMO、Bcl-2、Gli3和Caspase-3等一抗及辣根过氧化物酶标记的羊抗兔二抗均购自Thermo Fisher公司;蛋白印迹仪(PROFIBLOT 48)购自帝肯(上海)贸易有限公司;细胞培养箱(BC-J80/160S)购自上海博迅医疗生物仪器股份有限公司;流式细胞仪(CytoFLEX LX)购自美国贝克曼库尔特。
2 实验分组
实验分为5组:空白对照组(不给予任何药物处理)、雷公藤红素低剂量组(5nmol /L雷公藤红素作用48h)、雷公藤红素中剂量组(10nmol/L雷公藤红素作用48h)、雷公藤红素高剂量组(20nmol/L雷公藤红素作用48h)、环巴胺组(5μmol/L环巴胺作用48h)。RPMI-1640培养基(含10%胎牛血清)传代培养SKOV-3细胞。将传代培养的SKOV-3细胞,调整为1×105个/ml细胞悬液,分组接种于培养板中(100μl/孔)。按照实验方法进行细胞分组给药,培养48h,空白组(100μl 1640 培养基/孔)。
3 MTT法检测细胞活力
检测各分组的吸光度(OD490)值情况,计算各组SKOV-3细胞的存活率(细胞存活率(%) = 实验组OD490值/空白组OD490值×100%)。取3次实验平均值计算存活率。
4 流式细胞术检测细胞凋亡
收集按实验分组培养后的SKOV-3细胞,调整浓度为1×106/ml,离心、洗涤后加入乙醇固定;离心洗涤后加PI染色,流式细胞仪检测细胞凋亡。
5 蛋白质免疫印迹分析
将各组细胞用预冷的PBS润洗3次,后加入RIPA 裂解液(含 1%PMSF)并用刮刀刮下来,将悬液置于1.5ml EP 管中,置于摇床上冰浴裂解30min。随后于12000r/mg 离心30min 并将上清液置于新的1.5ml EP 管中。使用 BCA 法测定蛋白浓度后,将蛋白浓度调至 2mg/ml 备用,使用 5×蛋白上样缓冲液混匀蛋白上清后于 100℃中加热 5min,待其充分变性。10% SDS-PAGE 电泳后转膜并置于含 5% BSA的TBST 溶液中封闭 1h,加一抗(1:200~2000),4℃摇匀孵育过夜。一抗结束后使用TBST洗膜5min×3次,随后二抗(1:1000)4℃孵育2h。次日,洗膜5min×3次后采用 ECL 化学发光法于暗室中显影,应用 Image lab 进行凝胶成像分析。GAPDH为内参,计算目的蛋白相对表达量,取3次实验平均值计算结果。
6 实时定量逆转录PCR检测
TRIzol 试剂从细胞中分离总 RNA。用M-MLV逆转录酶试剂盒将RNA逆转录为cDNA,并根据SYBR Green RT-qPCR 试剂盒步骤通过ABI7500实时PCR系统进行RT-qPCR反应,所用引物序列见表1。qPCR反应条件:94℃进行 2min,然后在94℃15s,62℃40s,共进行40个循环。用2-△△CT比较方法确定每个靶基因的mRNA相对表达量,并以GAPDH mRNA进行归一化。

表1 PCR引物序列Tab.1 Sequences of the primers for PCR
7 统计学方法
采用SPSS22.0统计学软件统计分析数据,符合正态分布的计量资料以均数±标准差表示,检验方差齐性后,多组均数比较采用单因素方差分析,两两比较行LSD-t检验,以P<0.05为差异具有统计学意义。
结 果
1 雷公藤红素降低SKOV-3细胞存活率
MTT法分析显示:与空白对照组比较,各雷公藤红素组和环巴胺组SKOV-3细胞活力显著降低;与低剂量组比较,中、高剂量组和环巴胺组SKOV-3细胞活力降低更为明显,以高剂量组的细胞活力降低最为显著,表明雷公藤红素抑制SKOV-3细胞的存活,其抑制作用随雷公藤红素剂量的升高而逐渐增强(表2)。
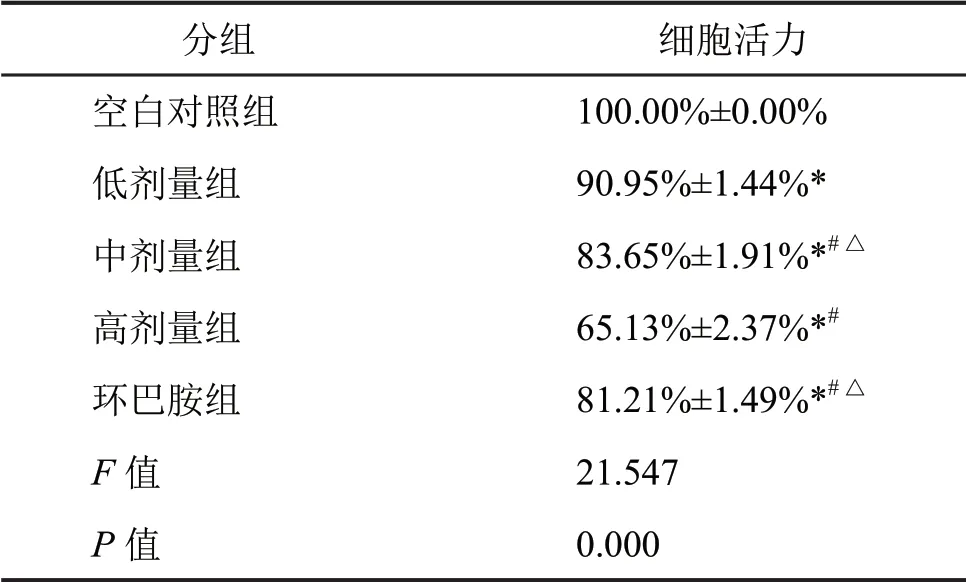
表2 雷公藤红素对SKOV-3细胞活力的影响Tab.2 Effect of tripterine on the viability of SKOV-3 cells
2 雷公藤红素促进SKOV-3细胞凋亡
流式细胞术分析显示,与空白对照组比较,各雷公藤红素组和环巴胺组SKOV-3细胞凋亡率明显升高;与低剂量组比较,中、高剂量组和环巴胺组SKOV-3细胞凋亡率升高更为明显,以高剂量组升高最为显著,表明雷公藤红素促进SKOV-3细胞凋亡,其促进凋亡作用随雷公藤红素剂量升高而逐渐增强(图1,表3)。
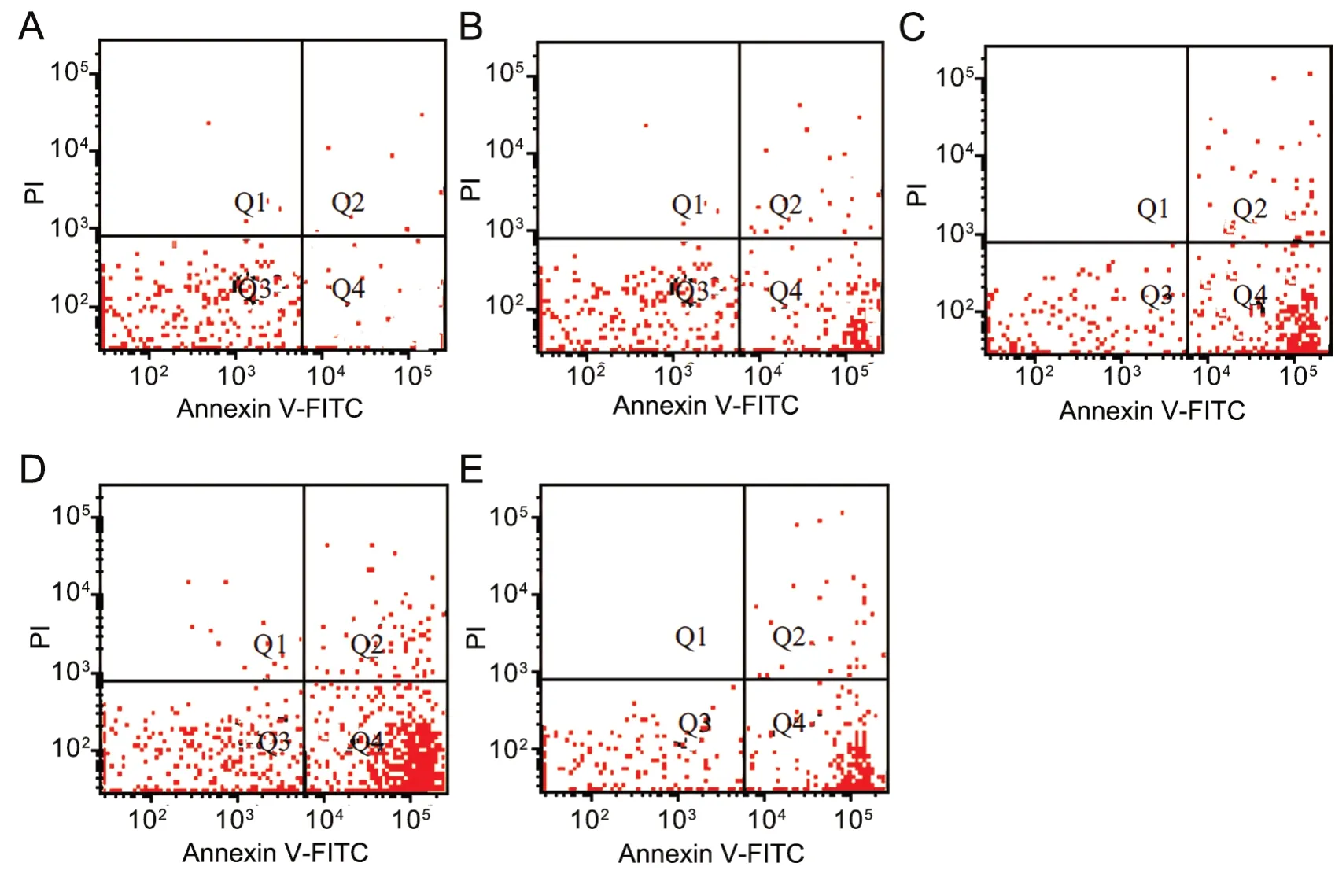
图1 雷公藤红素诱导SKOV-3细胞凋亡作用的流式细胞术分析。A,空白对照组;B,低剂量组;C,中剂量组;D,高剂量组;E,环巴胺组Fig. 1 Flow cytometry analysis of tripterine-induced apoptosis of SKOV-3 cells. A, blank control group; B, low-dose group; C, medium-dose group; D,high-dose group; E, cyclopamine group
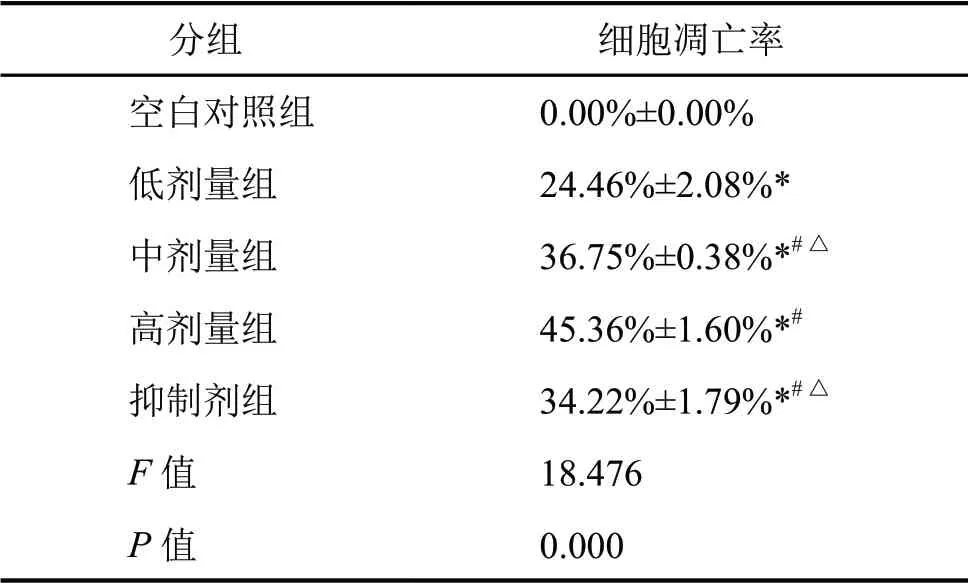
表3雷公藤红素对SKOV-3细胞的凋亡诱导作用Tab.3 Effect of tripterine on the apoptosis of SKOV-3 cells
3 雷公藤红素下调SHH、SMO、PTCH1、Gli1和Bcl-2的表达上调Gli3和Caspase-3表达
为了明确雷公藤红素促进SKOV3细胞凋亡的机制,检测了不同剂量雷公藤红素对Hedgehog通路相关蛋白表达的影响。Western blot检测显示:低、中、高剂量雷公藤红素和环巴胺显著降低SHH、SMO、PTCH1、Gli1和Bcl-2水平,升高Gli3、Caspase-3水平,尤以高剂量组作用最为明显(图2,表4)。RT-qPCR分析显示:雷公藤红素对Hedgehog通路相关蛋白mRNA表达的影响与对蛋白水平。
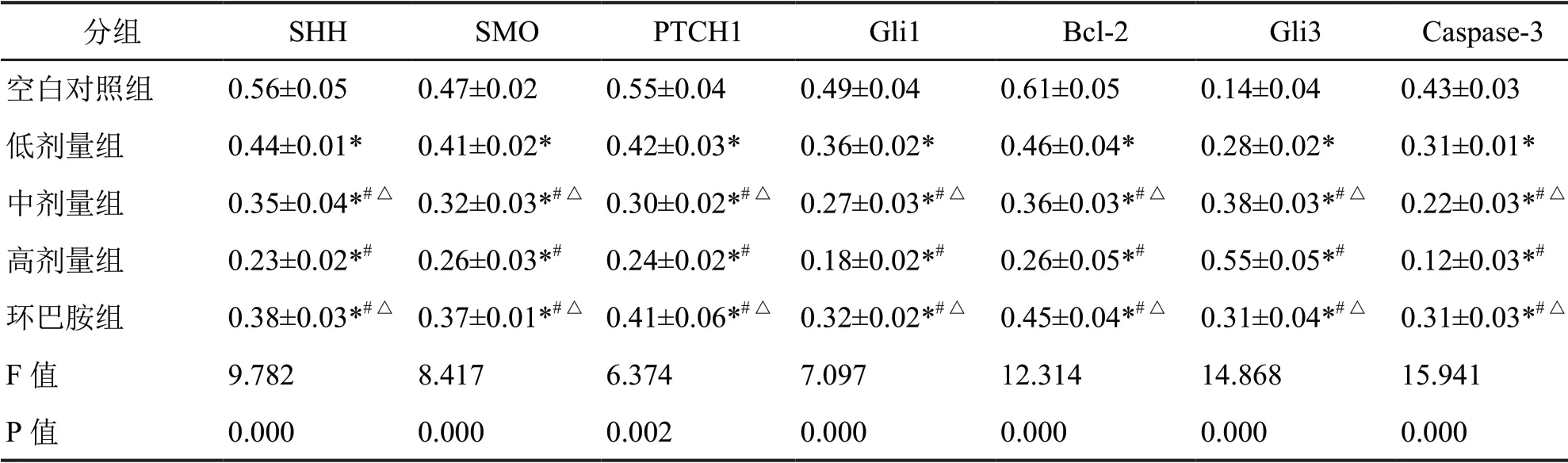
表4 雷公藤红素对Hedgehog通路和凋亡相关蛋白mRNA表达的影响Tab.4 Effects of tripterine on the mRNA expression of Hedgehog pathway-related and apoptosis-related proteins (`x±s, n=3)

图2 雷公藤红素对SKOV-3细胞Hedgehog通路和凋亡相关蛋白表达影响的Western blot检测。A,空白对照组;B,低剂量组;C,中剂量组;D,高剂量组;E,环巴胺组Fig. 2 Western blot analysis for the effect of tripterine on the expression of Hedgehog pathway-related and apoptosis-related proteins in SKOV-3 cells. A, blank control group; B, low-dose group; C, medium-dose group;D, high-dose group; E, cyclopamine group
讨 论
卵巢癌病人占女性新发肿瘤病人的4%,其致死率为5%[3]。研究卵巢癌干细胞的增殖、自我更新、凋亡机制对于降低卵巢癌的死亡率有着极大的意义和作用。安申[4]等研究表明,雷公藤红素可逆转SKOV3细胞对DDP 的耐药性,促进细胞凋亡。本实验通过分析雷公藤红素处理后的SKOV-3细胞凋亡情况及Hedgehog信号通路SHH、PTCH1、Gli1、Gli3、SMO及下游Bcl-2、Caspase-3相关因子的变化,发现雷公藤红素调控 Hedgehog通路,诱导卵巢癌细胞的凋亡。环巴胺在多种人类肿瘤中研究发现可明显抑制癌细胞增殖诱导癌细胞凋亡,其中环巴胺可抑制卵巢癌、宫颈癌细胞生长、迁移、调控周期及诱导凋亡,且有研究[5]指出,SHH、Dhh、Ptch、SMO和Gli1与细胞增殖有显著相关性,当应用环巴胺或Gli1 siRNA阻断Hedgehog信号后可明显降低细胞增殖,阻滞细胞于G1期并诱导卵巢癌细胞凋亡。在本研究中,雷公藤红素对Hedgehog信号作调控作用更加明显。
雷公藤红素通过Hedgehog通路调控卵巢癌细胞的凋亡。研究发现,肿瘤干细胞自稳态的维持、细胞增殖、肿瘤形成都有Hedgehog信号通路参与[6],即Hedgehog信号通路参与了卵巢癌细胞的凋亡。细胞的凋亡与肿瘤的生发有着密切的联系,当细胞由于各种因素使死亡受到抑制而未发生死亡,致使细胞继续生长,最终导致肿瘤产生[7]。在卵巢癌细胞中,经典的Hedgehog信号通路含HH、Patched、SMO、Gli 4个重要基因[8]。Hedgehog(Hh)、Ptch、SMO及Gli1不仅是Hedgehog信号通道的成分,也有着反馈调控机制[9]。SMO 蛋白是SHH 信号通路的转换器,SHH 蛋白不表达时,Ptch抑制SMO,但启动因子SHH 与受体Ptch 结合时,SMO发挥信号转导作用,上调下游基因Gli表达, 进而激活目的基因表达[10-11]。
Western blot 和定量PCR检测雷公藤红素处理的卵巢癌SKOV-3细胞中SHH、Ptch1、SMO表达水平显示,在一定浓度内,随着雷公藤红素浓度升高,SHH被抑制,Ptch1抑制SMO,表达,下调Gli的表达后,进而调控目的基因表达。
王丽霞等研究[12],在下调Gli的表达后,抗凋亡蛋白Bcl-2 的表达下降,凋亡蛋白Caspase-3 的表达增高,促进SKOV3 的凋亡。

表5 雷公藤红素对SKOV3细胞Hedgehog通路和凋亡相关蛋白表达的影响Tab.5 Effect of tripterine on the expression of Hedgehog pathway-related and apoptosis-related proteins in SKOV3 cells
通过实验雷公藤红素处理过的卵巢癌SKOV-3细胞中Gli1、Gli3及下游Bcl-2,Caspase-3的蛋白和mRNA表达水平得知,在一定浓度内,随着雷公藤红素浓度升高,雷公藤红素抑制Gli1表达,促进Gli3表达,从而Bcl-2抗凋亡蛋白表达下降,Caspase-3凋亡蛋白表达增高。Bcl-2基因家族表达产物Bcl-2蛋白作用于线粒体膜、核膜和内质网,诱导细胞发生凋亡[13]。Caspase蛋白是一种可促使细胞凋亡的酶[14-15]。Bcl-2 可以抑制Caspase-2的活化, Caspase-2活化可以阻断Bcl-2表达,形成正性的反馈[16]。有研究发现,雷公藤红素可以抑制C6胶质瘤细胞增殖,促使Caspase-3凋亡蛋白的上调,下调抗凋亡蛋白Bcl-2,诱导细胞凋亡[17]。与本实验得出的结果相同,藤红素通过抑制Hedgehog信号通道中SHH、Ptch1、SMO的表达,抑制了Gli1表达,促进了Gli3表达。而Bcl-2抗凋亡蛋白表达下降, Caspase-3凋亡蛋白表达增高,促进卵巢癌细胞的凋亡。
本研究初步证明雷公藤红素通过Hedgehog信号通路调控人卵巢癌SKOV-3细胞凋亡,为卵巢癌的临床医疗及预后判断提供了参考。但是,人卵巢癌SKOV-3细胞的凋亡在雷公藤红素的影响下的具体机制仍待深入研究,需进一步对其细胞周期变化等进行验证。
