猪源牛病毒性腹泻病毒与猪瘟病毒一步法双重RT-PCR鉴别检测方法的建立及应用
2022-01-18王怀禹粟元文
梁 洪 , 王怀禹 , 粟元文 , 魏 玲
(南充职业技术学院 , 四川 南充 637000)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)和猪瘟病毒(Classical swine fever virus,CSFV)在分类学上均属于黄病毒科瘟病毒属,二者的核苷酸序列同源性达60%以上,且二者存在抗原交叉性和免疫学交叉反应性[1]。CSFV仅感染猪,我国自2007年开始采取猪瘟强制免疫政策,有效防止了猪瘟的大规模流行。自2017年开始,我国取消了猪瘟强制免疫政策,改为对符合条件的养殖场实行“先打后补”的财政补助政策,表明我国猪瘟防控工作取得了阶段性成果,但非典型性猪瘟的感染仍时有发生,猪瘟的综合防控仍任重道远[2-4]。BVDV主要感染牛,但其还可以感染猪、羊、鹿以及野生动物,BVDV感染猪后可引起母猪流产、死胎、畸形胎等繁殖障碍以及仔猪消瘦、生长缓慢等类似非典型性猪瘟的临床症状和病理变化[5-6]。近年来,我国猪群中BVDV感染的报道不断增多[7-9],猪源BVDV的流行不但直接给养猪业造成了经济损失,也增加了猪瘟防控工作的困难。加强猪源BVDV和CSFV的鉴别诊断,对猪病的整体防控至关重要,鉴于此,本试验根据猪源BVDV与CSFV的保守区序列分别设计特异性鉴别检测引物,经一步法双重RT-PCR反应条件的优化,建立了鉴别检测猪源BVDV与CSFV的一步法双重RT-PCR方法,以期为猪群中这2种致病原的临床鉴别诊断提供一种方便、快速的分子生物学检测方法,为猪源BVDV与CSFV的综合防控提供技术保障。
1 材料与方法
1.1 病毒 猪源牛病毒性腹泻病毒(BVDV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪细小病毒(PPV)、猪圆环病毒2型(PCV-2)、猪流行性腹泻病毒(PEDV)、猪乙型脑炎病毒(JEV)、猪传染性胃肠炎病毒(TGEV),均由四川省南充市畜禽疫病防控与检测重点实验室保存。
1.2 主要试剂与试剂盒 病毒基因组RNA/DNA提取试剂盒,购自美国AXYGEN公司;一步法RT-PCR扩增试剂盒,购自日本TaKaRa公司。
1.3 引物设计与合成 分别根据猪源BVDV、CSFV基因组5′UTR序列设计2对分别扩增猪源BVDV和CSFV的引物(引物信息见表1),引物委托生工生物工程(上海)股份有限公司合成。
1.4 核酸提取 利用病毒基因组RNA/DNA共同提取试剂盒分别提取猪源BVDV、CSFV、猪源BVDV/CSFV(猪源BVDV和CSFV混合毒,即将猪源BVDV和CSFV等量混合)、PRRSV、PRV、PPV、PCV-2、PEDV、JEV、TGEV的病毒基因组RNA或DNA。
1.5 猪源BVDV一步法RT-PCR反应条件的确定 采用设计合成的猪源BVDV检测引物,利用一步法RT-PCR扩增试剂盒,对提取的猪源BVDV RNA进行一步法RT-PCR扩增。通过对退火温度、模板含量、引物含量等主要参数指标进行优化,确定猪源BVDV一步法RT-PCR扩增的反应体系和反应程序。
1.6 CSFV一步法RT-PCR反应条件的确定 采用设计合成的CSFV检测引物,利用一步法RT-PCR扩增试剂盒,对提取的CSFV RNA进行一步法RT-PCR扩增。通过对退火温度、模板含量、引物含量等主要参数指标进行优化,确定CSFV一步法RT-PCR扩增的反应体系和反应程序。
1.7 猪源BVDV和CSFV一步法双重RT-PCR反应条件的确定 将猪源BVDV检测引物和CSFV检测引物等量混合。采用混合引物,利用一步法RT-PCR扩增试剂盒,对猪源BVDV/CSFV混合RNA进行一步法RT-PCR扩增。通过对退火温度、模板含量、引物含量等主要参数指标进行优化,确定猪源BVDV和CSFV一步法双重RT-PCR扩增的反应体系和反应程序。
1.8 特异性试验 利用优化确定的猪源BVDV和CSFV一步法双重RT-PCR反应条件分别对猪源BVDV、CSFV、猪源BVDV/CSFV、PRRSV、PRV、PPV、PCV-2、PEDV、JEV、TGEV的基因组RNA或DNA进行检测,确定一步法双重RT-PCR鉴别检测方法的特异性。
1.9 敏感性试验 利用紫外分光光度计对提取的猪源BVDV、CSFV、猪源BVDV/CSFV混合RNA分别进行浓度测定,然后利用灭菌水将3个RNA依次进行10倍系列倍比稀释。利用优化确定的猪源BVDV和CSFV一步法双重RT-PCR反应条件依次对不同稀释倍数的猪源BVDV、CSFV、猪源BVDV/CSFV混合RNA进行检测,确定一步法双重RT-PCR鉴别检测方法的敏感性。
1.10 重复性试验 利用优化确定的猪源BVDV和CSFV一步法双重RT-PCR反应条件分别对BVDV、CSFV、猪源BVDV/CSFV、3份猪源BVDV感染病料、3份CSFV感染病料、3份猪源BVDV和CSFV均阴性病料、PRRSV、PRV、PPV、PCV-2、PEDV、JEV、TGEV进行检测,在3个不同时间重复检测3次,确定一步法双重RT-PCR鉴别检测方法的重复性。
1.11 临床应用 采集南充及周边地区疑似猪瘟病毒感染病料样品94份,分别利用优化确定的猪源BVDV和CSFV一步法双重RT-PCR反应条件、优化确定的猪源BVDV一步法RT-PCR反应条件、优化确定的CSFV一步法RT-PCR反应条件进行检测,统计分析南充及周边地区猪源BVDV和CSFV的阳性感染率,并比较分析猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法分别相对于猪源BVDV一步法RT-PCR检测方法、CSFV一步法RT-PCR检测方法的符合率。
2 结果
2.1 猪源BVDV一步法RT-PCR反应条件的确定 通过优化确定最适退火温度为51 ℃,一步法RT-PCR反应体系最适模板含量为3 μL,最适引物含量为0.5 μL,进而确定猪源BVDV一步法RT-PCR扩增的反应体系:2×1 Step Buffer 12.5 μL、Step Enzyme Mix 0.5 μL、上下游引物各0.5 μL、RNA 5 μL、H2O 8 μL。猪源BVDV一步法RT-PCR扩增的反应程序:50 ℃ 30 min;95 ℃ 5 min;94 ℃ 30 s,51 ℃ 30 s, 72 ℃ 30 s,30个循环;72 ℃ 10 min。
2.2 CSFV一步法RT-PCR反应条件的确定 通过优化确定最适退火温度为52 ℃,一步法RT-PCR反应体系最适模板含量为3 μL,最适引物含量为0.5 μL, 进而确定CSFV一步法RT-PCR扩增的反应体系:2×1 Step Buffer 12.5 μL、Step Enzyme Mix 0.5 μL、上下游引物各0.5 μL、RNA 5 μL、H2O 8 μL。 CSFV一步法RT-PCR扩增的反应程序:50 ℃ 30 min;95 ℃ 5 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s, 30个循环;72 ℃ 10 min。
2.3 猪源BVDV和CSFV一步法双重RT-PCR反应条件的确定 通过优化确定最适退火温度为51 ℃, 最适模板含量为5 μL,最适引物含量为0.5 μL,进而确定猪源BVDV和CSFV一步法双重RT-PCR扩增的反应体系:2×1 Step Buffer 12.5 μL、Step Enzyme Mix 0.5 μL、BVDV和CSFV上下游引物各0.5 μL、混合RNA 5 μL、H2O 5 μL。猪源BVDV和CSFV一步法双重RT-PCR的反应程序:50 ℃ 30 min;95 ℃ 5 min;94 ℃ 30 s,51 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。
2.4 特异性试验 如图1所示,建立的猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法对猪源BVDV可扩增出1条185 bp的特异性条带,对CSFV可扩增出1条342 bp的特异性条带,对猪源BVDV/CSFV可同时扩增出185 bp和342 bp的2条特异性条带,对PRRSV、PRV、PPV、PCV-2、PEDV、JEV、TGEV均无任何扩增条带,均与试验理论预期结果相符,表明该猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法具有良好特异性。
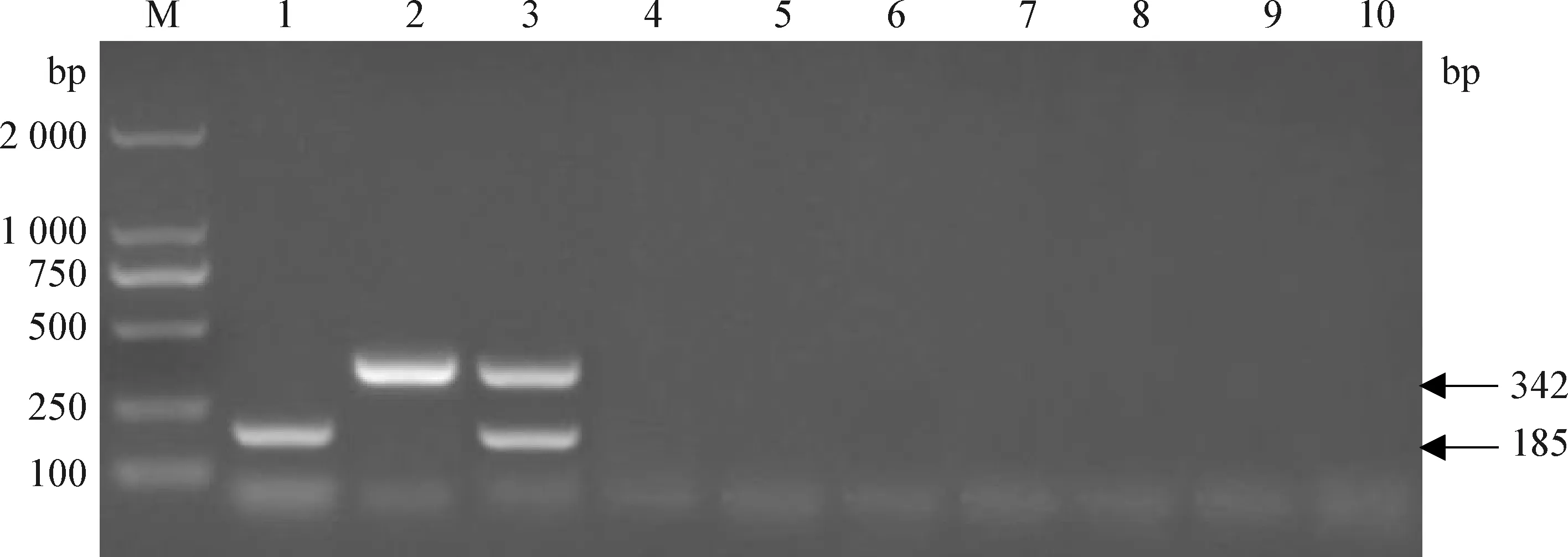
图1 特异性试验结果Fig.1 Result of specific testM: DL-2 000 marker; 1: 猪源BVDV(BVDV from pig); 2: CSFV; 3: BVDV/CSFV; 4: PRRSV; 5: PRV; 6: PPV; 7: PCV-2; 8: PEDV; 9: JEV; 10: TGEV
2.5 敏感性试验 经紫外分光光度计测定猪源BVDV、CSFV、BVDV/CSFV混合RNA的浓度分别为1.9 μg/μL、1.7 μg/μL、1.6 μg/μL。如图2、图3、图4所示,当猪源BVDV、CSFV、BVDV/CSFV混合RNA分别稀释至10-4、10-4、10-3倍时仍可见特异性扩增条带,即该一步法双重RT-PCR鉴别检测方法对猪源BVDV、CSFV、BVDV/CSFV混合RNA的检测灵敏度分别为0.95 ng、0.85 ng、8.0 ng,表明该猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法具有良好的敏感性。
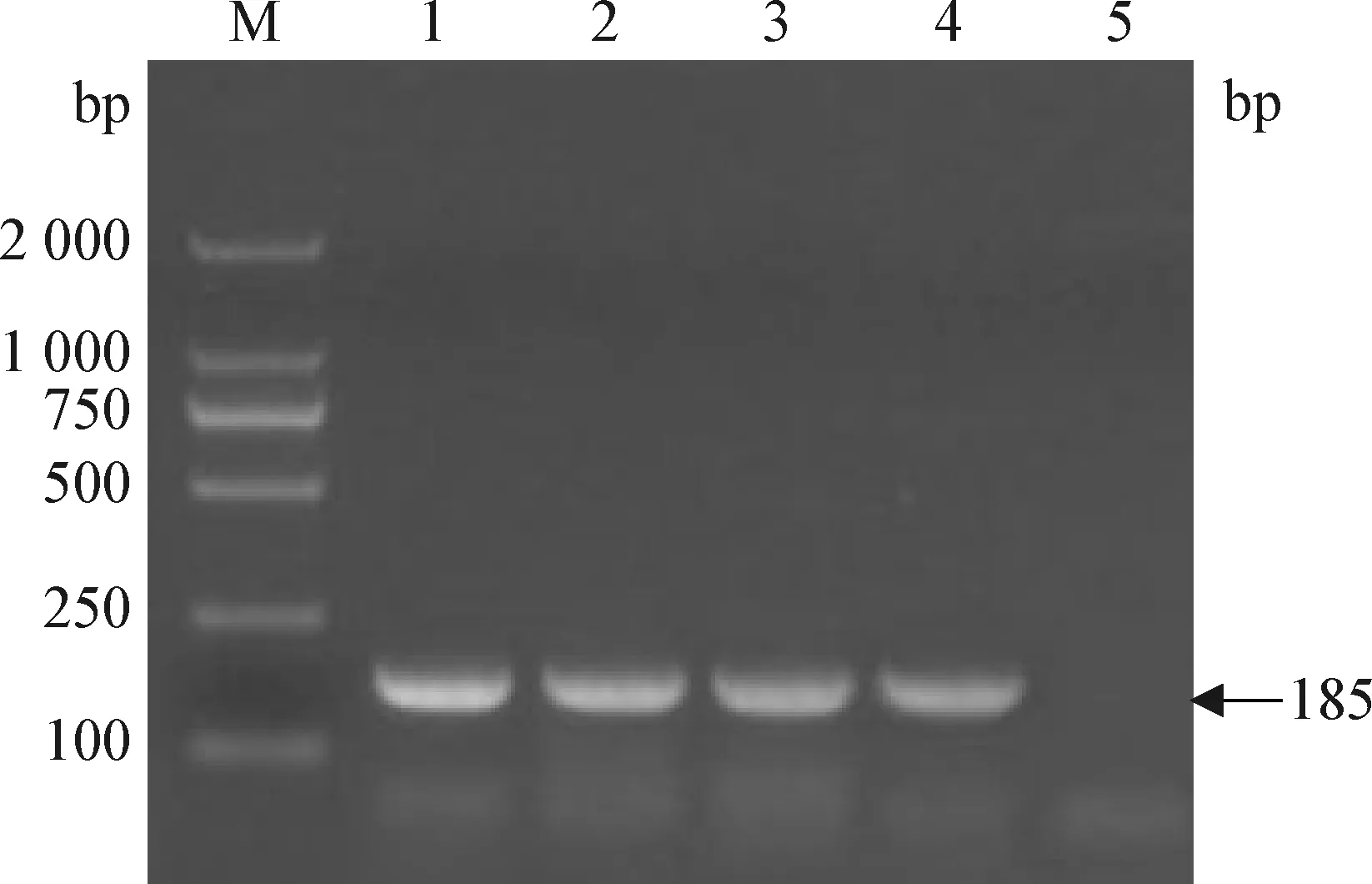
图2 猪源BVDV敏感性试验结果Fig.2 Result of sensitivity test of BVDV from pigM: DL-2 000 marker; 1: RNA 10-1倍稀释; 2: RNA 10-2倍稀释; 3: RNA 10-3倍稀释; 4: RNA 10-4倍稀释; 5: RNA 10-5倍稀释M: DL-2 000 marker; 1: RNA 10-1 dilution; 2: RNA 10-2 dilution; 3: RNA 10-3 dilution; 4: RNA 10-4 dilution; 5: RNA 10-5 dilution
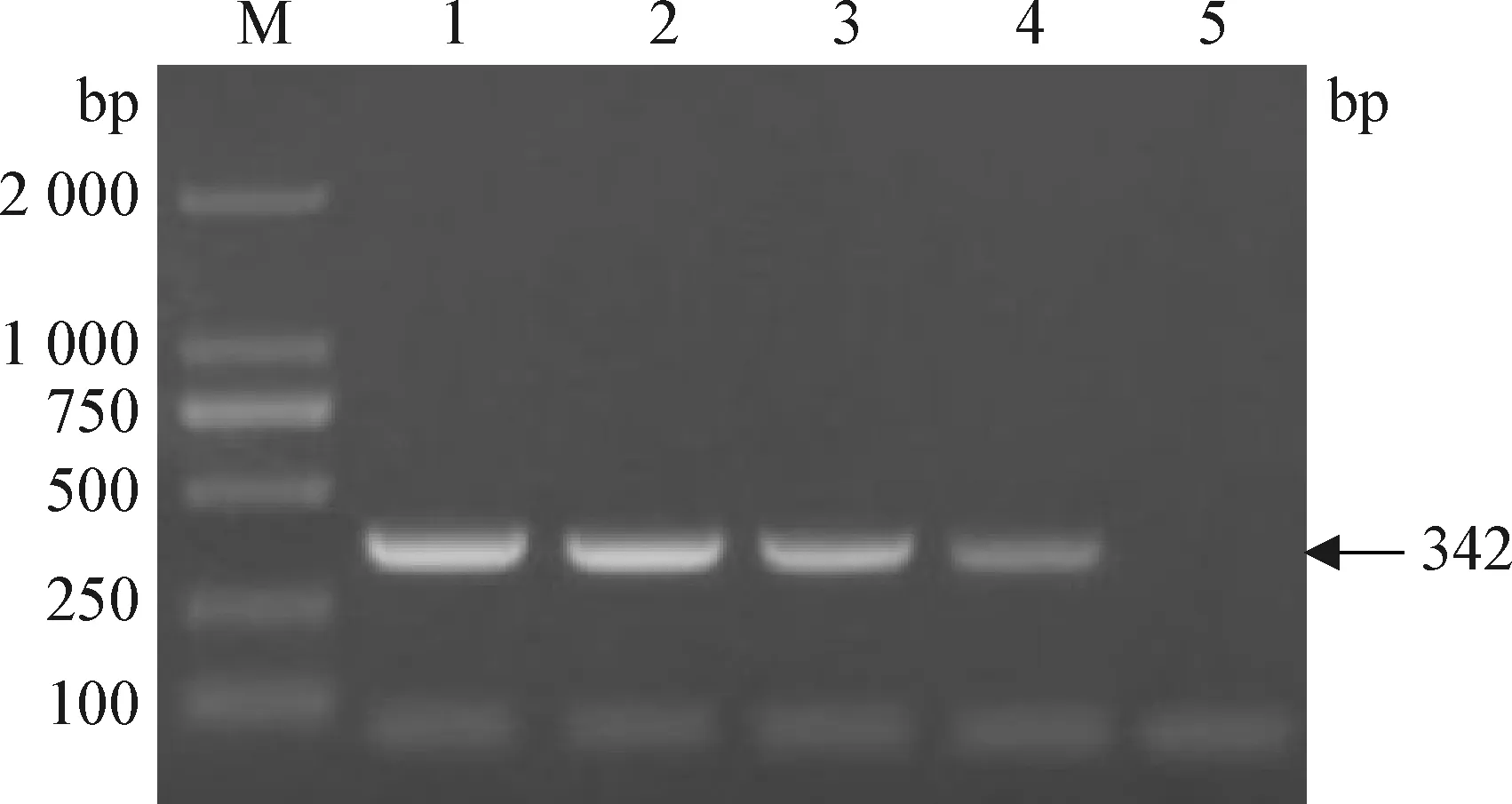
图3 CSFV敏感性试验结果Fig.3 Result of sensitivity test of CSFVM: DL-2 000 marker; 1: RNA 10-1倍稀释; 2: RNA 10-2倍稀释; 3: RNA 10-3倍稀释; 4: RNA 10-4倍稀释; 5: RNA 10-5倍稀释M: DL-2 000 marker; 1: RNA 10-1 dilution; 2: RNA 10-2 dilution; 3: RNA 10-3 dilution; 4: RNA 10-4 dilution; 5: RNA 10-5 dilution
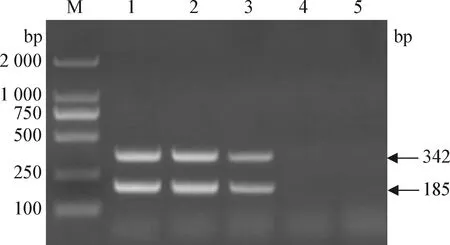
图4 BVDV/CSFV敏感性试验结果Fig.4 Result of sensitivity test of BVDV/CSFVM: DL-2 000 marker; 1. RNA 10-1倍稀释; 2: RNA 10-2倍稀释; 3: RNA 10-3倍稀释; 4: RNA 10-4倍稀释; 5: RNA 10-5倍稀释M: DL-2 000 marker; 1: RNA 10-1 dilution; 2: RNA 10-2 dilution; 3: RNA 10-3 dilution; 4. RNA 10-4 dilution; 5: RNA 10-5 dilution
2.6 重复性试验 该方法分别在3个不同时间重复检测BVDV、CSFV、猪源BVDV/CSFV、3份猪源BVDV感染病料、3份CSFV感染病料、3份猪源BVDV和CSFV均阴性病料、PRRSV、PRV、PPV、PCV-2、PEDV、JEV、TGEV 3次,3次检测结果均完全一致,表明该猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法具有良好的重复性。
2.7 临床应用 利用猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法检测采集于南充及周边地区的94份疑似猪瘟病毒感染病料样品,共检测出猪源BVDV阳性样品14份,阳性感染率为14.89%,CSFV阳性样品23份,阳性感染率为24.47%,猪源BVDV/CSFV混合感染样品5份,混合感染率为5.32%。该猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法与猪源BVDV一步法RT-PCR检测方法、CSFV一步法RT-PCR检测方法的检测结果完全一致,符合率均为100%。表明该猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法具有良好的临床适用性。
3 讨论
鉴于猪源BVDV与CSFV的抗原交叉性、免疫学交叉反应性、引起临床特征的高度相似性以及猪瘟对我国养猪业危害的严重性,加强猪源BVDV与CSFV的鉴别诊断对我国当前猪病的整体防控尤为必要。PCR技术能够检测到病原体特定的核苷酸序列,且具有操作简单、检测快速、特异性强、敏感性高等优点,是当前动物疫病临床诊断和流行病学应用最为广泛的分子生物学诊断技术,邓宇等[10]和刘梅芬等[11]均已经分别建立了检测猪源BVDV、CSFV的PCR方法,但常规PCR方法只能检测1种致病原,无法满足猪源BVDV、CSFV的鉴别诊断。双重PCR方法是在常规PCR方法中利用2种不同的特异性检测引物同时进行PCR扩增,能够同时快速、准确的鉴别检测出2种致病原,且没有改变检测时间和检测工作量的前提条件下将检测成本减少一半,其特别适合于临床病例的快速诊断和流行病学监测。同时,由于猪源BVDV和CSFV均为RNA病毒,其在进行PCR扩增前要将病毒核酸RNA反转录合成cDNA,操作繁琐,增加了检测时间,而一步法RT-PCR将反转录过程和PCR扩增过程在同一个体系中通过一步反应即可完成,大大节省了检测时间和工作量。鉴于此,本试验将双重PCR技术、一步法RT-PCR扩增技术引入到猪源BVDV和CSFV的鉴别检测中,经一步法双重RT-PCR反应条件的不断优化,建立了鉴别检测猪源BVDV和CSFV的一步法双重RT-PCR方法。该猪源BVDV和CSFV的一步法双重RT-PCR鉴别检测方法使用商品化的一步法RT-PCR扩增试剂盒,虽然增加了检测成本,但也大大节省了时间,减少了操作步骤,在拿到临床样品后3 h内即可鉴别检测出猪源BVDV和CSFV。
由于猪源BVDV和CSFV的核苷酸同源性非常高,增加了猪源BVDV和CSFV鉴别检测引物设计的难度,5′UTR基因是瘟病毒中最保守的基因,成为了猪源BVDV和CSFV检测引物设计的首选基因,故本试验选择猪源BVDV和CSFV的5′UTR序列设计检测引物。而鉴别检测引物要求有很好的特异性,本试验在分析多株猪源BVDV和CSFV 5′UTR保守区序列后,选择二者差异序列分别设计特异性鉴别检测引物,经一步法RT-PCR反应条件的优化,在分别建立猪源BVDV一步法RT-PCR方法和CSFV一步法RT-PCR方法的基础上,将2种引物等量混合,通过双重一步法RT-PCR反应条件的优化,建立了鉴别检测猪源BVDV与CSFV的一步法双重RT-PCR方法,根据扩增片段大小的不同实现了猪源BVDV和CSFV的鉴别检测。后期试验结果证实,该鉴别检测方法具有非常高的特异性,其扩增猪源BVDV仅出现1条185 bp的特异性条带,扩增CSFV仅出现1条342 bp的特异性条带,而同时扩增猪源BVDV和CSFV可同时出现185 bp和342 bp的2条特异性条带。
应用猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法对采集于南充及周边地区的94份疑似猪瘟病毒感染病料样品进行检测,猪源BVDV阳性感染率为14.89%,CSFV阳性感染率为24.47%,猪源BVDV/CSFV混合感染率为5.32%,表明南充及周边地区猪群中存在猪源BVDV与CSFV的感染与流行,且同时存在猪源BVDV与CSFV的混合感染,应引起重视。
综上,本试验建立的猪源BVDV和CSFV一步法双重RT-PCR鉴别检测方法可用于临床病料样品中猪源BVDV和CSFV的快速鉴别检测,非常适用于一般实验室鉴别检测猪源BVDV和CSFV,为基层兽医工作者开展猪源BVDV和CSFV的临床鉴别诊断和流行病学监测提供了一种简单、有效的分子生物学鉴别检测方法,为我国猪源BVDV和CSFV的有效防控提供了技术支持。
