猪流行性腹泻病毒GDsg株的分离鉴定及遗传进化分析
2022-01-18董建国陈明睿何书海焦凤超易本驰赵攀登
董建国 , 饶 丹 , 陈明睿 , 何书海 , 焦凤超 , 陈 斌 , 易本驰 , 黄 立 , 赵攀登
(1.信阳农林学院牧医工程学院 , 河南 信阳 464000 ; 2.河南牧业经济学院动物医学院 , 河南 郑州 450046)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种肠道致病性疾病,其临床主要表现为腹泻、呕吐和脱水,以及造成小肠肠道扩张,肠绒毛萎缩、脱落,肠壁弹性消失等病理变化[1]。该病对哺乳仔猪致死性高,死亡率可达100%[2-3]。1971年,英国首次暴发PED,随后在欧洲和亚洲许多国家相继报道[4]。2010 年,PEDV变异毒株在我国出现,给我国养猪业造成重大损失[5]。
PEDV属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus) α冠状病毒亚属,为单股正链RNA病毒[6]。PEDV全基因组约为28kb,依次由5′端帽子结构(Cap)、7个开放阅读框(Open reading fragment,ORFs) 以及含PolyA尾的3′端组成[7]。7个ORFs编码情况为:ORF1a和ORF1b位于5′端后,约占全基因组的2/3,编码非结构蛋白;其余5个开放阅读框依次为S基因编码结构蛋白S(Spike)、ORF3基因编码非结构蛋白ORF3、E基因编码包膜蛋白E、M基因编码膜蛋白M、N基因编码核衣壳蛋白N[8]。S蛋白表面包含多种抗原表位,在病毒识别进入宿主细胞中具有重要作用[9-10]。具有代表性的抗原表位主要为:中和抗原表位COE(499~638 aa)、2个B细胞抗原表位S1D5(744~759 aa)和S1D6(756~771 aa)、2个线性抗原表位SS2(748~755 aa)和SS6(764~771 aa)[11]。基于S基因的同源性分析可将其分为S1和S2两个区域。S基因具有很强的变异性,且其变异性主要集中在S1的N端,根据其变异性可将PEDV分为经典型和变异型2种类型[12]。因此,S基因在PEDV的研究中具有重要意义,其被广泛地应用于亚单位疫苗、基因工程疫苗及PEDV抗体检测试剂盒的研发当中。
为了解我国广东地区PEDV的流行及变异情况,本实验室于2015年1月从广东省韶关市某中大型养猪场大面积暴发仔猪腹泻死亡的肠道及粪便样本中检测出PEDV阳性,并成功在Vero细胞上分离出PEDV毒株并命名为GDsg株。通过对其全基因测序并与其他PEDV代表性毒株进行序列比对及进化树分析,进而分析其与我国现流行毒株的相似性,从而了解广东省PEDV的流行趋势。
1 材料与方法
1.1 病料采集 广东省韶关市2015年疑似暴发PEDV某猪场自然发病仔猪,采集小肠及内容物于-80 ℃储存。
1.2 细胞、菌体及载体 本试验使用Vero细胞由华南农业大学国家生猪种业工程技术研究中心猪病防控研究室保存;克隆宿主菌Trans5α化学感受态细胞和pEASY-Blunt Simple Cloning Kit®克隆载体,均购自北京全式金生物技术有限公司。
1.3 试剂 病毒DNA/RNA提取试剂盒,购自广州Magen公司;反转录试剂盒和Wizard SV Geland PCR Clean-Up System 胶回收试剂盒,均购自Promega公司;DNA Marker DL2 000,购自广州东盛生物科技有限公司;EB替代染料,购自广州华奇盛有限公司;全基因序列扩增高保真酶PrimeSTAR®HS DNA Polymerase,购自TaKaRa生物工程公司;DMEM细胞培养液、澳洲胎牛血清、双抗、无EDTA胰酶,均购自Thermo Fisher生物公司。
1.4 引物设计合成 根据GenBank上发布的PEDV序列,通过生物信息学分析选取S基因保守区间设计特异性鉴定引物(表1)对PEDV进行鉴定。并根据已发表的CV777毒株等PEDV全基因序列及参考相关文献设计用于PEDV全基因扩增的14对引物[13](表2)。引物均由生工生物工程上海(股份)有限公司合成。


1.5 病料处理及PCR检测 将采集的发病仔猪小肠及内容物剪碎,加入1 mL PBS研磨,研磨液移至1.5 mL离心管中。4 ℃下12 000 r/min离心10 min,取上清液于0.22 μm 微孔滤器过滤除菌。取滤液220 μL用于病毒DNA/RNA的提取,剩余滤液存储于-80 ℃中。对提取的病毒核酸进行有关PEDV、PRRSV、PPV和CSFV的RT-PCR检测以及PRV、PCV2和PCV3的常规PCR检测。
1.6 病毒分离纯化及间接免疫荧光试验 在37 ℃含5% CO2细胞培养箱下使用12孔细胞培养板培养Vero细胞,待细胞长至单层铺满时弃上清,PBS洗3次,接种50 μL滤膜过滤无菌的病料研磨液,加入100 μL无血清、含2%双抗的DMEM培养液,37 ℃ 5% CO2细胞培养箱下培养,72 h后约90%细胞出现明显细胞病变效应(CPE)。收集细胞并对细胞反复冻融3次,离心后弃掉细胞碎片,将收集的病毒进行蔗糖密度梯度离心纯化,并存储于-80 ℃。为了进一步鉴定出现CPE的细胞感染了PEDV,同时将做的重复孔细胞用无水乙醇固定20 min,PBS洗涤3次,每次3 min;加入抗PEDV M蛋白单克隆抗体,室温孵育1 h;PBS洗涤3次,每次3 min;加入FITC标记的二抗,避光,室温孵育1 h;PBS洗涤3次,每次3 min;加入荧光猝灭剂,制作片子并在荧光显微镜下观察。
1.7 病毒接毒传代 在37 ℃含5% CO2细胞培养箱下使用25 mL细胞培养瓶培养Vero细胞。待细胞长至单层铺满时弃上清,PBS洗3次,接种200 μL病毒液,加入100 μL无血清、含2%双抗的DMEM维持液5 mL,置于37 ℃ 5% CO2细胞培养箱中培养。3~5 d后约90%细胞出现明显CPE。反复冻融3次收样并存储于-80 ℃。重复此方法对病毒进行传代。
1.8 病毒RNA提取及反转录 取在Vero细胞上分离到的第3代GDsg株200 μL,根据 Magen 公司产品试剂盒进行病毒核酸提取,然后根据Promega 反转录试剂盒对所提取的病毒核酸进行反转录。
1.9 PEDV GDsg株全基因组扩增 使用 TaKaRa 生物工程公司PrimeSTAR®HS DNA Polymerase高保真酶对目的片段进行扩增。扩增体系为 50 μL:PrimeSTAR HS DNA Polymerase 0.5 μL,5×PrimeSTAR Buffer 10 μL,dNTP Mixture 4 μL,cDNA 模板 4 μL,上游引物 2 μL,下游引物 2 μL,RNase Free H2O 27.5 μL。PCR 扩增程序:98 ℃预变性 2 min;98 ℃变性 10 s,56 ℃退火 60 s,72 ℃延伸 30 s/kb,35 个循环;72 ℃延伸 10 min。将 PCR 产物进行 1%琼脂糖凝胶电泳。
1.10 PEDV GDsg株全基因组测序 PCR 扩增产物通过 1% 琼脂糖凝胶电泳鉴定后,使用胶回收试剂盒对目的片段进行胶回收。然后连接到pEASY-Blunt Simple Cloning Vector 上。经过转化挑菌鉴定后送往测序公司进行测序。
1.11 序列比对分析 利用 DNASTAR.Lasergene.v 7.1、Mega 5.0及Clustal X 软件将分离的毒株全基因组与国内外分离毒株进行序列比对并构建进化树,并分别将S基因序列和氨基酸序列与其他国内外代表毒株的S基因序列和氨基酸序列进行比对分析。PEDV 代表毒株基因序列均来源于GenBank。
2 结果
2.1 病料样品RT-PCR检测 使用PEDVS基因检测引物S1将采集样品处理好后提取核酸进行RT-PCR检测,通过琼脂糖凝胶电泳证明检测结果为阳性(图1)。
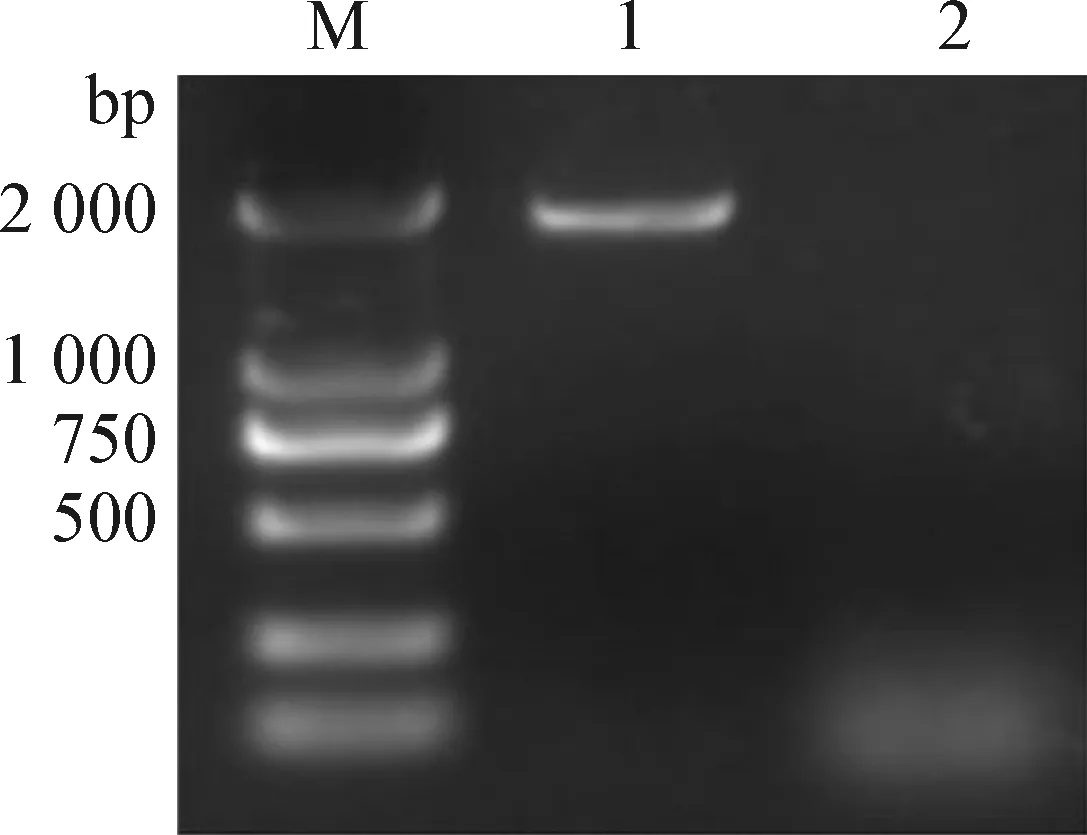
图1 PEDV S基因的扩增Fig.1 Amplification of PEDV S geneM:DNA分子质量标准; 1:样品; 2:阴性对照M:DNA marker DL2 000; 1:Sample; 2:Negative control
2.2 病毒分离纯化与鉴定 将处理好的病料滤液接种至Vero细胞上,传代培养至第4代,Vero细胞出现明显CPE时进行免疫荧光鉴定,结果显示接毒组细胞出现特异性的荧光(图2),表明病毒分离成功。收集细胞液进行蔗糖密度梯度离心纯化,将纯化获得的病毒提取核酸进行全基因测序。
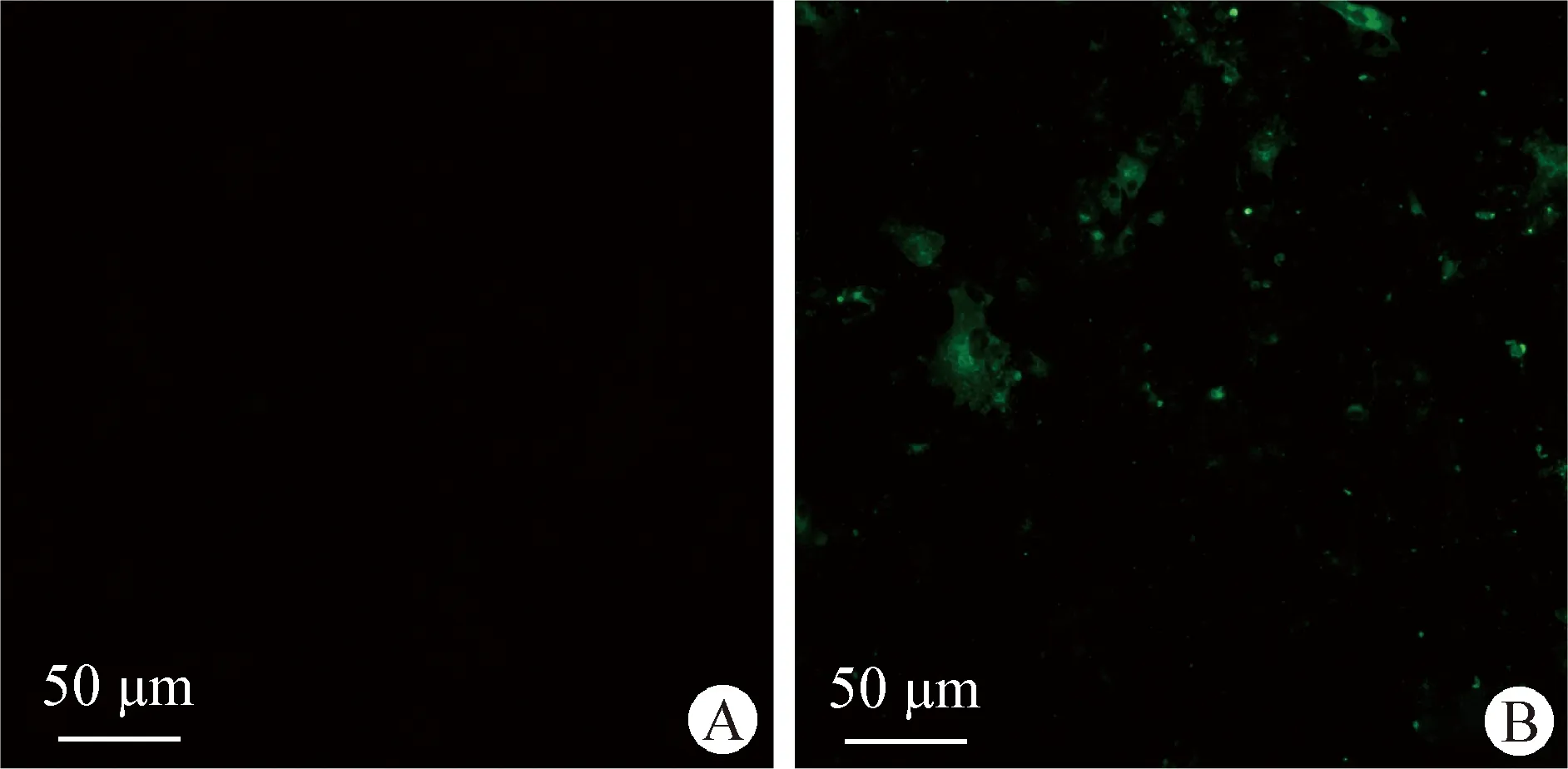
图2 PEDV致Vero细胞病变Fig.2 Cytopathic effect of PEDV on Vero cellA:正常细胞; B:接种病猪肠道内容物的细胞A:Normal cell; B:Cells inoculated with intestinal contents of diseased pigs
2.3 PEDV GDsg株全基因进化树构建分析 运用生物进化分析软件Mega 5.0和Clustal X对GDsg株进行全基因进化树构建(图3)。进化树构建所使用国内外参考毒株均从GenBank上下载。如图3进化树分析所示,分离株GDsg株与GII型GIIa亚型的代表毒株AJ1102距离较近,应属于GII型GIIa亚型毒株,属于流行变异毒株。
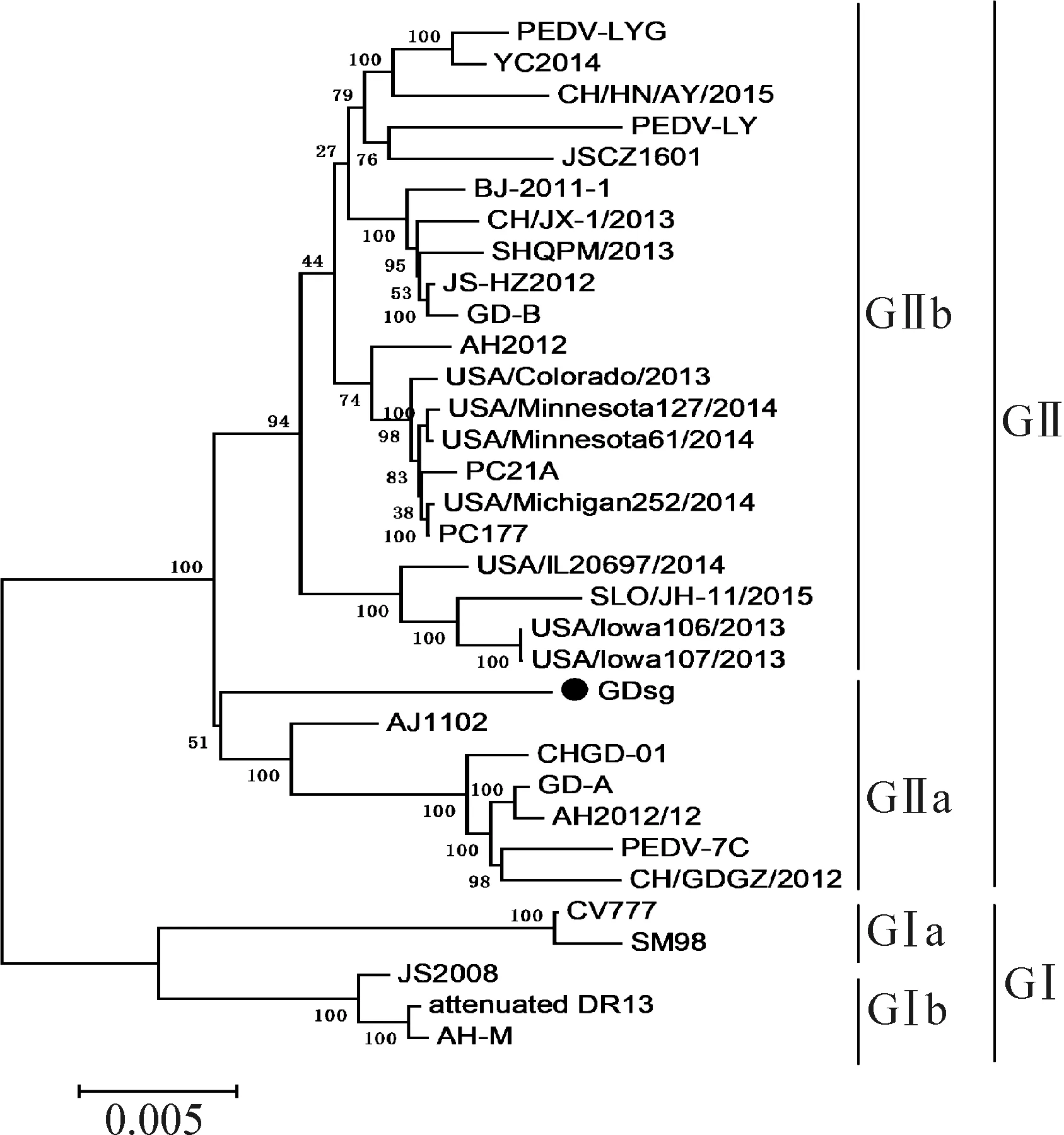
图3 PEDV GDsg株全基因组进化树分析Fig.3 Analysis of whole-genome evolutionary tree of PEDV GDsg strain●:本试验分离的毒株●:The strains isolated in this experiment
2.4 PEDV GDsg株全基因组同源性分析 运用生物进化分析软件DNASTAR.Lasergene.v 7.1中的MegAlign对PEDV GDsg株进行全基因组同源性进化分析(图4)。GDsg株与经典株GIa亚型代表毒株CV777的同源性为96.6%,同源性最低;与经典株GIb亚型代表毒株attenuated DR13同源性为97.1%;与变异株GIIa亚型代表毒株GHGD-01同源性为98.2%,同源性最高。此结果进一步证明GDsg株属于变异株GIIa亚型毒株。
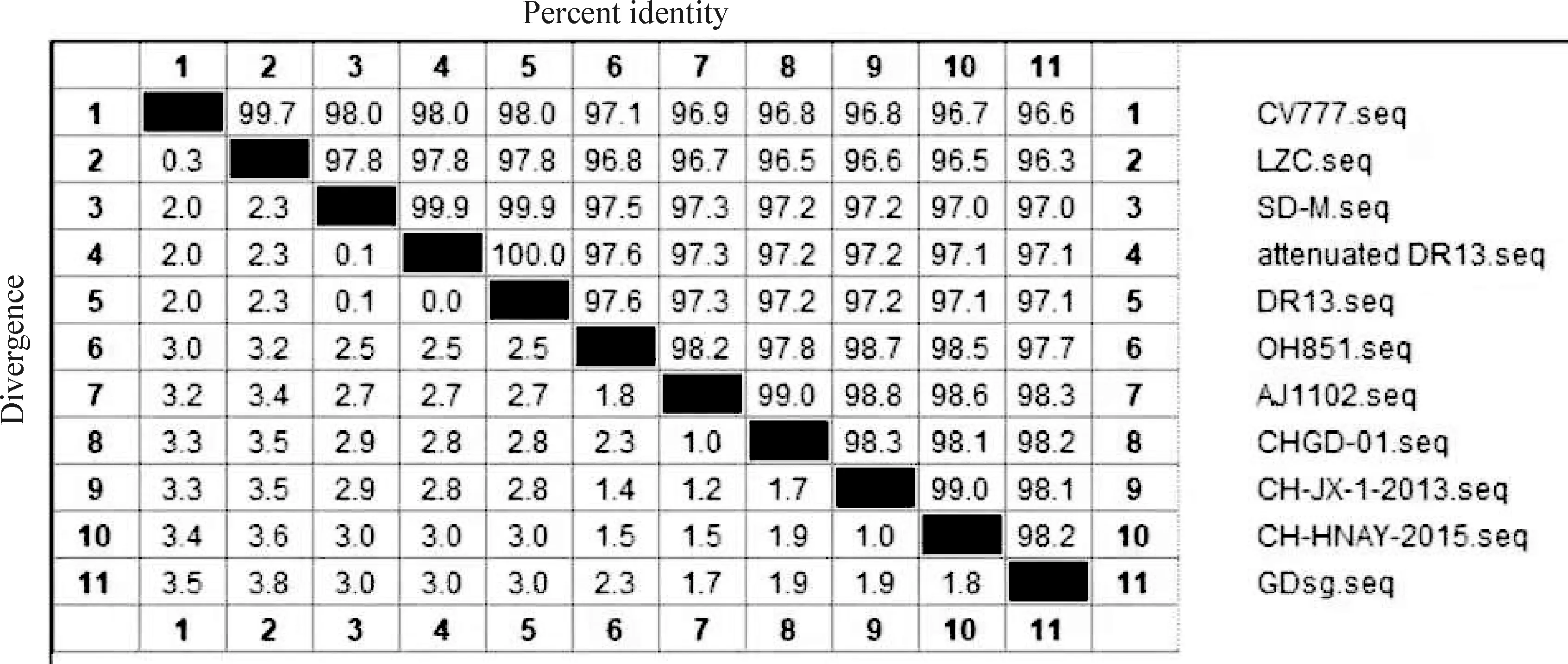
图4 PEDV GDsg株全基因组同源性分析Fig.4 Homology analysis of whole-genome of PEDV GDsg strain
2.5 PEDV GDsg株S基因氨基酸抗原表位分析 运用生物进化分析软件DNASTAR.Lasergene.v 7.1中的MegAlign对PEDV GDsg株的S基因氨基酸序列进行比对分析。结果显示,与经典株GIa亚型代表毒株CV777相比,在中和抗原表位COE区间GDsg有6个氨基酸突变,分别为522(A/S)、526(H/Y)、554(T/S)、599(G/S)、634(P/T)和638(Q/E),无氨基酸插入和缺失;在线性表位SS2区间GDsg无氨基酸突变、插入和缺失;在线性抗原SS6区间GDsg有1个氨基酸发生突变,为769(L/S),无氨基酸插入和缺失。
3 讨论
自1971年PED首次感染育肥猪在英国报道后,很快就传播至欧洲其他国家及亚洲国家[3]。2010年10月,变异型PEDV毒株在我国南方出现并迅速传播至全国各地,造成大面积哺乳仔猪死亡,死亡率高达80%~100%,给我国养猪业造成重大经济损失[5]。目前,PEDV的防控主要通过疫苗免疫和生物安全两方面来进行。用于PEDV防控的疫苗有基于经典毒株和变异毒株的灭活疫苗、弱毒疫苗、亚单位疫苗等多种,但至今尚无有效的疫苗能够控制PEDV的传播。另一方面,由于PEDV为RNA病毒,疫苗的混乱使用反而加剧其不断变异的可能性,这也可能是造成2010年变异毒株出现的原因,也使得PEDV的防控更加艰难[14-15]。
本试验在Vero细胞中成功分离出PEDV GDsg毒株,通过RT-PCR进行全基因序列的分段扩增并克隆至测序载体上进行全基因测序。最后通过生物学进化分析软件,与GenBank上已发布的相关PEDV毒株进行基因进化分析及同源性分析。分析结果显示,GDsg株与PEDV变异株GIIa亚型代表毒株AJ1102同源性最高,为98.3%,且进化分析位于同一分支上。表明PEDV在广东地区变异毒株流行,给养猪业造成防控压力,并随着其传播有增大PEDV变异的可能性。
PEDV变异毒株的出现主要是由于S基因的变异所造成的。S基因编码的蛋白成为纤突蛋白,位于病毒粒子的最外层,为I型跨膜糖蛋白。由于其位于病毒粒子的最外层,PEDV的抗原表位主要集中在S蛋白表面[16-17]。通过对S蛋白氨基酸序列比对分析得出,与经典毒株CV777相比,GDsg株在中和抗原表位COE区间有6个氨基酸的发生突变,分别为A522S、H526Y、T554S、G599S、P634T和Q638E;在线性抗原表位SS6区间有1个氨基酸发生突变,为L769S。这些突变可能会影响免疫原性,从而导致疫苗免疫失败,造成PED的暴发,进而造成更大的变异。
本试验结果表明,GDsg株为PEDV变异株GIIa亚型毒株。通过对GDsg株的测序比对分析,一方面可对广东省PEDV的流行状况进行了解,根据其变异趋势提出合理有效地防控方案;另一方面可根据其抗原表位的突变情况设计相应合理的亚单位疫苗方案,从而有效地阻止PEDV的传播。
