猫杯状病毒蚀斑纯化方法的建立
2022-01-18赵静杰刘子宁肖发沂贾亚雄梁瑞英崔尚金
赵静杰 , 梁 琳 , 刘子宁 , 肖发沂 , 贾亚雄 , 梁瑞英 , 崔尚金
(1. 中国农业科学院北京畜牧兽医研究所 , 北京 海淀 100193 ; 2. 农业农村部兽用药物与诊断技术 北京科学观测实验站 , 北京 海淀 100193 ; 3. 山东畜牧兽医职业学院 , 山东 潍坊 261061)
猫杯状病毒(Feline calicivirus,FCV) 属于杯状病毒科水疱疹病毒属,为无囊膜单股正链RNA病毒,是引起猫科动物呼吸道疾病的一种常见病原。目前,该病毒可跨物种传播,呈世界分布[1-2]。FCV不仅对宠物猫造成严重的健康威胁,同时也威胁着虎、狮、豹等野生猫科动物的健康[3-4]。猫疱疹病毒Ⅰ型(Feline herpesvirus type 1,FHV-1) 属于疱疹病毒科,为有囊膜的线性双链DNA病毒,主要引起猫传染性鼻气管炎[5]。两者临床症状相似,主要表现为呼吸啰音、鼻眼浆液性或脓性分泌物增多等呼吸道症状[6]。口鼻眼拭子是进行FCV病原学诊断或病毒分离常见的病料,但病料中常含有其他病原体微生物,这给病毒的分离纯化带来了困难[7]。目前,常见的病毒分离纯化技术有血清中和试验、不同宿主细胞增殖试验和蚀斑纯化。血清中和试验是通过加入特定抗原的抗体来中和混合样品中的特定抗原,该方法适用于不同抗原间无抗体交叉反应的情况,相对来说成本较高,且市面上抗体质量参差不齐,试验效果较难把控[8]。不同宿主细胞增殖试验是利用不同病毒对宿主细胞噬性不同完成病毒筛选及纯化的。其中一种病毒能在某种细胞上增殖,而其他病毒则不能,如此多次重复操作,可得到纯化的单一病毒。FCV和FHV-1均可以在F81及CRFK等猫肾传代细胞中良好增殖,所以不能利用该方法完成FCV和FHV-1的分离纯化[9-11]。本试验对F81细胞纯化FCV的条件进行优化摸索,旨在建立简单、快速高效的病毒分离纯化方法,通过建立FCV蚀斑纯化方法,为FCV后续试验奠定基础,同时也为其他病毒的分离纯化提供借鉴。
1 材料与方法
1.1 样品来源及处理 病料取自大连某宠物医院疑似病例口鼻眼拭子,将拭子放于1 mL灭菌 PBS中(含青霉素100 U/mL和链霉素100 μg/mL)涡旋振荡,37 ℃ 培养箱中静置 1 h,弃去棉拭子,将拭子悬液放于-20 ℃ 冰箱备用。
1.2 细胞及主要试剂E.coliDH5α 感受态细胞,购自全式金公司;PrimeSTAR Max DNA Polymerase为TaKaRa产品;柱式质粒小量抽提试剂盒、通用型DNA胶回收试剂盒,均购自OMEGA公司;病毒RNA提取试剂盒为艾德莱产品;反转录试剂盒为TIANGEN产品,购自北京汇百惠生物科技中心;2×DMEM细胞培养液为SIGAMA产品;胎牛血清(FBS)为Gibco产品;中性红染色液(0.33% 过滤除菌,活细胞染色),购自北京索莱宝科技有限公司。低熔点琼脂糖为SIGAMA产品;PBS缓冲液为Gibco产品。
1.3 引物设计 根据GenBank中公布的FCV基因序列,利用MAGA 7.0对比各个序列之间差异,使用DNAMAN 和DNASTAR进行引物设计,同时参考文献[12]报道的FHV-1鉴定引物,引物由北京擎科生物科技有限公司合成,引物序列见表1。
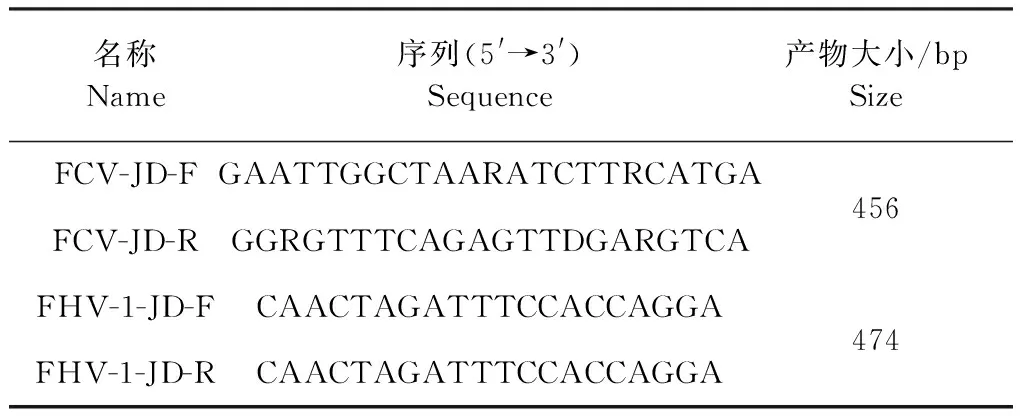
表1 FCV和FHV-1基因扩增鉴定引物Table 1 FCV and FHV-1 gene amplification and identification primers
1.4 病毒的分离 F81细胞长成单层后,弃生长液,用PBS洗涤2次,加入处理好的病毒液200 μL,37 ℃、5% CO2培养箱吸附90 min,每30 min摇晃1次。90 min后弃病毒液,加入含2% FBS的DMEM,37 ℃、5%CO2培养箱培养1~3 d,每12 h观察1次,细胞出现圆缩、脱落等明显细胞病变后收取细胞培养物,反复冻融3次后,收取细胞培养物进行下一步鉴定。
1.5 病毒RT-PCR鉴定 取200 μL细胞培养物,按照艾德莱病毒RNA提取试剂盒及病毒DNA提取试剂盒说明书提取病毒总RNA及DNA,RNA按照TIANGEN反转录试剂盒使用说明书进行反转录。20 μL反转录体系:5×FastKing-RT SuperMix 4 μL,RNA 2 μL,Rnase-Free ddH2O 14 μL。反转录程序:42 ℃ 15 min,95 ℃ 3 min。以反转录产物及提取的DNA为模板进行PCR扩增。FCV PCR反应体系(20 μL): PrimeSTAR Max DNA Polymerase 10 μL,FCV-JD-F 1 μL,FCV-JD-R 1 μL,cDNA 1 μL,ddH2O 7 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。FHV-1 PCR反应体系(25 μL):2×Taq Plus PCR Master Mix (Ⅱ) 12.5 μL,PCR Enhancer 1 μL,FHV-1-JD-F 0.5 μL,FHV-1-JD-R 0.5 μL,DNA 1 μL,dd H2O 9.5 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 10 s;53.1 ℃ 20 s;72 ℃ 30 s,35个循环;72 ℃ 5 min[12]。
1.6 FCV F81细胞蚀斑纯化方法的建立
1.6.1 F81细胞铺板剂量优化 将F81细胞制成1× 105、3×105、5×105、7×105、9×105个/mL的细胞悬液,接种于6孔板,每孔2 mL,于37 ℃、5% CO2培养箱培养24 h,每12 h观察细胞状态及铺板情况。
1.6.2 低熔点琼脂糖浓度的优化 用PBS分别配制2%、4%和6%的低熔点琼脂糖溶液,高压灭菌后,置于40~50 ℃水浴中备用;制备含5% FBS的2× DMEM,将两者按1∶1的比例混匀后,40~50 ℃水浴备用。低熔点琼脂糖溶液终浓度分别为1%、2%和3%,待细胞长成单层后,取10-1~10-8稀释度的混合病毒液200 μL分别接种到6孔板中,37 ℃、 5% CO2培养箱吸附90 min,每30 min晃动1次。 90 min后弃去病毒液,每孔加入2 mL第1层琼脂,观察第1层琼脂凝固情况。
1.6.3 第1层覆盖液铺板时间的优化 待F81细胞培养至致密单层。将混合病毒进行10倍倍比稀释,取10-1~10-8稀释度的混合病毒液200 μL接种到6孔板中,37 ℃、5% CO2培养箱吸附时间分别为30、60、90、120 min和180 min,到时间后弃去病毒液并用PBS洗2遍,每孔加入2 mL第1层覆盖液,待第1层覆盖液完全凝固后,置于37 ℃、5% CO2培养箱倒置培养,每12 h观察细胞是否出现圆缩、脱落等细胞病变。48 h后每孔加入2 mL第2层覆盖液(第2层覆盖液:5% FBS的2×DMEM和2%低熔点琼脂糖溶液等体积混合,添加0.01%中性红染色液),待第2层覆盖液完全凝固后,置于37 ℃、体积分数为5% CO2培养箱正置培养,每3 h观察蚀斑形成情况。
1.6.4 第2层覆盖液铺板时间的优化 确定第1层覆盖液铺板时间后,分别在完成第1层覆盖后24、36、48、56 h和72 h覆盖第2层覆盖液,待第2层覆盖液完全凝固后,置于37 ℃、体积分数为5% CO2培养箱正置培养,每3 h观察蚀斑形成情况。
1.6.5 蚀斑挑取、扩增及鉴定 待蚀斑形成后用修剪好的黄色枪头挑取噬斑,并放入500 μL 的无血清DMEM中,反复冻融3次后,取200 μL提取RNA,采用RT-PCR进行鉴定[13-14]。鉴定结果为FCV阳性的再次进行蚀斑试验,取上清继续克隆纯化,经3轮纯化并经RT-PCR鉴定,结果为FCV阳性且FHV-1阴性的病毒液扩大培养,-80 ℃保存备用。
2 结果
2.1 病毒的RT-PCR鉴定 混合病毒接种F81单层细胞后,发现F81细胞出现变圆、脱落,细胞聚集在一起呈葡萄串样典型细胞病变效应(CPE)。将收取的病毒培养液按照病毒RNA提取试剂盒及病毒DNA提取试剂盒说明书提取病毒总RNA及DNA,以获得的RNA及DNA为模板,进行FCV、FHV-1 PCR检测。PCR产物经凝胶电泳检测后显示,在456 bp及474 bp处分别出现特异性片段(图1)。表明病毒为FCV和FHV-1混合病毒。
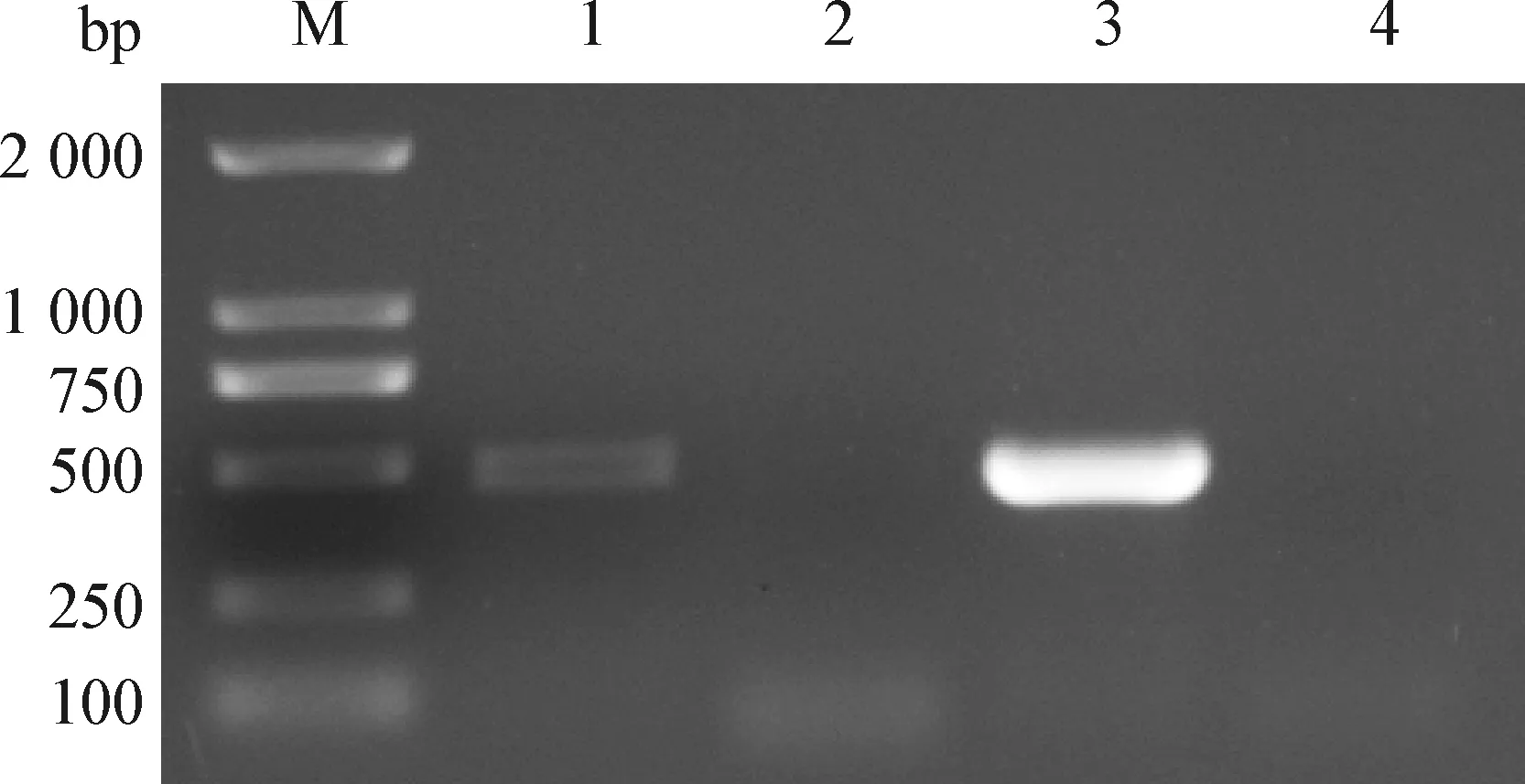
图1 FCV和FHV-1 PCR产物电泳结果Fig.1 Electrophoresis results of FCV and FHV-1 PCR productsM:DL-2 000 DNA相对分子质量标准; 1:FHV-1; 2:FHV-1阴性对照; 3:FCV; 4:FCV阴性对照M:DL-2 000 DNA Marker; 1:FHV-1; 2:FHV-1 negative control; 3:FCV; 4:FCV negative control
2.2 FCV F81细胞蚀斑纯化方法的建立
2.2.1 F81细胞铺板剂量优化 以每孔不同剂量的F81细胞铺6孔板,24 h后观察细胞状态及密度,结果显示铺板细胞数为1×105、3×105、5×105个/mL时,细胞未长满,中间间隙较多,无法满足蚀斑纯化的要求;铺板剂量为9×105个/mL,细胞过于密集,且培养基中有漂浮死细胞;最终确定铺板剂量为7×105个/mL,此剂量细胞状态良好,细胞呈紧密规则排列,适合进行蚀斑纯化试验。
2.2.2 低熔点琼脂糖浓度的优化 低熔点琼脂糖溶液终浓度为1% 时,第1层覆盖液凝固不佳,倒置培养过程中出现脱落情况;低熔点琼脂糖溶液终浓度为3%时,第1层覆盖液相对较硬;最终选取低熔点琼脂糖溶液终浓度为2%。
2.2.3 第1层覆盖液铺板时间的优化 结果显示,吸附时间30 min及60 min后铺第1层覆盖液,蚀斑数量较少;吸附时间120 min及180 min后铺第1层覆盖液,可能因更多的病毒完成吸附,使得细胞病变区域较多,不利于蚀斑的挑取;吸附时间为90 min时,蚀斑数适中,最终确定铺第1层覆盖液时间为病毒吸附90 min后。
2.2.4 第2层覆盖液铺板时间的优化 分别在完成第1层覆盖后24、36、48、56 h和72 h铺第2层覆盖液,其中24 h和36 h后铺第2层覆盖液,蚀斑较小,不易挑取,待蚀斑长大时,中性红颜色却变得不明显;56 h和72 h后铺第2层覆盖液,由于病变区域时间过长,蚀斑较多且大小不均;48 h后铺第2层覆盖液,3 h后便可在10-5稀释度观察到蚀斑(图2)。蚀斑呈圆形或类圆形,大小较均匀,直径为1.0~2.0 mm,边缘清晰。最终确定第2层覆盖液铺板时间为第1层覆盖液铺板48 h后,此时挑取蚀斑最佳。显微镜下观察,可见病毒在细胞单层上形成明显的局限性病灶(图3)。

图2 FCV感染F81细胞形成的蚀斑Fig.2 Plaque formed by FCV on F81 cellsA:接毒组; B:对照组A:Inoculation group; B:Control group

图3 FCV感染F81细胞形成的蚀斑 (40×)Fig.3 Plaque formed by FCV on F81 cells (40×)A:接毒组; B:对照组A:Inoculation group; B:Control group
2.2.5 蚀斑纯化后蚀斑的挑取及病毒鉴定 经过3轮蚀斑纯化,同样条件下均出现同样规律的蚀斑。取第3轮挑取的蚀斑病毒培养液,扩大培养后收取细胞培养液,按照病毒RNA提取试剂盒及病毒DNA提取试剂盒说明书提取病毒总RNA和DNA,以获得的RNA及DNA为模板,按照2.1方法进行FCV和FHV-1 PCR检测,PCR产物经凝胶电泳检测后显示,仅在456 bp处出现FCV特异性片段(图4),挑取蚀斑FCV RT-PCR检测阳性率为100%,且通过序列比对,纯化病毒无变异,表明FCV分离纯化成功。

图4 蚀斑试验后PCR鉴定结果Fig.4 PCR identification result after plaque testM:DL-2 000 DNA相对分子质量标准; 1:FHV-1; 2:FHV-1阴性对照; 3:FCV; 4:FCV阴性对照M:DL-2 000 DNA Marker; 1:FHV-1; 2:FHV-1 negative control; 3:FCV; 4:FCV negative control
3 讨论
FCV在猫群中感染率较高,主要引起猫口腔溃疡和上呼吸道疾病[15]。流行病学调查试验表明,FCV常和FHV-I、猫细小病毒等病原混合感染[16],从临床发病或者死亡的猫中获得的病料常常存在多种病毒,除FCV外,其他病毒大多也在细胞上增殖,这大大影响了病毒的分离、病毒滴度测定及生物学特性等试验。
1952年,Dulbecco将噬菌体空斑技术应用于动物病毒学,病毒蚀斑技术(Virus plaque formation)成为病毒纯化克隆和病毒生物学特性试验的常见方法[17]。病毒蚀斑的形成是由于病毒感染细胞后,在固体介质的限制下,释放的病毒只能由最初感染的细胞向周边扩展。经过几个增殖周期,便形成一个局限性病变细胞区[18]。目前,病毒蚀斑技术在病毒分离和病毒定量方面应用广泛,但宠物常见病毒的蚀斑纯化方法尚未报道。本试验利用梯度稀释法对混合毒进行稀释,然后依次铺两层琼脂覆盖液对混合毒进行纯化,并对FCV蚀斑形成条件进行优化摸索:(1) F81细胞铺板密度。细胞铺板密度过大会造成细胞过于密集甚至培养基中有漂浮死细胞,过小细胞未长满,中间间隙较多,无法满足蚀斑纯化的要求,细胞数为7×105个/mL,每孔2 mL为最适宜。(2)琼脂糖浓度。琼脂糖浓度大小直接影响覆盖液铺板成功与否,是蚀斑纯化关键因素之一,浓度过低时,第1层覆盖液凝固不佳,倒置培养过程出现脱落情况;浓度过高时,第1层覆盖液相对较硬,影响细胞透气,最终确定低熔点琼脂糖溶液适宜终浓度为2%,另外需要注意的是,琼脂糖现配现用,并避免反复高压。(3)覆盖液铺板时间。通过比较最终确定铺第1层覆盖液时间为病毒吸附90 min 后,第2层覆盖液铺板时间为第1层覆盖液铺板48 h后,此条件最终形成蚀斑数量及大小均适合挑取。添加第1、2层覆盖液时,速度要快,避免速度慢造成琼脂糖凝固,同时也要注意避免产生气泡,否则后期影响蚀斑观察。(4) 挑取蚀斑。由于FCV形成蚀斑相对较小,挑取蚀斑时应小心,避免碰触周围蚀斑。
本试验完成FCV蚀斑形成条件的优化并建立猫杯状病毒蚀斑纯化方法,该方法具有成本低、操作简单、试验周期短、纯化效率高等优点,4~5 d即可以完成病毒的纯化,有效解决了后续试验对纯净病毒的要求。本试验也为其他病毒的分离纯化提供了借鉴和方法。
